Содержание статьи
Введение
Доказано и не вызывает сомнения, что вакцинация является наиболее действенным методом иммунопрофилактики инфекционных заболеваний [1, 2]. Однако современный арсенал средств активной специфической иммунизации для предупреждения острых респираторных инфекций (ОРИ) ограничен вакцинами против гриппа, пневмококковой и Hib-инфекции, что определяет неподдельный интерес к средствам неспецифической иммунопрофилактики. При этом среди всех препаратов, используемых для неспецифической иммунопрофилактики острых и рекуррентных респираторных инфекций, особое место, благодаря высокой эффективности и безопасности, занимают бактериальные лизаты (БЛ) [3–20].
Клинико-терапевтическая и профилактическая результативность, профиль безопасности и переносимость БЛ у детей и взрослых хорошо изучены и имеют высокий уровень доказательности. При этом результаты многочисленных экспериментальных и клинических исследований отражены не только в отдельных публикациях [4, 6, 8, 9, 13, 19, 20], но и в метаанализах и систематических обзорах [10, 12, 14, 17, 18]. Благодаря полученным данным были сделаны выводы о высокой лечебно-профилактической эффективности БЛ, заключающейся в достоверном снижении частоты острых и рекуррентных инфекций, уменьшении продолжительности эпизодов обострений хронических и рецидивирующих заболеваний органов дыхания, а также в сокращении применения при этом антибиотиков и антипиретиков. Все авторы связывают отмеченную высокую терапевтическую результативность БЛ с их позитивным влиянием на различные звенья иммунитета [4, 6, 8–10, 12–14, 17–20]. Учитывая это, считаем целесообразным осветить основные расшифрованные иммунотропные эффекты БЛ и механизмы действия.
Механизм действия БЛ
Детальное понимание механизма действия БЛ стало возможным после получения доказательств выдвинутой ранее C.A.Jr. Janeway (1989, 1992) концепции о том, что микроорганизмы, независимо от их видовой и родовой принадлежности, обладают универсальными консервативными молекулами (Pathogen-Associated Molecular Patterns, РАМР), которые специфически распознаются врожденным иммунитетом [20–23]. Несмотря на то, что ранее мы уже излагали основные положения этой концепции [19, 24], считаем важным еще раз конспективно представить ее ключевые звенья. Это позволит более наглядно объяснить позитивные иммунологические эффекты БЛ. Выражаясь образно, можно сказать, что расшифровка молекулярных механизмов специфической детекции врожденным иммунитетом универсальных маркеров чужеродности микроорганизмов позволяет раскрасить уже известные фармакодинамические характеристики БЛ новыми и весьма интересными оттенками.
Благодаря тому, что удалось установить комплементарность определенных рецепторов нейтрофилов, моноцитов, тканевых макрофагов, дендритных клеток, натуральных киллеров конкретным молекулам универсальной патогенности, значительно расширились наши представления о врожденном иммунитете. Особо следует отметить, что в результате полученных неопровержимых данных коренным образом были пересмотрены традиционные представления о характере врожденного иммунитета. Доказано, что процесс распознавания «чужого» врожденным иммунитетом имеет четкую специфичность, поэтому ошибочно считать его неспецифическим. При этом специфическая идентификация «чужого» врожденным иммунитетом в корне отличается от специфического распознавания, которое осуществляется адаптивным иммунитетом [25].
Так, клетки врожденного иммунитета (нейтрофилы, циркулирующие моноциты, тканевые макрофаги, натуральные киллеры) специфически распознают РАМР, которые являются общими для различных микроорганизмов. В то же время клетки приобретенного иммунитета (Т- и В-лимфоциты) способны специфически верифицировать антигены — молекулярные структуры, которые являются исключительно индивидуальными для конкретных возбудителей. При этом важно отметить, что рецепторы клеток врожденного иммунитета, специфически распознающих «чужое», имеют одинаковое строение, что позволяет обнаружить консервативные структуры, общие для различных микроорганизмов. Указанные рецепторы принято обозначать как рецепторы, распознающие патогенный образ (Pattern Recognition Receptors, PRR). При этом установлено, что различные PRR, расположенные на поверхности клеток врожденного иммунитета, строго комплементарны определенным консервативным структурам микроорганизмов (специфичны к конкретным молекулам универсальной патогенности) [25]. На примере толл-подобных рецепторов (Toll-Like Receptors, TLR), которые относятся к PRR, подробнее остановимся на механизмах специфического распознавания РАМР-молекул, которые клетками врожденного иммунитета верифицируются как маркеры «чужого».
Так, установлена комплементарность TLR-2 протеогликанам, которые входят в состав клеточной стенки всех грамположительных бактерий. Следовательно, нейтрофилы, циркулирующие моноциты, тканевые макрофаги и дендритные клетки, на поверхности которых имеются TLR-2, будут специфически распознавать протеогликаны, представленные в структуре бактериальной стенки различных грамположительных бактерий (пневмококки, пиогенные и другие стрептококки, стафилококки и другие грамположительные микроорганизмы). Таким образом, обнаружение грамположительных микробов клетками врожденного иммунитета происходит благодаря специфическому взаимодействию их TLR-2 с протеогликанами клеточной стенки бактерий, которые распознаются как универсальные молекулы патогенности (РАМР). При этом комплементарность TLR-2 одинакова к протеогликанам всех (!) грамположительных бактерий.
В свою очередь, установление строгой комплементарности TLR-4 другой консервативной структуре клеточной стенки микробов — липополисахаридам, которые входят в наружную мембрану грамотрицательных бактерий (менингококк, гонококк, кишечная палочка, клебсиелла, легионелла и др.), позволило понять, каким образом клетки врожденного иммунитета распознают указанных возбудителей. При этом хотелось бы подчеркнуть, что специфическое распознавание «чужого» врожденным иммунитетом направлено исключительно на обнаружение консервативных структур, универсальных для различных микроорганизмов, а не на верификацию конкретного возбудителя. Строение рецепторов Т- и В-клеток, напротив, весьма вариабельно, благодаря чему и достигается их исключительная специфичность, направленная на верификацию не просто «чужого», общего для многих возбудителей, а непосредственно антигенов, характеризующих индивидуальные особенности конкретных микроорганизмов. Эта уникальная специфичность обусловлена огромным разнообразием структуры антигенраспознающих центров у рецепторов Т- и В-лимфоцитов. Указанная особенность строения рецепторов Т- и В-клеток (выраженная вариабельность антигенраспознающих центров) обусловлена процессами V(D)J-реанжировки (соматическая рекомбинация ДНК) и соматической гипермутации (точечные мутации), постоянно происходящими при дифференцировке и созревании лимфоцитов в ответ на антигенную стимуляцию. В результате достигается колоссальное разнообразие в строении рецепторов Т- и В-клеток, что и позволяет им распознавать исключительно комплементарный антиген из огромного их числа [25].
Кроме того, специфическое распознавание при реализации реакций врожденного и адаптивного иммунитета имеет свои характерные особенности конечного этапа этого процесса. Так, адаптивный иммунитет в результате специфического распознавания не только препятствует распространению возбудителя в организме при первичном его проникновении (тактическая задача), но и формирует иммунологическую память, которая обеспечивает высокоэффективную иммунологическую защиту, направленную против данной конкретной инфекции в дальнейшем (стратегическая задача). И в случае повторного проникновения данного возбудителя в организм он будет максимально быстро распознан и уничтожен благодаря сформированной ранее иммунологической памяти. Врожденный же иммунитет, в отличие от адаптивного, не формирует иммунологическую память. Поэтому каждый последующий раз при вторжении возбудителя в организм нейтрофилы, циркулирующие моноциты, тканевые макрофаги и натуральные киллеры будут заново распознавать универсальные молекулы патогенности, чтобы ликвидировать их носителей, решая тем самым, как и в первый раз, только тактическую задачу по защите организма от инфекции в момент ее проникновения [25].
Специфическое распознавание молекул РАМР (консервативные структуры, общие для различных возбудителей) PRR (TLR и др.) нейтрофилов, моноцитов, тканевых макрофагов, дендритных клеток и натуральных киллеров приводит к активации указанных клеток врожденного иммунитета и сопровождается повышением продукции и секреции различных иммунорегуляторных цитокинов (интерлейкины, интерфероны и др.), антимикробных пептидов и других биологически активных веществ. В результате этого не только возрастает функциональная активность врожденного иммунитета, что определяет эффективное уничтожение возбудителей на этапе их проникновения и первичного распространения в организме (решение тактической задачи), но и инициируется запуск процессов формирования приобретенного иммунитета. При этом благодаря активации клеток врожденного иммунитета и повышению продукции ими различных цитокинов ускоряется созревание дендритных клеток, что обеспечивает адекватную презентацию антигенов. Последнее, в свою очередь, приводит к активному размножению и быстрому созреванию тех Т- и В-лимфоцитов, рецепторы которых распознали антигены возбудителя. В результате значительно возрастает количество лимфоцитов с рецепторами, комплементарными только данным антигенам. При этом на конечном этапе В-лимфоциты трансформируются в плазмоциты, которые начинают вырабатывать антитела, а Т-лимфоциты — в специфические к антигенам данного возбудителя цитотоксические Т-лимфоциты. Одновременно некоторые Т- и В-лимфоциты, рецепторы которых оказались комплементарны антигенам возбудителя, навсегда «запоминают» структуру этих антигенов и становятся клетками иммунологической памяти. В результате создается эффективная иммунологическая защита (специфическая невосприимчивость) организма против данной инфекции на долгие годы и десятилетия (решение стратегической задачи) [25].
Учитывая вышеизложенное, можно более глубоко понять механизм действия БЛ. Так, стало ясно, что активация врожденного иммунитета под действием БЛ происходит в результате распознавания молекул универсальной патогенности, входящих в состав препаратов. Указанные РАМР-молекулы (протеогликаны, липополисахариды и другие консервативные структуры бактерий) распознаются PRR нейтрофилов, циркулирующих моноцитов, тканевых макрофагов, запуская реализацию описанных выше механизмов врожденного иммунитета, которые обеспечивают противоинфекционную защиту организма в период проникновения в него возбудителей и первичного их распространения — активируется фагоцитоз бактерий, блокируется репликация вирусов и т. д. Благодаря этому у пациентов, принимающих БЛ, снижается частота острых и рекуррентных респираторных инфекций, уменьшается число обострений хронических и рецидивирующих заболеваний органов дыхания [3–7, 9–12, 14–19, 24].
Особо следует подчеркнуть, что положительные иммунологические эффекты БЛ не ограничиваются только активацией врожденного иммунитета. Прием БЛ приводит также и к одновременному повышению функциональной активности адаптивного иммунитета. Это обусловлено тем, что цитокины, вырабатываемые активированными клетками врожденного иммунитета под действием БЛ, стимулируют созревание дендритных клеток и готовность их к презентации антигенов, в том числе и тех, которые входят в состав бактериальных лизатов. Антигенная презентация сопровождается инициацией реакций адаптивного иммунитета. Так, В-лимфоциты, рецепторы которых комплементарны презентируемым антигенам, начинают активно размножаться и в конечном счете трансформируются в плазмоциты. Последние, в свою очередь, начинают синтез и продукцию иммуноглобулинов, комплементарных распознанному антигену, т. е. специфических антител. Таким образом, за счет содержащихся в их составе антигенов лизированных бактерий и молекул универсальной патогенности БЛ активируют механизмы врожденного и адаптивного иммунитета, что сопровождается адекватным повышением противоинфекционной резистентности организма в целом. Подчеркнем, что увеличение синтеза и продукции антител в ответ на прием БЛ происходит преимущественно в системе местного иммунитета. В результате этого в слюне, назальной и трахеобронхиальной слизи создаются высокие концентрации специфических иммуноглобулинов против тех бактериальных возбудителей, антигены которых представлены в препаратах. Именно это стало основанием для введения такого названия, как мукозальные вакцины, для характеристики БЛ. Однако угасание указанных иммунологических эффектов в течение нескольких месяцев после отмены БЛ не позволяет рассматривать их в качестве полноценных вакцин, так как отсутствуют доказательства формирования ими полноценной иммунной памяти. Тем не менее существенное снижение частоты острых и рекуррентных респираторных инфекций, а также сокращение рецидивов хронических заболеваний органов дыхания [3–7, 9–12, 14–19, 24] даже после отмены препаратов говорит в пользу того, что антигены БЛ выступают в роли бустера для ранее уже сформированных клеток иммунной памяти. В то же время нельзя исключить, что сохраняющийся терапевтический эффект БЛ после окончания курса лечения обусловлен другими механизмами. В целом же можно сделать вывод, что высокая клиническая эффективность БЛ определяется их позитивным комбинированным влиянием на функциональное состояние как врожденного, так и адаптивного иммунитета.
Расшифровка механизмов действия БЛ позволила высказать предположение, что степень выраженности их иммуномодулирующих эффектов может быть связана с качеством и количеством в их составе неповрежденных фрагментов микробной стенки и антигенов бактерий. Анализ результатов исследований в этом направлении показал, что иммуногенность БЛ действительно зависит от этих параметров. В связи с этим был проведен поиск возможностей увеличения иммуногенности БЛ за счет изменения технологии бактериального лизиса. Было установлено, что замена химического разрушения бактерий на физический лизис (разрушение бактерий под действием высокого давления) позволяет уменьшить повреждение антигенов и фрагментов бактериальной стенки. Благодаря полученным результатам разработан и с успехом внедрен в практику поливалентный механический БЛ (ПМБЛ), характеризующийся высокой иммуногенностью. Последнее объясняется тем, что при изготовлении данного препарата применяется метод механического, а не химического лизиса бактерий, используемого в технологии изготовления всех остальных БЛ [9].
Поливалентный механический БЛ: иммуннологические эффекты и клиническая эффективность
В состав ПМБЛ (препарат Исмиген®) входят продукты механического лизиса возбудителей, которые наиболее часто вызывают бактериальные поражения органов дыхания: Streptococcus pneumoniae (серотипы: TY1, TY2, TY3, TY5, TY8, TY47), Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans, Klebsiella pneumoniae, Klebsiella ozaenae, Haemophilus influenzae b, Neisseria catarrhalis. Препарат выпускается в таблетках для сублингвального применения и разрешен для лечения и профилактики инфекций респираторного тракта у детей старше 3 лет и у взрослых [26]. Особенностью использования препарата является требование исключительно сублингвального приема таблеток. Считается, что это не только позволяет улучшить контакт иммуногенных компонентов БЛ со слизистой ротовой полости (часть слизистой всей дыхательной системы), но и предупреждает воздействие на препараты ферментов желудка и кишечника, что обеспечивает их более высокую
клинико-иммунологическую эффективность [9].
Основные иммунологические эффекты ПМБЛ, описанные в ходе клинических и экспериментальных исследований, представлены на рисунке 1. Считаем целесообразным обратить более подробное внимание на анализ результатов некоторых из них. Так, в исследовании В. Morandi et al. [13] установлено позитивное влияние ПМБЛ на дендритные клетки — ускорение их созревания и повышение функциональной активности. При этом указанные иммунотропные эффекты были более выражены у ПМБЛ, чем у молекулярных дериватов бактериальной стенки [13]. Особый интерес представляют также данные о том, что стимулирующее влияние препарата на дендритные клетки приводит к экспрессии молекул костимуляции Т-лимфоцитов (CD80, CD83), а также молекулярных маркеров зрелости антигенпрезентирующих клеток (CD86). В результате повышается чувствительность дендритных клеток к интерлейкину-2 (ИЛ-2), что определяет их готовность к активации внутриклеточных сигнальных путей. Установлено также, что под действием ПМБЛ изменяется профиль цитокинов, секретируемых дендритными клетками. Последние при этом начинали активно секретировать те цитокины, которые являются типичными для их зрелого состояния. Принимая во внимание полученные результаты, B. Morandi et al. [13] высказали предположение о том, что ПМБЛ может использоваться одновременно с другими иммунотропными препаратами, если они характеризуются низкой иммуногенностью. Указанная терапевтическая комбинация, по мнению авторов, позволит повысить эффективность этих препаратов за счет адъювантных свойств ПМБЛ.
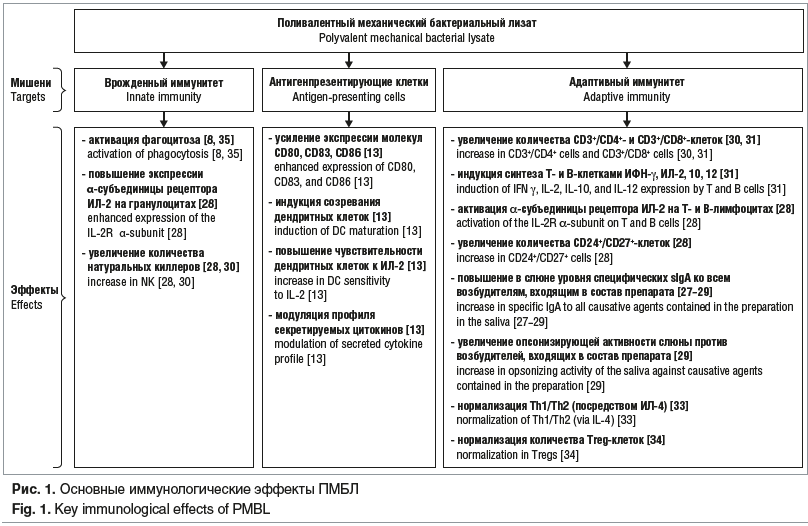
Анализируя результаты серии исследований [27–29], можно сделать вывод, что ПМБЛ характеризуется выраженным позитивным влиянием на адаптивный иммунитет, преимущественно на местное его звено. Так, на фоне лечения ПМБЛ в слюне существенно увеличивалась концентрация специфических sIgA ко всем возбудителям, входящим в состав препарата. Кроме того, G. Lanzilli еt al. [28] показали, что одновременно повышается количество CD24+/CD27+ и CD25+-клеток. Это позволило сделать вывод, что препарат обладает способностью одновременно стимулировать врожденный и приобретенный иммунитет. При этом авторы подчеркивают, что адаптивный иммунный ответ под действием ПМБЛ формируется преимущественно в системе местного иммунитета [28]. Последнее подтверждается результатами исследования [29], согласно которым использование ПМБЛ сопровождается повышением опсонизирующей активности слюны против тех возбудителей, антигены которых содержатся в препарате. Параллельно было установлено позитивное влияние препарата на врожденный иммунитет: например, он повышал функциональную активность фагоцитирующих клеток и увеличивал количество натуральных киллеров (см. рис. 1). Кроме этого, повышалась продукция таких цитокинов, как ИЛ-2, ИЛ-10, ИЛ-12 и интерферон γ. Представленные выше данные свидетельствуют о том, что ПМБЛ положительно влияет на все ключевые звенья иммунитета, обеспечивая у подавляющего большинства пациентов улучшение клинической картины и снижение уровня респираторной заболеваемости в целом [27–31].
Аналогичные результаты, свидетельствующие о высокой лечебно-профилактической эффективности ПМБЛ у пациентов с рекуррентной респираторной инфекцией (РРИ), были получены и в других клинических исследованиях [8, 9, 13]. В этой связи считаем целесообразным представить и собственные результаты двух наблюдательных проектов, в которых изучались переносимость, а также профилактическая и терапевтическая эффективность препарата Исмиген® у детей [19, 24]. Применение ПМБЛ
у 27 организованных детей дошкольного возраста (средний возраст 4,3±0,6 года) с РРИ позволило добиться положительного клинического результата
в 77,8% наблюдений. Так, на фоне трехмесячного курса лечения и в течение последующих 9 мес. наблюдения заболеваемость респираторными инфекциями снизилась в 2,8 раза (р<0,05), лихорадочный период при эпизодах респираторной инфекции сократился в 2,9 раза (р<0,05), потребность в противовирусных лекарственных средствах уменьшилась в 2,7 раза (р<0,05), антибиотиков — в 1,7 раза. Благодаря снижению респираторной заболеваемости дети стали в 2,6 раза реже пропускать занятия (р<0,05) [19]. Целью нашей следующей наблюдательной программы было уточнение профилактических возможностей препарата Исмиген® по предупреждению ОРИ и снижению респираторной заболеваемости в целом у детей во вновь образованных коллективах. Под наблюдением находились 74 ребенка (средний возраст 11,6±0,7 года), которые в период адаптации к вновь образованному коллективу получали с профилактической целью Исмиген® по стандартной схеме [26]. Применение препарата в период адаптации к новому коллективу сопровождалось снижением респираторной заболеваемости (31,1% детей в течение 6 мес. вообще не болели, 50,0% — болели не более 1 раза, средний уровень месячной заболеваемости не превышал 0,26 эпизода на 1 ребенка в месяц), а также сокращением числа бактериальных осложнений и значительным уменьшением частоты (до 5,4%) использования антибиотиков. Наш опыт применения препарата Исмиген® позволил сделать выводы, аналогичные выводам других авторов, о хорошей переносимости и высокой безопасности препарата [19, 26].
Отдельного внимания заслуживают результаты систематического обзора, посвященного неспецифическим иммуномодуляторам у педиатрических пациентов, и данные метаанализа рандомизированных клинических исследований по изучению безопасности и эффективности ПМБЛ у детей с РРИ [14, 17]. Так, метаанализ рандомизированных плацебо-контролируемых клинических исследований, проведенных среди детей с РРИ и рецидивирующими заболеваниями органов дыхания (345 детей, из них ПМБЛ получали 192 ребенка, плацебо — 153 ребенка), показал достоверное снижение заболеваемости респираторными инфекциями. У каждого пациента, получавшего ПМБЛ, удалось предупредить в среднем 2,2 эпизода инфекций органов дыхания (Q-value 0,82; df=2 (р=0,960); I2 0%; Tau2=0,00; Test of overall effect: Z=-4,089, от -3,260 до -1,147) [14].
В целом накопленный опыт применения ПМБЛ у детей с острыми, рекуррентными и хроническими заболеваниями органов дыхания дает основания сделать вывод о его хорошей переносимости, безопасности и высокой клинико-иммунологической эффективности [8, 9, 13, 14, 19, 24, 27–32].
В последние годы были опубликованы результаты экспериментальных и клинических исследований применения препарата Исмиген® у пациентов с аллергическими заболеваниями органов дыхания (бронхиальная астма, аллергический ринит) [33–36]. В работах была не только показана хорошая переносимость ПМБЛ у данных групп пациентов, но и сформулированы весьма обнадеживающие и перспективные выводы, требующие дальнейшего изучения в крупных рандомизированных клинических исследованиях: использование препарата в комплексной терапии бронхиальной астмы и аллергического ринита может позволить надежнее контролировать течение указанных заболеваний. При этом отмеченный лечебно-профилактический эффект авторы связывают с нормализацией процессов поляризации вектора иммунного ответа и приведения к адекватному уровню Th1/Th2, что сопровождается уменьшением эозинофилии, а также снижением продукции ИЛ-4 и синтеза IgE [33–36].
Заключение
Изложенные выше традиционные представления о механизмах действия БЛ, а также описанные иммуномодулирующие эффекты логичны и подкреплены результатами многочисленных исследований. На определенном этапе это позволило считать, что основные звенья фармакодинамики БЛ достаточно полно описаны и возможна лишь более глубокая их детализация. Между тем появившиеся в последние годы данные заставляют задуматься о том, что, вероятно, не все ключевые механизмы действия БЛ расшифрованы. Так, результаты экспериментальных исследований [37] свидетельствуют о сохранении профилактического эффекта БЛ даже при высокой степени лизиса бактерий, при котором в препарате остаются лишь мелкие пептиды или их небольшие фрагменты, которые не обладают антигенными свойствами. На основании полученных данных авторы высказывают предположение о том, что развитие протективного эффекта БЛ может быть обусловлено какими-то другими, пока еще не описанными механизмами. В этом отношении в качестве дополнительного фармакодинамического эффекта БЛ может представлять интерес концепция тренированного иммунитета, активно изучаемая в последнее десятилетие [37–39]. Концепция тренированного иммунитета описывает долгосрочное функциональное перепрограммирование клеток врожденного иммунитета, которое вызывается экзогенными или эндогенными повреждениями и которое приводит к измененному ответу на второй вызов после возврата в неактивированное состояние. Вторичный ответ на последующий неспецифический стимул может быть изменен таким образом, что клетки реагируют сильнее, чем при первичном ответе. При этом важно подчеркнуть, что понятие тренированного иммунитета представляет собой концепцию долгосрочной адаптации клеток врожденного иммунитета, а не конкретную транскрипционную или функциональную программу. В отличие от адаптивных иммунных ответов, тренированный иммунитет опосредует эпигенетическое перепрограммирование транскрипционных путей, а не рекомбинацию генов. Доказано, что эффекты тренированного иммунитета обратимы и сохраняются значительно меньшее время, чем классическая эпитоп-специфическая адаптивная иммунологическая память [37–39].
Таким образом, возможно, мы находимся в самом начале нового понимания одного из многочисленных позитивных эффектов БЛ, комбинация которых наряду с уже расшифрованными позволяет добиваться положительных лечебно-профилактических результатов при использовании их у детей и взрослых.
Благодарность
Авторы и редакция благодарят компанию «Сотекс» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Acknowledgements
The authors and Editorial Board are grateful to «Sotex» for providing full-text foreign articles required to write the review.
77-020-0285-6.
Сведения об авторах:
Заплатников Андрей Леонидович — д.м.н., профессор, заведующий кафедрой неонатологии им. профессора В.В. Гаврюшова, профессор кафедры педиатрии им. академика Г.Н. Сперанского, проректор по учебной работе ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0003-1303-8318.
Гирина Асия Ахмедовна — к.м.н., доцент кафедры фармакологии, клинической фармакологии, педиатрии, с курсом иммунологии и аллергологии БУ «Ханты-Мансийская государственная медицинская академия»; 628011, Россия, г. Ханты-Мансийск, ул. Мира, д. 40; ORCID iD 0000-0002-5281-1564.
Свинцицкая Виктория Иосифовна — к.м.н., доцент кафедры педиатрии им. академика Г.Н. Сперанского
ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-9272-2339.
Леписева Инга Владимировна — главный врач ГБУЗ «ДРБ»; 185000, Россия, г. Петрозаводск, ул. Парковая, д. 58; ORCID iD 0000-0001-8989-6103.
Лешик Мария Владимировна — врач-педиатр, соискатель кафедры педиатрии им. академика Г.Н. Сперанского ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1.
Контактная информация: Заплатников Андрей Леонидович, e-mail: zaplatnikov@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.07.2021.
Поступила после рецензирования 09.08.2021.
Принята в печать 27.08.2021.
About the authors:
Andrey L. Zaplatnikov — Dr. Sc. (Med.), Professor, Head of the Department of Neonatology named after prof. V.V. Gavryushov, Professor of the Academician G.N. Speranskiy Department of Pediatrics, Vice-rector for Academic Affairs, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya, Moscow, 123836, Russian Federation; ORCID iD 0000-0003-1303-8318.
Asiya A. Girina — C. Sc. (Med.), associate professor of the Department of Pharmacology, Clinical Pharmacology, and Pediatrics with the Courses of Immunology and Allergy, Khanty-Mansi State Medical Academy; 40, Mira str., Khanty-Mansiysk, 628011, Russian Federation; ORCID iD 0000-0002-5281-1564.
Viktoriya I. Svintsitskaya — C. Sc. (Med.), associate professor of the Academician G.N. Speranskiy Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya, Moscow, 123836, Russian Federation; ORCID iD 0000-0002-9272-2339.
Inga V. Lepiseva — Head Doctor, Children’s Republican Hospital; 58, Parkovaya str., Petrozavodsk, 185000, Russian Federation; ORCID iD 0000-0001-8989-6103.
Maria V. Leshik — pediatrician, postgraduate student of the Academician G.N. Speranskiy Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya, Moscow, 123836, Russian Federation.
Contact information: Andrey L. Zaplatnikov, e-mail: zaplatnikov@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.07.2021.
Revised 09.08.2021.
Accepted 27.08.2021.
.
Информация с rmj.ru






