Содержание статьи
Артериальная гипертензия и хроническая обструктивная болезнь легких — проблемы выбора терапии
В. С. Задионченко*, доктор медицинских наук, профессор
Т. В. Адашева*, доктор медицинских наук, профессор
В. В. Ли*, кандидат медицинских наук, доцент
Е. И. Жердева*
Ю. В. Малиничева*
О. И. Нестеренко**, кандидат медицинских наук
С. В. Павлов*
*ГБОУ ВПО МГМСУ Минздравсоцразвития России,
**ГБУЗ ГКБ № 11 Департамента здравоохранения города, Москва
В настоящее время, по данным ВОЗ, около 250 миллионов человек в мире страдают хронической обструктивной болезнью легких (ХОБЛ). Это второе по распространенности неинфекционное заболевание по общемировой статистике. Заболеваемость ХОБЛ прогрессивно растет, и хроническая обструктивная болезнь легких является единственной причиной смерти с увеличением количества регистрируемых случаев [1, 2]. По прогнозам ВОЗ ХОБЛ станет третьей наиболее распространенной причиной смерти после инсульта и инфаркта миокарда к 2030 году [1]. Наиболее часто встречающимися коморбидными состояниями при ХОБЛ являются артериальная гипертензия (АГ) (28%), сахарный диабет (14%), ишемическая болезнь сердца (10%) [2, 3].
Приоритеты в изучении коморбидной сердечно-сосудистой и легочной патологии принадлежат отечественной терапевтической школе. Так, в 1954 году российский терапевт академик А. Л. Мясников выявил наклонность к повышению АД у больных эмфиземой легких и предположил ведущую роль в развитии гипертензивных реакций гипоксии головного мозга. Он писал: «В подобных условиях легче возникают, при действии психоэмоциональных факторов, соответствующие нарушения высшей нервной деятельности, которые ведут в ряде случаев к развитию гипертонии». Н. М. Мухарлямов в 1966 году отметил, что у 20–25% больных хроническими неспецифическими заболеваниями легких (ХНЗЛ) диагностируется АГ, связь которой с состоянием бронхиальной проходимости позволяет выделить ее в качестве самостоятельной симптоматической «пульмогенной» гипертонии. В генезе этой формы АГ Н. М. Мухарлямов предполагал участие гипоксии и гиперкапнии, нарушения роли легких в метаболизме биологически активных веществ (катехоламинов, серотонина, гистамина, кининов, ангиотензина II), которые являются вазоактивными агентами [4, 5]. В свою очередь В. Ф. Жданов и соавт. отмечали связь развития системной АГ с бронхообструкцией при участии гипоксии, гиперкапнии, нарушений легочного газообмена и гемодинамики малого круга кровообращения у больных ХНЗЛ, что подтверждается и более поздними исследованиями [6]. В дальнейшем отечественные исследователи в целом ряде работ изучили патогенетические особенности АГ и клинико-функциональные характеристики АГ у больных ХОБЛ, а также подходы к терапии этой коморбидной патологии [7–11].
Однако до настоящего времени не существует доказательной базы эффективности антигипертензивной терапии и влияния на «суррогатные» и «жесткие» конечные точки у больных с сочетанной патологией АГ и ХОБЛ. Современные международные рандомизированные исследования в основном решают вопросы сравнения эффективности различных классов препаратов или их комбинаций. Возможности использования результатов данных исследований в реальной клинической практике зачастую ограничены, так как в список критериев исключения попадает большое количество больных АГ с сочетанной патологией, в том числе и ХОБЛ. С другой стороны, пульмонологические протоколы ведения больных с ХОБЛ не учитывают сочетанную кардиологическую патологию. Так, в европейских рекомендациях по ведению АГ (ESC/ESH 2007 — Европейское общество кардиологов (European Society of Cardiology — ESC) и Европейское общество по изучению гипертензии (The European Society of Hypertension, ESH)) вообще не выделяется такого клинического варианта АГ — сочетание с ХОБЛ [12]. В национальных клинических рекомендациях в разделе «АГ в сочетании с патологией легких» обсуждаются особенности ведения АГ у больных с ХОБЛ и бронхиальной астмой, проблемы подбора антигипертензивных препаратов, предпочтительные терапевтические стратегии [13].
Не вызывает сомнения, что в лечении АГ при ХОБЛ оправдано назначение препаратов, не только эффективно снижающих АД, но и отвечающих ряду требований:
- адекватный контроль АД в ночные и ранние утренние часы;
- совместимость препаратов с базисными средствами лечения ХОБЛ;
- отсутствие эффектов, ухудшающих вентиляцию легких, бронхореактивность и усугубляющих гипоксемию;
- положительное влияние на гемодинамику малого круга кровообращения;
- выраженные кардио- и вазопротективные эффекты;
- отсутствие влияния на фармакодинамику антигипертензивных препаратов в условиях гипоксии.
Также необходимо, чтобы выбранный препарат оказывал влияние на патогенетические механизмы формирования АГ при ХОБЛ.
В основе развития АГ при ХОБЛ лежит раннее формирование эндотелиальной дисфункции в малом и большом круге кровообращения, повышение симпатической активности с дисбалансом синтеза катехоламинов, нарушение роли легких в метаболизме вазоактивных веществ, оксидативный стресс, хроническое системное воспаление, дисбаланс в ренин-ангиотензин-альдостероновой системе (РААС) [14]. Имеются немногочисленные работы, подтверждающие роль компонентов РААС в патогенезе сердечно-сосудистых изменений у больных ХОБЛ [15]. Активность ангиотензин-превращающего фермента (АПФ) увеличивается при гипоксии, что, возможно, играет немаловажную роль в увеличении степени системной гипертонии [16]. Повышение функции РААС возможно как при непосредственном воздействии гипоксии, так и опосредованно, через активацию симпатоадреналовой системы.
Проблемы применения ингибиторов АПФ (ИАПФ) у больных с бронхообструктивным синдромом неоднократно обсуждались. И связаны они, прежде всего, с накоплением бронхоирритантов (брадикинин, субстанция Р, оксид азота) и появлением или усугублением кашля с возможным усилением бронхообструктивного синдрома. По данным клинических исследований частота этого побочного эффекта достигает 10–20%, причем среди больных без сопутствующей патологии [17]. Появление брадикининового кашля у больных ХОБЛ может ошибочно расцениваться как обострение ХОБЛ и приводить к неоправданному изменению лечебной тактики: усилению противовоспалительной и бронходилатирующей терапии, что, в свою очередь, ведет к усугублению течения АГ, микроциркуляторным расстройствам и ухудшению качества жизни больных.
Блокаторы АТ1-ангиотензиновых рецепторов (БАР) в отличие от ИАПФ не влияют на активность других нейрогуморальных систем, с которыми связывают такие характерные для ИАПФ побочные эффекты, как сухой кашель и ангионевротический отек, при этом сохраняя плейотропные эффекты, характерные для блокады РААС (антиоксидантные эффекты, эндотелийрегулирующие свойства). Большей селективностью и специфичностью блокады РААС объясняют лучшую переносимость БАР, по сравнению с ИАПФ. Частота побочных эффектов при лечении БАР такая же, как при назначении плацебо. У пациентов с нарушенной бронхиальной проходимостью не было отмечено препарат-индуцированного кашля, что дает основания рассматривать БАР как препараты выбора в данной группе, что подтверждено в национальных рекомендациях Всероссийского научного общества кардиологов по ведению АГ (ВНОК, 2010) [13, 18].
Однако в одной из работ на фоне применения лозартана было отмечено индуцирование бронхоспазма и появление кашля у пациентов с АГ. Среди предположительных механизмов этого побочного эффекта обсуждалось повышение освобождения бронхоирританта оксида азота [19]. В другом же исследовании лозартан ингибировал метахолин-индуцированный бронхоспазм и значительно уменьшил редукцию объема формированного выдоха за первую секунду (ОФВ1) [20].
Таким образом, влияние БАР на функцию легких описано в небольшом количестве местных исследований, которых недостаточно для однозначного заявления о тактике применения препаратов этой фармакологической группы у пациентов с сочетанием АГ и ХОБЛ в связи с небольшим количеством наблюдений и отсутствием ослепления исследований. Таким образом, теоретические предпосылки благоприятного действия блокады негативных влияний АТII дают основание для дальнейших исследований влияния данной группы препаратов не только при изолированной АГ, но и ее сочетании с другими патологиями, в том числе ХОБЛ.
Целью нашей работы явилась оценка эффективности и переносимости антагониста рецепторов ангиотензина II — валсартана (Нортиван®) в дозе 80–160 мг в сутки у больных АГ 1–2 степени и ХОБЛ II-IV стадии.
Материалы и методы исследования. Дизайн исследования — местное, открытое, несравнительное исследование по изучению эффективности и безопасности препарата Нортиван® у больных АГ в сочетании с ХОБЛ. Нами обследовано 18 пациентов с ХОБЛ II–IV стадии (the Global initiative for chronic Obstructive Lung Disease, GOLD 2011) в период ремиссии, страдающий АГ I и II степени, определяемой в соответствии с общепринятой классификацией уровней АД (ВНОК, 2010). Средний возраст больных составил 53,5 ± 4,6 года.
Критериями исключения из исследования являлось наличие у пациентов осложнений АГ, ишемической болезни сердца, декомпенсированного хронического легочного сердца, эндокринных заболеваний, требующих медикаментозной коррекции, патологии почек, хронической сердечной недостаточности, пероральной стероидной терапии более 10 дней за последние 6 месяцев до включения в исследование, онкологических заболеваний и любых других состояний, которые могли бы помешать интерпретации и оценке результатов исследования. Пациенты, не получавшие ранее антигипертензивного лечения, включались в исследование сразу, а остальные проходили отмывочный период в течение 2 недель.
В качестве антигипертензивной терапии на протяжении 24 недель пациенты получали препарат Нортиван®. Эффективность терапии контролировалась с помощью суточного мониторирования артериального давления (СМАД). Выбор в качестве критериев эффективности терапии параметров СМАД связан с литературными данными и собственными наблюдениями о преобладании у пациентов с АГ и ХОБЛ суточных профилей АД с отсутствием снижения или повышением АД в ночной период, когда офисные цифры АД в меньшей степени отражают эффективность проводимой антигипертензивной терапии. Начальная дозировка составила 80 мг/сут. При недостаточном гипотензивном эффекте на 4-й неделе лечения доза препарата удваивалась. Базисная терапия ХОБЛ не менялась на протяжении всего времени исследования и включала антихолинергические препараты (ипратропия бромид, тиотропия бромид), бета2-адреномиметик (фенотерол) или их комбинацию.
Исходно и через 24 недели лечения проводилось полное лабораторное обследование: клинический анализ крови, биохимический анализ крови. Также исследовалась толщина комплекса интима-медиа (КИМ) сонных артерий, ЭКГ. Критерием безопасности проводимой терапии послужила оценка показателей функции внешнего дыхания, суточной пульсоксиметрии. СМАД проводилось с использованием портативных мониторов АВРМ-03 и АВРМ-04. Суточная пульсоксиметрия проводилась с использованием пульсоксиметра MIROxi. При суточной пульсоксиметрии анализировались следующие параметры: Ср%SpO2 — средний уровень сатурации за сутки; Мин%SpO2 — минимальное значение сатурации за сутки; Макс%SpO2 — максимальное значение сатурации за сутки; индекс десатурации (1/ч) — среднее количество эпизодов десатурации за час; максимальная продолжительность (c) — максимальная продолжительность десатурации. Вентиляционная функция легких оценивалась на бодиплетизмографе волюметрического типа Master Lab методами спирографии с компьютерным расчетом показателей. Критерием безопасности терапии были данные спирометрии и суточной пульсоксиметрии до назначения препарата и в процессе терапии.
Анализ данных проводился с помощью статистического пакета программ SPSS 15.0. При сравнении количественных признаков в параллельных группах использовался критерий Стьюдента.
Результаты и обсуждение
Все больные по данным СМАД на фоне лечения достигли целевых цифр АД. Увеличение дозы препарата до 160 мг/сут потребовалось 50% пациентов. Побочных эффектов в процессе терапии зарегистрировано не было.
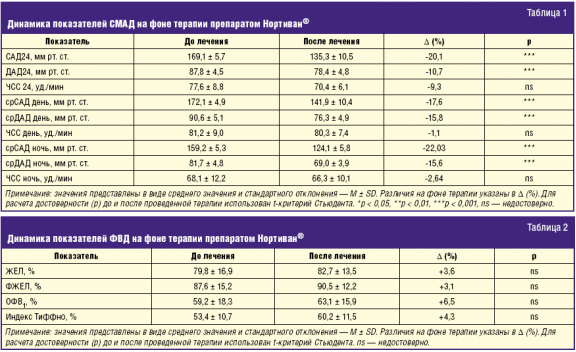
Под влиянием терапии произошло статистически значимое снижение как среднесуточных показателей систолического артериального давления (САД) и диастолического артериального давления (ДАД), так и показателей АД в дневной и ночной периоды (табл. 1). При анализе суточного профиля АД до терапии обращало на себя внимание преобладание пациентов с повышением или отсутствием снижения АД в ночном периоде (night-peaker — 31%, non-dipper — 50%, dipper — 19%), что связано с усугублением бронхиальной обструкции в ночные часы с активацией нейрогуморальных систем (симпатико-адреналовой и РААС) и повышением АД. В процессе терапии произошла полная коррекция типа night-peaker с увеличением количества пациентов с физиологическим ночным снижением АД (dipper) до 62%.
В наше исследование вошли пациенты со значительными обструктивными нарушениями в целом по группе (ОФВ1 < 60%). В процессе лечения существенной динамики данных спирометрии не получено, что доказывает безопасность и хорошую переносимость изучаемого препарата у пациентов с ХОБЛ и АГ (табл. 2).
При оценке показателей суточной пульсоксиметрии достоверной динамики на фоне лечения Нортиваном® не выявлено.
Не было отмечено существенного влияния Нортивана® на концентрацию общего холестерина, триглицеридов, глюкозы натощак и мочевой кислоты в сыворотке крови.
В 97% случаев у больных ХОБЛ было выявлено увеличение толщины КИМ, у 25,6% отмечено увеличение толщины КИМ на фоне нормального уровня липидного спектра, у 35,7% больных обнаружены в сонных артериях атеросклеротические бляшки различной локализации. В дальнейшем на фоне проводимой терапии статистически значимой динамики не отмечалось.
Клинический пример
Больной А., 58 лет.
Диагноз: хроническая обструктивная болезнь легких III ст., вне обострения. Артериальная гипертензия II ст., риск 4. Цереброваскулярная болезнь: стеноз левой внутренней сонной артерии 42%. Дислипидемия II А типа.
Жалобы: на одышку смешанного характера при ходьбе, кашель со слизистой мокротой в утренние часы, головные боли в затылочной области, эпизодически беспокоят «мушки перед глазами», слабость.
Анамнез: курит с 20 лет по 1,5 пачки в день. Работает слесарем. Хронический кашель много лет. Одышка беспокоит с 2008 года с затрудненным выдохом, которая в дальнейшем стала носить смешанный характер. В июле 2008 г. перенес пневмонию в средней доле правого легкого, в том же году была диагностирована ХОБЛ II ст. Обострения 2–3 раза в год. В течение 3–4 лет отмечает повышение АД, максимальные цифры 175/95 мм рт. ст., адаптирован к 130–140/80–90 мм рт. ст. Постоянного лечения не получал, эпизодически принимал метопролол 50 мг утром. Не обследовался, к врачам не обращался. Базисная терапия ХОБЛ: Беродуал нерегулярно.
Объективный статус: состояние относительно удовлетворительное. Кожные покровы нормальной окраски, умеренной влажности, периферических отеков нет. При перкуссии над легкими коробочный звук, при аускультации везикулярное дыхание, проводящееся во все отделы, единичные дискантовые хрипы. ЧДД 19 в мин. Границы сердца не расширены. Верхушечный толчок в V межреберье по среднеключичной линии. Тоны сердца ясные, ритмичные. АД 170/100 мм рт. ст. ЧСС 90 уд./мин. Язык чистый, влажный. Живот мягкий, безболезненный. Печень не увеличена. Физиологические отправления в норме.
ЭКГ: синусовый ритм. ЧСС 93 уд./мин. Нормальное положение электрической оси сердца. Гипертрофия левого желудочка. Нарушение внутрижелудочковой проводимости.
Результаты терапии: начальная дозировка Нортивана® составила 80 мг/сут. Через 2 недели после анализа индивидуального дневника АД пациента доза была увеличена до 160 мг/сут из-за недостаточного гипотензивного эффекта препарата.
На фоне терапии больной субъективно отметил улучшение самочувствия: уменьшилась слабость, головные боли в затылочной области не беспокоили, эпизоды «мушек перед глазами» не возникали, субъективно несколько уменьшилась выраженность одышки. После 6-месячной терапии Нортиваном® в суточной дозе 160 мг по результатам офисного измерения АД зарегистрирован хороший клинический эффект (АД 130/80 мм рт. ст.). Побочных эффектов не отмечалось.
При контрольном СМАД на фоне терапии отмечалось снижение СрСАД и СрДАД на 13,2% и 18,4% соответственно, уменьшение ВарСАД, показателей нагрузки давлением, улучшение суточного профиля АД (переход из типа non-dipper в dipper) (табл. 3).

При исследовании ФВД было выявлено значительное снижение вентиляционной способности легких по обструктивному типу. Резкая обструкция бронхов на всех уровнях. ЖЕЛ, ФЖЕЛ в норме. ЖЕЛ 92%, ФЖЕЛ 89%, ОФВ1 55%, индекс Тиффно 49%. В дальнейшем при контрольном исследовании без существенной динамики: ЖЕЛ 89%, ФЖЕЛ 95%, ОФВ1 56%, индекс Тиффно 47%.
Пульсоксиметрия: распределение SpO2 (насыщение кислорода): среднее — 95,2%, min — 95%, max — 96%. Эпизоды SpO2 < 89% — 0.Δ Index (12S) — 0. Длительность десатурации: общие события десатурации — 0. Распределение ЧСС: среднее — 96,3 в мин, min — 93%, max — 97%. В дальнейшем при оценке суточной пульсоксиметрии существенной динамики на фоне лечения Нортиваном® не выявлено: распределение SpO2 (насыщение кислорода): среднее — 96%, min — 95%, max — 97%. Эпизоды SpO2 < 89% — 0. Δ Index (12S) — 0. Длительность десатурации: общие события десатурации — 0. Распределение ЧСС: среднее — 92 в мин, min — 90%, max — 94%.
Ультразвуковая допплерография: в области бифуркации общей сонной артерии отмечается утолщение КИМ до 1,5 мм справа, 1,0 мм слева. Утолщение КИМ 1 см до бифуркации сонной артерии: слева по передней стенке до 1,1 мм, по задней стенке 0,8 мм; справа до 1,0 мм. Внутренняя сонная артерия слева: КИМ 1,5 мм, стеноз 42%. В дальнейшем при контрольном исследовании без динамики.
Показатели биохимического и клинического анализа крови в процессе терапии без динамики.
Таким образом, данный клинический пример иллюстрирует высокую антигипертензивную эффективность и безопасность Нортивана® у больного АГ очень высокой степени риска в сочетании с ХОБЛ.
Заключение
Применение препарата Нортиван® показало высокую эффективность и безопасность у больных АГ I–II степени в сочетании с ХОБЛ II-IV стадии. Выявлена статистически и клинически значимая нормализация показателей СМАД с коррекцией патологических типов суточных кривых за счет уменьшения количества пациентов с повышением или отсутствием снижения АД в ночной период. Безопасность использования препарата в клинической группе с синдромом бронхообструкции подтверждена динамикой вентиляционных показателей по данным спирометрии и результатами суточной пульсоксиметрии, которые показали отсутствие усугубления гипоксии на фоне терапии.
Литература
- Hurd S. S., Lenfant C. COPD: good lung health is the key. Comment // Lancet. 2005; 366: 1832–1834.
- WHO Key Facts COPD: http://www.who.int/mediacentre/factsheets/fs315/en/index.html.
- Crisafulli E., Costi S., Luppi F. et al. Role of comorbidities in a cohort of patients with COPD undergoing pulmonary rehabilitation // Thorax. 2008; 63: 487–492.
- Мухарлямов Н. М. Легочное сердце. М.: Медицина, 1973, 263 с.
- Мухарлямов Н. М., Саттбеков Ж. С., Сучков В. В. Системная артериальная гипертензия у больных хроническими неспецифическими заболеваниями легких // Кардиология. 1974; № 12 (34): с. 55–61.
- Жданов В. Ф. Клинико-статистическая характеристика больных неспецифическими заболеваниями легких с системной артериальной гипертензией. В кн.: Актуальные проблемы пульмонологии. Сб. науч. тр., Л., 1991; 89–93.
- Задионченко В. С., Погонченкова И. В., Адашева Т. В. Артериальная гипертония при хронической обструктивной болезни легких. Монография. М.: Анахарсис, 2005: 243.
- Задионченко В. С., Адашева Т. В. Глава «Артериальная гипертония у больных хронической обструктивной болезнью легких». Рук-во по артериальной гипертонии под ред. акад. Е. И. Чазова, проф. И. Е. Чазовой. М.: Медиа Медика, 2005: 454–471.
- Задионченко В. С., Адашева Т. В., Федорова И. В., Нестеренко О. И., Миронова М. А. Артериальная гипертония и хроническая обструктивная болезнь легких — клинико-патогенетические параллели и возможности терапии // Российский кардиологический журнал. 2009; 6: 62–69.
- Адашева Т. В., Федорова И. В., Задионченко В. С., Мациевич М. В., Павлов С. В., Ли В. В., Гринева З. О. Клинико-функциональные характеристики артериальной гипертонии у больных хронической обструктивной болезнью легких // Сердце. 2009; 6: 345–351.
- Задионченко В. С., Адашева Т. В., Мациевич М. В. Артериальная гипертония и хроническая обструктивная болезнь легких. Набор слайдов с комментариями. М., 2009: 40.
- Mancia G., De Backer G., Dominiczak A. et al. Guidelines for the Management of Arterial Hypertension. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J Hypertens. 2007; 25: 1105–1187.
- Диагностика и лечение артериальной гипертензии. Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов, 2010. www.gypertonic.ru.
- Hunninghake D. B. Cardiovascular Disease in Chronic Obstructive Pulmonary Disease The Proceedings of the American Thoracic Society. 2005; 2: 44–49.
- Ulfendahl H. R., Aurell M. Renin-Angiotensin. London: Portland Press. 1998; 305.
- Zimmerman B. G., Sybertz E. J., Wong P. C. Interaction between sympathetic and renin-angiotensin system // J Hypertens. 1984; 2: 581–587.
- Goldszer R. C., Lilly L. S., Solomon H. S. Prevalence of cough during angiotensin converting enzyme inhibitor therapy // Am J Med. 1988; 85: 887.
- Lacourciere Y., Lefebvre J., Nakhle G. et al. Association between cough and angiotensin converting enzyme inhibitors vs angiotensin II antagonists: the design of a prospective, controlled study // J Hypertens. 1994; 12: 49–53.
- Chan P., Tomlinson B., Huang T. Y. et al. Double-blind comparison of losartan, lisinopril, and metolazone in elderly hypertensive patients with previous angiotensin-converting enzyme inhibitorinduced cough // J Clin Pharmacol. 1997; 37: 253–257.
- Myou S., Fujimura M., Kamio Y. et al. Effect of losartan, a type 1 angiotensin II receptor antagonist, on bronchial hyperresponsiveness to methacholine in patients with bronchial asthma // Am J Respir Crit Care Med. 2000; 162: 40–44.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru

