Введение
COVID-19 характеризуется разнообразной клинической картиной, однако наиболее частыми клиническими проявлениями в дебюте болезни являются симптомы поражения респираторного тракта (кашель, катаральные явления), а также лихорадка, потеря обоняния/вкуса [1]. Помимо вышеперечисленных симптомов, нередко выявляются симптомы поражения желудочно-кишечного тракта (ЖКТ): анорексия, рвота, диарея, боль в животе [2–8], причем самым распространенным из них является диарея. По данным различных исследований, распространенность диареи может варьироваться от 2% до 49,5% [9, 10]. По нашим данным, при госпитализации в многопрофильный стационар, не предназначенный для госпитализации больных с SARS-CoV-2-инфекцией, диарея выявлялась в 7,8% случаев (у пациентов жидкий стул наблюдался с поступления, был учащенным до 2–4 раз в сутки, без патологических примесей; бактериальные и вирусные патогены не обнаруживались) [11].
Диарея, связанная с COVID-19, обычно протекает в легкой форме и может быть единственным симптомом болезни. Частота дефекации составляет в среднем 3,3–4,3 раза в сутки, а продолжительность диареи — 3,0–5,4 дня. Однако в некоторых случаях болезнь протекает более тяжело, с частотой дефекации, достигающей 18–30 раз в день [12–15].
Патогенетические механизмы диареи, ассоциированной с COVID-19, можно описать следующим образом. Вирус SARS-CoV-2 может инфицировать и размножаться в клетках пищевода и энтероцитах, что приводит к прямому повреждению эпителия кишечника. Процесс проникновения SARS-CoV-2 в клетки-мишени обеспечивается наличием рецепторов ангиотензинпревращающего фермента 2 (АПФ2), которые экспрессированы на клетках эпителия верхних дыхательных путей, энтероцитах тонкого кишечника, эндотелии сосудов, макрофагах. Проникновение коронавируса в клетки-мишени хозяина зависит от связывания S-белка с клеточным рецептором, где он затем праймируется для проникновения протеазами мембраны клетки-хозяина [16]. SARS-CoV-2 использует рецептор AПФ2 для интернализации и рецептор TMPRSS2 для праймирования S-белка. Также интересно отметить, что белок S SARS-CoV-2 проявляет в 10–20 раз более высокую аффинность к рецепторам по сравнению с белком SARS-CoV. После проникновения вирусная геномная РНК (гРНК) выводится в цитоплазму. После трансляции образуются полипептиды pp1a и pp1ab, которые затем расщепляются вирусными протеазами с образованием неструктурных белков, РНК-зависимой РНК-полимеразы и геликазы, которые образуют комплекс репликаза-транскриптаза с вирусной гРНК. Этот комплекс локализуется во внутриклеточных удвоенных мембранных везикулах, где он опосредует производство (-) смысловой РНК посредством репликации и транскрипции. Во время репликации образуются полноразмерные (-) РНК-копии генома, которые используются в качестве шаблонов для полноразмерных (+) РНК. Субгеномные РНК образуются в результате транскрипции и транслируются в структурные белки, нуклеокапсид, шип, мембрану и оболочку. Белки шипа, мембраны и оболочки поступают в эндоплазматический ретикулум, а нуклео-капсид образует нуклеопротеиновый комплекс с вновь синтезированной (+) гРНК. Они собираются в вирусную частицу в промежуточном отсеке Гольджи эндоплазматического ретикулума, выводятся через аппарат Гольджи и, наконец, высвобождаются путем экзоцитоза в небольших везикулах [16].
Несмотря на то, что основной мишенью SARS-CoV-2 являются альвеолярные клетки II типа и это определяет основные клинические проявления заболевания, наличие рецепторов АПФ2 на мембранах эпителия желудка и энтероцитов предполагает развитие катарального гастроэнтероколита, обусловливающего появление соответствующих симптомов, влияющих на течение COVID-19 [17–20]. В легких вирус вызывает активацию иммунной системы, характеризующуюся выработкой провоспалительных цитокинов и рекрутированием иммунных клеток. Если вирусный клиренс недостаточен, иммунный ответ прогрессирует в направлении развития «цитокинового шторма». В кишечнике вирус вызывает аналогичный иммунный ответ, хотя еще не ясно, достигает ли величина воспалительного ответа того же уровня, что и в легких.
Вирус инфицирует эпителиальные клетки кишечника, вызывая высвобождение цитокинов и хемокинов, провоцируя острое кишечное воспаление, характеризующееся инфильтрацией нейтрофилов, макрофагов и Т-клеток. У пациентов, инфицированных SARS-CoV-2, наблюдается диарея, что может косвенно подтверждать этот тезис. M. Effenberger et al. [21] доказали, что SARS-CoV-2 у пациентов действительно вызывает воспалительный ответ в кишечнике, о чем свидетельствуют повышенный уровень фекального кальпротектина (фекальный биомаркер кишечного воспаления, в значительной степени продуцируемый нейтрофильными гранулоцитами) и системный ответ c повышением содержания IL-6. У пациентов с тяжелой формой COVID-19 с симптомами желчнокаменной болезни, помимо гистологических изменений в кишечнике, также регистрировались пищеводные кровотечения с эрозиями и язвами [22, 23]. Более того, у 73 госпитализированных пациентов с COVID-19 в кале была обнаружена РНК SARS-CoV-2, а в слизистой оболочке ЖКТ — интерстициальный отек, многочисленные инфильтрирующие плазматические клетки и лимфоциты. Кроме того, определялось положительное окрашивание ACE2 и SARS-CoV-2 в эпителии ЖКТ [20]. Было установлено, что человеческий дефенсин 5 (HD5), наиболее распространенный α-дефенсин, специфически секретируемый кишечными клетками Панета, играет важную роль в реализации инфекционного процесса, обусловленного SARS-CoV-2 [24].
Одним из последствий развития иммунного ответа может стать дисбактериоз с распространением провоспалительного состояния. Антигенпрезентирующие клетки участвуют в активации иммунной системы в ответ на различные экзогенные триггеры вируса: SARS-CoV-2 может активировать воспалительные пути, которые имеют сходство с некоторыми иммуноопосредованными заболеваниями, такими как воспалительные заболевания кишечника или ревматоидный артрит [25]. Активность SARS-CoV-2 может вызывать модификации АПФ2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. АПФ2 оказывает значительное влияние на состав кишечной микробиоты. Первичные воспалительные стимулы способствуют высвобождению в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию. Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Микробиом человека меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна, во взрослом возрасте — стабильна и разнообразна, а в пожилом возрасте разнообразие микробиоты уменьшается, и именно это может служить фактором риска заражения COVID-19 для пожилых людей. Установлено, что состав микробиоты кишечника у пациентов с COVID-19 сильно изменен: разнообразие значительно снижено, доля комменсальных бактерий уменьшена, а условно-патогенных микроорганизмов, напротив, увеличена по сравнению с таковой у здоровых людей [26, 27].
В исследовании, проведенном в Гонконге, показано, что преобладание Coprobacillus, Clostridium ramosum и Clostridium hathewayi коррелировало с тяжестью COVID-19, а присутствие Faecalibacterium prausnitzii (противовоспалительной бактерии) показало обратную корреляцию. Bacteroides dorei, Bacteroides thetaiotaomicron, Bacteroides massiliensis и Bacteroides ovatus были связаны с низкой фекальной вирусной нагрузкой SARS-CoV-2 [28].
Согласно метаанализу данных гонконгской группы пациентов, опубликованному в 2020 г., 17,6% пациентов с COVID-19 имеют желудочно-кишечные симптомы, а 48,1% образцов фекалий от пациентов с COVID-19 дали положительный результат на вирусную РНК. В связи с этим следует внимательно относиться к потенциальной желудочно-кишечной инфекции и фекально-оральной передаче вируса [29, 30].
Было обнаружено, что вирусная нагрузка в образцах стула достигает пика позже, обычно через 2–3 нед. после появления симптомов [30]. Нагрузка вирусной РНК в образцах стула, по-видимому, соответствовала уровню в мокроте в 86% (6 из 7) случаев в исследовании, проведенном в Германии [30, 31]. Однако у некоторых пациентов образцы фекалий оставались положительными на наличие вируса даже после того, как в образцах дыхательных путей и/или мокроты вирус не обнаруживался. В некоторых случаях вирусная нагрузка в фекалиях достигала 107 KOE/г [31], что было выше, чем в глоточных мазках. Наличие и персистенцию такого большого количества вирусной РНК в фекалиях вряд ли можно объяснить только проглатыванием вирусных частиц, реплицирующихся в горле, скорее можно предположить кишечную инфекцию SARS-CoV-2.
Детальная характеристика микробиома кишечника может быть полезна для прогнозирования тяжести заболе-вания при COVID-19, и для дальнейшего изучения этого аспекта необходимы крупные проспективные исследования. Использование пробиотиков или пребиотиков может помочь восстановить микробиоту кишечника. Адекватное потребление высококачественных белков, витамина А и жирных кислот с разветвленной цепью может увеличить выработку антител. Потребление диетических компонентов с известными противовоспалительными и антиоксидантными свойствами (омега-3, витамины С, Е и фитохимические вещества, такие как каротиноиды и полифенолы) может помочь ослабить чрезмерную воспалительную реакцию и тем самым предотвратить дисрегулированное иммуноопосредованное повреждение. Низкий уровень витамина D повышает восприимчивость к тяжелым заболеваниям и риск летального исхода. Достаточное потребление клетчатки снижает относительный риск смертности от инфекционных и респираторных заболеваний на 20–40% и связано с более низким риском развития хронической обструктивной болезни легких [32].
Таким образом, измененная микробиота, наблюдаемая у пациентов с COVID-19, может быть дополнительным фактором, способствующим развитию диареи за счет ослабления колонизационной резистентности, снижения продукции полезных бактериальных метаболитов и запуска локальной иммунной перестройки. Резюмируя вышеизложенное, можно выделить вероятные механизмы развития нарушений со стороны ЖКТ при развитии СOVID-19: нарушение кишечного барьера из-за местного воспаления или репликации вируса; нарушение регуляции АПФ2, дефицит которого повышает восприимчивость кишечника к развитию воспаления; изменение состава и функции микробиоты ЖКТ.
Как было отмечено выше, помимо диареи при коронавирусной инфекции могут возникать и другие гастроинтестинальные симптомы: тошнота и рвота — в 7% случаев, диарея — в 8% случаев, анорексия — в 17% случаев. Боль в животе, которая также является одним из симптомов поражения ЖКТ при COVID-19, регистрируется в 3–3,6% случаев [33–37]; по нашим данным, болевой абдоминальный синдром встречается у 3,1% детей с COVID-19 [11]. Боль в животе является одной из наиболее частых причин госпитализации ребенка в хирургическое отделение многопрофильного стационара, и в 15–20% случаев она возникает в результате патологии аппендикса — острого аппендицита (ОА) [38]. Имеются единичные публикации о случаях ОА у детей с COVID-19 [39], однако в настоящее время не накоплено достаточно данных, указывающих на вероятность ОА как осложнения инфекции, вызванной SARS-CoV-2. В исследование было включено 1010 детей с подтвержденной SARS-CoV-2-инфекцией или мультисистемным воспалительным синдромом (МВС). У 42 (4,2%) детей был установлен клинический диагноз ОА. Четыре (9,5%) ребенка с МВС не подвергались хирургическому вмешательству, 38 (3,8%) детей были оперированы по поводу подозрения на аппендицит, при этом у 34 (89,7%) из них интраоперационно был установлен диагноз ОА. У 4 детей при проведении операции не обнаружили хирургических причин болей в животе, что позволило исследователям предположить возможность COVID-19 и МВС проявляться как острым животом, так и симулировать аппендицит [40].
Причины, по которым симптомы поражения ЖКТ возникают только у части пациентов с COVID-19, в настоящее время не известны. Данных за влияние демографических показателей и/или наличие коморбидной патологии (новообразования, хроническая болезнь почек, хроническая обструктивная болезнь легких) также не получено. Раннее выявление симптомов поражения ЖКТ имеет большое значение, поскольку у некоторых пациентов могут быть только желудочно-кишечные проявления при отсутствии легочных симптомов, что затрудняет диагностику. В тех случаях, когда SАRS-CoV-2-инфекция протекает с абдоминальным болевым синдромом, симулирующим аппендицит, сложности диагностики возрастают.
В качестве иллюстрации приводим наблюдение пациента, у которого уточнение диагноза проводилось поэтапно.
Клиническое наблюдение
Семнадцатилетний подросток доставлен по экстренным показаниям машиной СМП в ГБУЗ «ДГКБ св. Владимира ДЗМ» 30.11.2021 в 02:40 с жалобами на остро появившиеся (в 01:30) боли в животе и подозрением на аппендицит. Из анамнеза жизни известно, что наследственность не отягощена; хронические заболевания и перенесенные ранее операции отрицает. Развитие в соответствии с возрастом, рост 175 см, масса тела 73 кг, нормостеник. Контакты с инфекционными больными или носителями отрицал.
При поступлении в приемное отделение в сознании, температура 36,6 °С, ЧСС 90 в 1 мин, жалобы на боли в животе. Насморка, кашля, рвоты нет. Стул был накануне, оформленный. При осмотре: кожа без сыпи; слизистые, доступные осмотру, чистые, влажные; лимфоузлы не увеличены, безболезненные; язык влажный, с белым налетом. Живот не вздут, симметричен, участвует в акте дыхания, мягкий, доступен глубокой пальпации; локально определяется болезненность в правой подвздошной области, сомнительные перитонеальные знаки. Диурез не нарушен. Было принято решение о госпитализации в хирургическое отделение с диагнозом «Острый аппендицит?» для наблюдения и обследования. Взят мазок из носа и ротовой полости на SARS-CoV-2 в соответствии с обязательным обследованием в приемном отделении.
В хирургическом отделении в 03:20: боль в животе сохраняется, рвоты и стула не было. Живот мягкий, участвует в акте дыхания; отмечается болезненность живота в нижних отделах; симптомы раздражения брюшины отрицательные. В общем анализе крови (ОАК) (02:53) при отсутствии лейкоцитоза (8,5×109/л) доля нейтрофилов повышена (76,3%). Заключение хирурга: на момент осмотра диагноз не ясен; целесообразно продолжить наблюдение в динамике, проводить дообследование. При последующих осмотрах хирургом болезненность в правой подвздошной области сохраняется, перитонеальные симптомы отрицательные. Пациент нуждается в дообследовании.
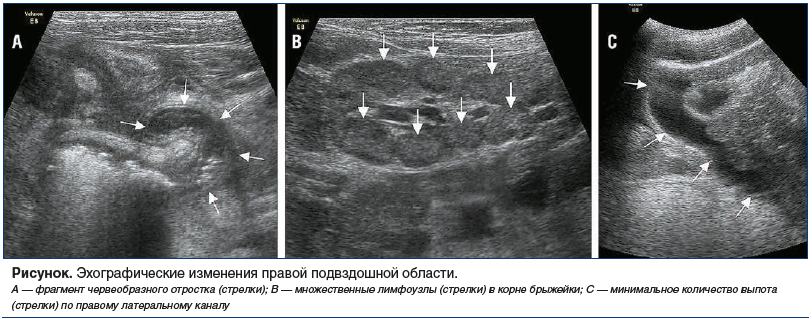
В 08:30 при УЗИ органов брюшной полости выявлены воспалительные изменения визуализируемого фрагмента червеобразного отростка (утолщен до 9 мм, протяженностью до 38 мм). Фрагменты кишечных петель около аппендикса с утолщенной до 3 мм стенкой практически не перистальтируют (локальный кишечный стаз). В правой подвздошной области и по ходу корня брыжейки определялись гипоэхогенные овальной формы лимфоузлы до 9–11 мм в диаметре. Также выявлены эхо-признаки ренальных дисметаболических нарушений, реактивных изменений паренхимы поджелудочной железы и стенок желчного пузыря, минимальное количество выпота в брюшной полости (см. рисунок).
На совместном консилиуме хирургов (заведующий отделением, лечащий врач, дежурный хирург) с учетом результатов клинического наблюдения (сохранение болевого синдрома) и наличием эхографических проявлений ОА принято решение о необходимости лапароскопии. Аппенд-эктомия выполнена лапароскопически с использованием видеоэндоскопических технологий под ингаляционным эндотрахеальным наркозом лигатурным способом. Червеобразный отросток расположен типично, гиперемирован, напряжен, утолщен до 0,9 см. Мутный выпот в области малого таза взят на посев. Рана ушита наглухо. Аппендикс отправлен на гистологическое исследование.
Послеоперационный диагноз: «Флегмонозный аппендицит». Микроорганизмы в абдоминальной жидкости не обнаружены. Макроскопическая картина: отросток длиной 4 см, диаметр 0,6 см, серозная оболочка тусклая с наложением фибрина, на разрезе стенка утолщена, точечный просвет. Микроскопическая картина: эпителий частично отсутствует. В стенке — очаговая лимфолейкоцитарная инфильтрация, расстройства кровообращения. Краевое стояние лейкоцитов, липоматоз подслизистой основы. Серозная оболочка и брыжейка отечные, выраженная лимфолейкоцитарная инфильтрация, наложение фибрина. Заключение: морфологическая картина соответствует флегмонозному аппендициту, фибринозно-гнойному периаппендициту и мезентериолиту.
Пациенту назначены антибиотики (внутривенно цефотаксим и амикацин). Он был доставлен из операционной в ОРИТ в сопровождении анестезиолога-реаниматолога в состоянии частичной медикаментозной седации. Дыхание самостоятельное: FiO2 21%, SpO2 99%, без дотации кислорода. ЧДД 18 в 1 мин, хрипов нет. К 18:00 30.11.2021 отмечена положительная динамика за счет восстановления сознания, начала энтеральной нагрузки. Послеоперационные раны без признаков воспаления. Пробуждение после наркоза без особенностей. Показано наблюдение хирургом с коррекцией питания по клиническим и лабораторным показателям. Однако в ОРИТ пациент провел несколько часов, так как был получен положительный результат исследования на SARS-CoV-2 носоротоглоточного мазка, обусловивший перевод в инфекционное отделение на койку обсервации. Продолжена инфузионная внутривенная терапия сбалансированными солевыми растворами с учетом энтерального питания, внутривенная антибактериальная терапия (цефотаксим 1 г 3 р/сут и амикацин 400 мг 2 р/сут капельно). В динамике: дыхание самостоятельное, хрипов нет, ритм регулярный, экскурсия грудной клетки удовлетворительная; в дотации кислорода не нуждается (SpO2 96%). Налет на языке отсутствует. Вздутия живота, болезненности при пальпации нет. Диурез адекватный проводимой терапии. При осмотре педиатром отмечена гиперемия слизистой ротоглотки, небных дужек, везикулярное дыхание в легких. В терапии оставлено внутривенное введение антибиотиков, добавлен умифеновир, с целью коррекции водно-электролитного баланса продолжена инфузионная терапия. Течение коронавирусной инфекции без проявления дыхательной недостаточности. При КТ-исследовании грудной клетки очаговых и инфильтративных изменений не выявлено. В терапии введено: в нос физиологический раствор по 3 капли 3 р/сут, очистительная клизма при отсутствии стула.
В локальном статусе: послеоперационные раны без особенностей. В последующие дни катаральные симптомы со стороны верхних дыхательных путей уменьшились. На фоне проводимой терапии к 07.12.2021 респираторных явлений нет. Послеоперационный период без осложнений. Антибактериальная терапия завершена. В ОАК (07.12.2021) гемоглобин 160 г/л, лейкоциты 7,65×109/л, лимфоциты 23%, моноциты 8%, нейтрофилы 65%. Белки острой фазы: С-реактивный белок 42 мг/л (норма 0–6 мг/л), ферритин 100,6 мкг/л (норма 6–320 мкг/л). Показатели АЛТ, АСТ, мочевины, креатинина, метаболитов крови (концентрации билирубина, глюкозы, лактозы) и электролитов (натрий, калий) — в пределах референсных значений.
Данный клинический пример демонстрирует течение коронавирусной инфекции (выявленной при лабораторном обследовании) без дыхательной недостаточности, с флегмонозным аппендицитом, неосложненным течением при своевременно назначенной терапии. На основании клинической картины и лабораторных данных с самого начала болезни невозможно было заподозрить коронавирусную инфекцию, поскольку на первый план в симптоматике выступил болевой абдоминальный синдром, а катаральные явления отсутствовали. Лишь инструментальные методы обследования позволили выставить диагноз ОА, а мазок из носоглотки методом ПЦР — SARS-CoV-2-инфекцию, что позволило обосновать проведение адекватного своевременного лечения: хирургического и противовирусного. Подобная тактика обеспечила неосложненное течение послеоперационного периода, способствовала выздоровлению пациента с последующей выпиской из стационара под наблюдение участкового педиатра.
Наши данные совпадают с данными других авторов, согласно которым у пациентов с COVID-19 также развивались различные желудочно-кишечные проявления, которые не сопровождались респираторными симптомами [41]. Результаты метаанализа Z. Pogorelić et al. [42] указывают на значительно более высокую заболеваемость осложненным аппендицитом у детей во время пандемии COVID-19, чем в период до пандемии. A.G. Willms et al. [43] изучили в общей сложности 1915 аппендэктомий из 41 больницы Германии и обнаружили, что в период пандемии частота осложненного аппендицита значительно возросла, в то время как частота негативных аппендэктомий значительно снизилась.
Заключение
Таким образом, резюмируя вышесказанное, необходимо отметить, что лечение ребенка, госпитализированного с абдоминальным болевым синдромом, требует персонифицированого подхода и должно осуществляться с учетом клинической картины и тяжести течения болезни. Схожесть клинических проявлений острого состояния, требующего неотложной хирургической помощи (острый аппендицит), и острого инфекционного заболевания, сопровождающегося болями в животе, подчеркивает необходимость включения в план ведения пациентов вирусологического обследования всех больных при поступлении в многопрофильный стационар, что в определенной мере будет способствовать ускорению сроков выявления больных с COVID-19, что еще и важно для предупреждения ее распространения в больнице. Необходимы дальнейшие исследования.
.
Информация с rmj.ru






