Содержание статьи
Агонист опиатных рецепторов тримебутин в терапии функциональных расстройств желчного пузыря и сфинктера Одди
Э. П. Яковенко, доктор медицинских наук, профессор
Н. А. Агафонова, кандидат медицинских наук
А. В. Яковенко, кандидат медицинских наук
А. Н. Иванов, кандидат медицинских наук
А. В. Каграманова, кандидат медицинских наук
ГБОУ ВПО РНИМУ им. Н. И. Пирогова, Москва
Заболевания билиарной системы, как органические, так и функциональные, относятся к одной из наиболее распространенных патологий человека [1]. Патология билиарного тракта у большинства пациентов сочетается с функциональными и/или структурными нарушениями двенадцатиперстной кишки (ДПК), которая входит в единую функциональную систему, обеспечивающую нормальную деятельность желчного пузыря (ЖП), отводящих протоков и сфинктера Одди, и, по выражению А. М. Уголева, является гипоталамо-гипофизарной системой брюшной полости.
Дискоординация между сокращениями ЖП и тонусом сфинктеров билиарной системы лежит в основе формирования абдоминального болевого синдрома билиарного типа, для которого характерно наличие болевых приступов в эпигастрии и/или в правом верхнем квадранте живота длительностью 30 мин и более с сохраняющейся на постоянном уровне умеренной или достаточно выраженной интенсивностью, рецидивирующих с различными интервалами (не обязательно ежедневно), приводящих к нарушению повседневной активности или поступлению пациента в отделение неотложной помощи. Боли не купируются после стула, при перемене положения тела, приемом антацидов и при этом отсутствуют другие заболевания, которые могли бы объяснять их наличие. Боли могут сочетаться с одним или более из нижеследующих симптомов: тошнота или рвота, иррадиация в спину и/или правую подлопаточную область, возникновение в ночные часы. При функциональном расстройстве желчного пузыря (ФРЖП) во время болевого приступа отмечается нормальный уровень сывороточного билирубина, аминотрансфераз, щелочной фосфатазы, амилазы или липазы. При функциональном расстройстве сфинктера Одди (ФРСО) билиарного типа допускается транзиторное повышение сывороточного билирубина, аминотрансфераз, щелочной фосфатазы, а при ФРСО панкреатического типа — амилазы и/или липазы [2].
Моторные нарушения, а также микробная контаминация ДПК, приводящие к развитию дуоденальной гипертензии, лежат в основе формирования эпигастрального болевого синдрома не билиарного типа и ряда кишечных диспепсических расстройств. С дуоденальной гипертензией связано развитие и/или утяжеление течения ряда заболеваний желудочно-кишечного тракта, анатомически и функционально связанных с ДПК.
В настоящее время принято различать первичные функциональные дискинезии желчевыводящих путей и ДПК, при которых отсутствует органическая патология, и вторичные, которые сочетаются со структурными изменениями билиарного тракта и ДПК, однако принципы их коррекции не имеют существенных различий [3–5].
Основные направления в лечении первичных и вторичных функциональных расстройств билиарного тракта сводятся к нормализации тонуса сфинктеров билиарной системы и снижению дуоденального давления [6, 7]. Для купирования абдоминального болевого синдрома традиционно используются лекарственные препараты, нормализующие моторную функцию билиарной системы и кишечника: спазмолитики или прокинетики [8].
Однако у значительной части пациентов наблюдаются сочетанные и разнонаправленные нарушения моторики ЖП, сфинктера Одди и кишечника и, в первую очередь, ДПК, что существенно затрудняет выбор препаратов для их коррекции. В данной ситуации целесообразно использовать агонист опиатных рецепторов тримебутин, который широко применяется в нормализации как спастической, так и гипомоторной дискинезии кишечника [9, 10]. Однако имеются лишь единичные публикации об использовании тримебутина при моторных нарушениях билиарного тракта [11], в то же время остается не изученным его влияние на моторику ДПК.
Целью исследования было изучить терапевтическую эффективность, безопасность и переносимость препарата тримебутин (Тримедат®) у больных с первичными и вторичными функциональными расстройствами ЖП и сфинктера Одди билиарного типа.
Материал и методы исследования
В течение 2007–2013 гг. нами в открытое проспективное исследование эффективности и безопасности препарата Тримедат® было включено 96 пациентов (62 женщины и 34 мужчины) с патологией билиарного тракта, из них 56 с ФРЖП (24 — с отсутствием структурных изменений ЖП и 32 — с наличием хронического бескаменного холецистита в фазе ремиссии) и 40 — с ФРСО билиарного типа, развившимся после холецистэктомии.
Критерием включения больных в исследование явилось наличие болевого абдоминального синдрома билиарного типа, обусловленного нарушением функции ЖП и/или сфинктера Одди (с учетом диагностических признаков Римского консенсуса III). Из исследования исключались больные с воспалительными процессами билиарной системы, требующими хирургического лечения; с изменениями в клинических и биохимических анализах крови, принимающие препараты менее чем за 28 дней до включения в исследование, влияющие на моторную функцию ЖКТ; с онкологическими заболеваниями; с установленным диагнозом «алкоголизм II–III стадии»; с декомпенсированными или нестабильными заболеваниями, затрудняющими оценку эффективности лечения; с непереносимостью исследуемого препарата; при одновременном участии в другом клиническом исследовании, а также женщины, беременные или кормящие грудью. Каждым больным было подписано информированное согласие на участие в исследовании, проведение которого было одобрено локальным этическим комитетом РНИМУ им. Н. И. Пирогова.
Всем пациентам были проведены клинические исследования; эндоскопия желудка и ДПК с детальным изучением состояния большого дуоденального сосочка; ультразвуковое исследование (УЗИ) печени, ЖП и билиарных протоков; клинический анализ крови, мочи; биохимический анализ крови с определением активности аминотрансфераз (аспартатаминотрансфераза и аланинаминотрансфераза), гаммаглютамилтрансферазы (ГГТ), общего билирубина, креатинина. Значительной части пациентов с клиническими признаками кишечной диспепсии была проведена ректороманоскопия, ирригоскопия или колоноскопия и по показаниям — компьютерная томография органов брюшной полости. Для выявления избыточного бактериального роста в тонкой кишке всем больным до и через месяц от начала терапии был выполнен лактулозный водородный дыхательный тест с использованием анализатора концентрации ионов водорода в выдыхаемом воздухе EC60 Gastrolyzer (Bedfont Tech. Inst., Великобритания).
Для изучения функционального состояния ЖП и сфинктера Одди использовалась стандартизированая методика динамической ультразвуковой холецистографии с проведением пробы с пищевым раздражителем, содержащим 30 г жира и измерением объема ЖП и диаметра холедоха до и каждые 15 минут в течение 90 минут после приема пробного завтрака. Выделялись следующие типы моторики ЖП: нормальная, гипомоторная и гипермоторная.
Моторная функция ДПК оценивалась с использованием рентгенологического метода. Основными признаками моторных нарушений считались: задержка контраста и/или скопление бария в нижней горизонтальной ветви ДПК свыше 30 сек, эктазия кишки, усиление или снижение перистальтической активности, наличие антиперистальтических волн. Рентгенологическое исследование было выполнено 27 пациентам до начала терапии тримебутином.
В процессе терапии тримебутином нами учитывалась динамика следующих клинических синдромов и симптомов: болевой абдоминальный синдром билиарного типа; эпигастральный болевой синдром не билиарного типа, связанный, главным образом, с моторными нарушениями ДПК (тяжесть и/или тупые, часто опоясывающие боли в эпигастрии, появляющиеся или усиливающиеся сразу после еды, при пальпации определяется болезненность и урчание в проекции ДПК); диспепсические расстройства, обусловленные дуоденальной гипертензией (горечь во рту, чувство быстрого насыщения, обильные воздушные отрыжки или срыгивания горького содержимого, тошнота, реже рвота желчью).
Препарат Тримедат® назначался по 200 мг 3 раза в день за 30 мин до еды, в течение 28 дней. Больным с наличием избыточного бактериального роста в тонкой кишке дополнительно назначались в течение 7–10 дней или рифаксимин (Альфа Нормикс) 600–800 мг/сутки, или Ципрофлоксацин 1000 мг/сутки, или Доксициклин 100 мг сутки — антибиотики, не влияющие на моторную функцию желудочно-кишечного тракта.
Эффективность лечения препаратом Тримедат® оценивалась только по его влиянию на абдоминальный болевой синдром билиарного типа, который является основным диагностическим тестом функциональных расстройств ЖП и сфинктера Одди [2]. Анализ результатов терапии проводился через 4 недели от начала и через 4 недели после окончания лечения. Использовались следующие критерии: ремиссия, при которой наблюдалось полное исчезновение абдоминальных болей билиарного типа; улучшение — значительное уменьшение частоты развития и интенсивности болевого синдрома (при появлении болевого приступа больной не прибегал к дополнительному приему других медикаментов); без эффекта — сохранение болевых приступов в течение 7–10 дней от начала лечения; рецидив — при повторном появлении абдоминального болевого синдрома в течение 28 дней после окончания лечения у больного с наличием ремиссии, достигнутой в процессе курсового лечения тримебутином. В то же время нами изучалась динамика симптомов, связанных с дуоденальной гипертензией. При статистической обработке полученных результатов использовался критерий χ2. Различие между изучаемыми параметрами считались достоверными при р < 0,05.
Результаты исследования
При первичном исследовании у всех наблюдаемых больных выявлялся абдоминальный синдром билиарного и у 56 (58,3%) — не билиарного типа, у 84 (87,5%) — сочетанные диспепсические нарушения, из них у 54 (56,3%) — обусловленные дуоденальной гипертензией. При этом частота выявления болей не билиарного типа и диспепсических нарушений, обусловленных дуоденальной гипертензией, была существенно выше у больных ЖКБ после проведенной холецистэктомии.
Моторная функция ЖП была изучена у всех пациентов до и по окончанию терапии и у 43 — через месяц после прекращения лечения. Из 56 пациентов с ФРЖП у 29 (51,8%) была выявлена гипермоторная, у 19 (33,9%) — гипомоторная, у 8 (14,3%) — нормальная функция ЖП. При этом из 32 больных с наличием хронического холецистита и из 24 — с ФРЖП, гипермоторная дискинезия имела место у 9 (28,%) и у 20 (83,3%), гипомоторная — у 18 (56,3%) и у 1 (4,2%) пациента соответственно.
Моторная функция ДПК до начала терапии была изучена у 27 пациентов с наличием диспепсических нарушений, обусловленных дуоденальной гипертензией, из них у 6 — с ФРЖП и у 21 — с ФРСО. Моторные нарушения ДПК были выявлены у 25 (92,6%) больных, из них гипомоторная дискинезия отмечалась у 18 (66,7%), гипермоторная — у 7 (25,9%), при этом из 21 пациента с ФРСО гипомоторная дискинезия имела место у 20 (95,2%).
Избыточный бактериальный рост в тонкой кишке имел место у 67 (69,8%) пациентов и частота его выявления существенно не различалась у больных с ФРЖП и ФРСО.
Динамика клинических признаков и моторной функции ЖП по окончании и через 4 недели после прекращения терапии тримебутином представлена в табл. 1.
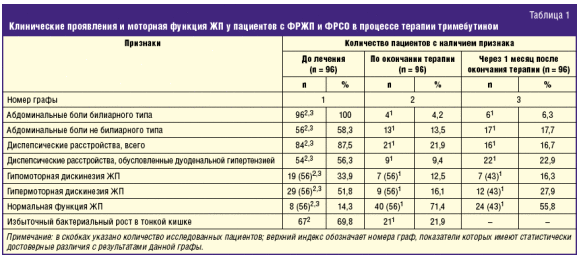
К окончанию курсового лечения препаратом Тримедат® и через месяц после его прекращения у 92 (95,8%) и у 90 (93,8) больных соответственно отсутствовали абдоминальные боли билиарного типа. Отмечено существенное снижение частоты выявления болевого абдоминального синдрома не билиарного типа, диспепсических нарушений, в том числе и обусловленных дуоденальной гипертензией. Таким образом, проведенный анализ частоты выявления клинических симптомов показал, что положительный эффект, достигнутый к окончанию курсового лечения тримебутином, сохранялся у большинства больных и через месяц после прекращения терапии
У значительной части пациентов к окончанию терапии достигнута нормализация моторной функции ЖП, при этом прием тримебутина оказывал положительный эффект как при гипомоторной, так и при гипермоторной дискинезии ЖП. Для оценки влияния препарата Тримедат® на тонус сфинктера Одди нами изучен диаметр холедоха до и через 4 недели после окончания терапии. В результате оказалось, что у больных с ФРЖП в процессе лечения диаметр холедоха существенно не изменялся и составил 5,3 ± 0,3 мм и 5,1 ± 0,5 мм до и после лечения соответственно. В группе больных с ФРСО исходный диаметр холедоха был значительно шире, чем у пациентов с ФРЖП, и к окончанию лечения значительно уменьшился с 8,1 ± 0,5 до 5,8 ± 0,3 мм (р < 0,05).
Оценка эффективности курсовой терапии тримебутином была проведена всем больным, включенным в исследование. В результате оказалось, что клиническая ремиссия заболевания имела место у 95,8% и 93,8%, улучшение — у 4,2% и 2,1%, к окончанию терапии и через 4 недели после прекращения лечения соответственно. Рецидивы заболевания имели место у 4,2% больных, перенесших холецистэктомию (табл. 2).
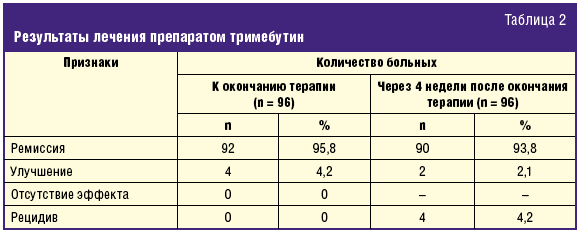
Таким образом, курсовая терапии препаратом тримебутин оказалась высокоэффективной в купировании и профилактике рецидива абдоминального болевого синдрома билиарного типа, при этом положительный эффект сохранялся и в течение 4 недель после ее прекращения.
Препарат хорошо переносился пациентами, нежелательных явлений и побочных эффектов зарегистрировано не было, как же как и патологических изменений в клиническом анализе крови и мочи, а также в биохимических показателях.
Обсуждение
При проведении данного исследования была изучена эффективность применения тримебутина у больных ФРЖП и ФРСО билиарного типа. Было установлено, что у наблюдаемых пациентов наряду с типичными абдоминальными болями билиарного типа, свойственными функциональным расстройствам билиарного тракта [2], у 58,3% пациентов были выявлены эпигастральные боли не билиарного типа и у 87,5% — диспепсические кишечные расстройства. Для уточнения механизмов их развития нами изучена моторная функция ДПК и состояние тонкокишечной микробиоты. При анализе результатов рентгенологического исследования было установлено, что у пациентов с функциональными расстройствами билиарного тракта преобладала гипомоторная дискинезия ДПК (66,7%) как с наличием ФРЖП (53,8%), так и при ФРСО (61,3%). Замедление кишечной моторики, как известно, является одним из ведущих факторов риска развития избыточного бактериального роста в тонкой кишке [12], что было подтверждено и результатами собственных исследований. Так, избыточный бактериальный рост в тонкой кишке был выявлен у 69,8% включенных в исследование пациентов с наличием преимущественно гипомоторной дискинезии ДПК.
Основная роль в терапии функциональных расстройств билиарной системы, развитие которых связано с повышением тонуса сфинктеров ЖП и большого дуоденального сосочка, принадлежит спазмолитическим средствам. В то же время наличие гипомоторной дискинезии ДПК лимитирует их прием. В данной ситуации использование эукинетика тримебутина, который нормализует моторику желудочно-кишечного тракта независимо от ее исходного уровня, патогенетически обосновано. Тримебутин, являясь агонистом периферических µ-, κ- и δ-опиатных рецепторов, модулирует высвобождение желудочно-кишечных пептидов, таких как мотилин, вазоактивный кишечный пептид, гастрин и глюкагон. В связи с тем, что опиатные рецепторы обнаруживаются в центральной нервной системе, в периферических нервных окончаниях, межмышечном нервном сплетении, а также в клетках гладких мышц, следует предполагать, что они участвуют в регуляции моторики всех отделов пищеварительного тракта. Проведенные в конце 1970-х и начале 1980-х гг. многочисленные экспериментальные и клинические исследования показали, что тримебутин ускоряет эвакуацию из желудка, индуцирует преждевременную фазу III мигрирующего моторного комплекса в кишечнике и модулирует сократительную способность толстой кишки, а также снижает висцеральную чувствительность кишечника и обладает местным обезболивающим действием [13]. В клинической практике тримебутин оказался эффективным как в купировании болевого синдрома у больных синдромом раздраженного кишечника [9, 14], что свидетельствует о его спазмолитическом эффекте, так и в разрешении кишечной непроходимости после оперативных вмешательств и идиопатической псевдообструкции, в том числе и у детей [10], что обусловлено прокинетическим действием препарата. Следовательно, тримебутин является модулятором моторики желудочно-кишечного тракта, что подтверждается также и результатами собственных исследований. Так, к окончанию месячного курса терапии у 95,8% и у 76,8% пациентов купировались абдоминальные боли билиарного и не билиарного типа соответственно и у 72,2% — диспепсические расстройства, связанные с дуоденальной гипертензией. При этом эффективность терапии существенно не различалась от исходного типа моторных нарушений ЖП и/или ДПК.
Таким образом, курсовая терапия препаратом тримебутин приводила к нормализации тонуса сфинктеров билиарной системы, моторики ДПК и ЖП у пациентов с функциональными нарушениями билиарного тракта независимо от исходного состояния моторной функции. К окончанию четырехнедельной терапии у 95,8% больных была достигнута клиническая ремиссия заболевания, которая сохранялась у 93,8% из них в течение месяца после отмены препарата. Препарат хорошо переносился больными, не оказывал побочных эффектов и не влиял на показатели клинического и биохимического анализа крови, что свидетельствует о его безопасности и позволяет рекомендовать для лечения пациентов функциональными расстройствами ЖП и сфинктера Одди.
Литература
- Максимов В. А., Далидович К. К., Чернышов А. Л. и др. Современная терапия заболеваний органов пищеварения. М.: Издательство АдамантЪ, 2011. 712 с.
- Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process // Gastroenterology. 2006. Vol. 130. P. 1З77–1З90.
- Лоранская И. Д., Вишневская В. В. Изучение моторной функции желчевыделительной системы и гастродуоденальной зоны при патологии билиарного тракта // Русский медицинский журнал. 2005. Том 7, № 1. С. 2–7.
- Яковенко Э. П., Григорьев П. Я., Агафонова Н. А. и др. Дисфункция сфинктера Одди, связанная с холецистэктомией (диагностика, лечение) // Практикующий врач. 2000. № 17. С. 26–30.
- Romеro Y., Johnson L., Thistlе G. L., Longstrеth G. F. et al. Quеstionnairе for thе Assessment of Biliary Symptoms // Am. J. Gastroenterol. 2003. Vol. 98. P. 1042–1051.
- Минушкин О. Н. Дисфункциональные расстройства билиарного тракта (патофизиология, диагностика и лечебные походы). М., 2002. 20 с.
- Яковенко Э. П. Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии // Клиническая фармакология и терапия. 2002. № 1. С. 1–4.
- Самсонов А. А., Никушина И. Н., Павлеева Е. Е. Диагностика и терапия функциональных расстройств билиарного тракта // Фарматека. 2013. № 6. С. 98–105.
- Lee S. W., Kirn I. S., Song J. H. et al. Clinical trial of polybutine (trimebutine maleate) in patients with irritable colon syndrome // N. Med. J. (Seoul). 1981. Vol. 24. Р. 52–59.
- Akhoue Y., Chaussade S., Guerre J. et al. Manometrie de l’intestin grele dans le diagnostic des maladies motrices de l’intestin grele: interet d’une stimulation pharmacologique par la trimebutine. (Abstract) // Gastroenterol. Clin. Bio. 1990. Vol. 14. Р. А10.
- Яковенко Э. П., Агафонова Н. А., Яковенко А. В. и др. Эффективность агониста опиатных рецепторов тримебутина в терапии нарушений моторной функции желчевыводящих путей // Consilium medicum. 2008. № 8. С. 52–57.
- Toskes P. P., Kumar A. Enteric bacterial flora and bacterial overgrowth syndrome // Sleisenger & Fordtrans’s Gastroentestinal and Liver Disease. 2003. Vol. 2. P. 1523–1548.
- Delvaux M., Wingate D. Trimebutine: mechanism of action effects on gastrointestinal function and clinical results // J. Int. Med. Res. 1997. Vol. 25 (5). P. 225–246.
- Ghidini O., Saponati G., Intrieri L. Single drug treatment for irritable colon: rociverine versus trimebutine maleate // Curr. Ther. Res. 1986. Vol. 39. Р. 541–548.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







