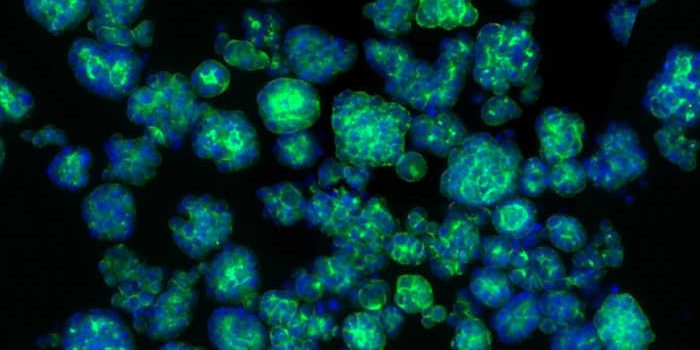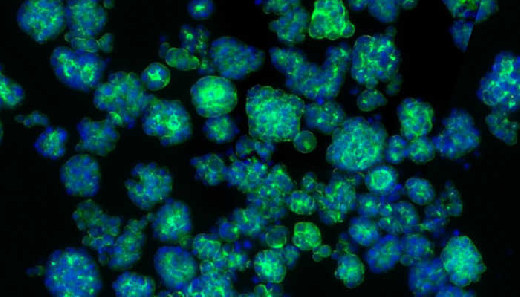
Рак поджелудочной железы подпитывается связями с нервной системой. Об этом сообщают ученые из Немецкого центра исследований рака (DKFZ) и Гейдельбергского института технологий стволовых клеток и экспериментальной медицины (HI-STEM) в своей текущей публикации в Nature. Группа обнаружила, что опухоль специально перепрограммирует нейроны для собственной выгоды. У мышей блокирование функции нерва подавляло рост рака и повышало чувствительность опухолевых клеток к определенным видам химиотерапии и иммунотерапии.
В течение нескольких лет ученые обнаруживали взаимодействия с нервной системой практически во всех изученных типах рака, взаимодействия, которые во многих случаях способствуют росту и выживанию опухоли. Это касается и рака поджелудочной железы, который переплетен густой сетью нервов. Однако в опухоль проецируются только нервные волокна, тогда как ядра нервных клеток лежат далеко снаружи, в ганглиях, центрах управления периферической нервной системы. Поэтому ранее было неясно, в какие молекулярные взаимодействия они вступают с раковыми клетками.
Используя недавно разработанный метод, группа под руководством Андреаса Трамппа, DKFZ и HI-STEM впервые успешно провела молекулярное исследование нервных клеток как в здоровых тканях, так и в тканях рака поджелудочной железы у мышей.
В опухолях поджелудочной железы нервы чрезвычайно хорошо разветвлены и контактируют с большинством опухолевых клеток. Благодаря детальному молекулярному анализу отдельных нейронов в опухоли, исследователи обнаружили, что рак поджелудочной железы перепрограммирует генную активность нервов для собственной выгоды. Активность многих генов увеличивается или уменьшается, что приводит к опухолеспецифической сигнатуре.
Более того, даже после хирургического удаления первичной опухоли нервная система опухоли сохранила свои свойства, способствующие развитию рака: когда ученые реимплантировали клетки рака поджелудочной железы животным, перенесшим операцию, полученные вторичные опухоли были в два раза больше, чем у мышей, которым клетки рака поджелудочной железы были трансплантированы впервые.
Помимо прямого взаимодействия с раковыми клетками, нервные клетки оказывают влияние, в частности, на фибробласты опухоли (CAF – cancer-associated fibroblasts), которые составляют большую часть опухолевой массы. Они также стимулируются к росту и вносят значительный вклад в подавление иммунной защиты в опухолевой среде.
Когда симпатические нервные связи с поджелудочной железой были хирургически разорваны или разрушены специальными нейротоксинами, рост опухоли был значительно подавлен. В то же время активность генов, способствующих росту, в раковых клетках, а также в CAFs снизилась. В CAFs исследователи наблюдали значительное увеличение активности провоспалительных генов после того, как нервы были разрушены.
«По-видимому, нейронные связи при раке поджелудочной железы подавляют провоспалительную активность фибробластов, тем самым подавляя защиту от рака со стороны иммунных клеток», — говорит соавтор исследования Вера Тиль.
Если прерывание нервных связей, по-видимому, имеет воспалительный эффект, т. е. активирует иммунную систему, это может повысить эффективность иммунотерапии с использованием так называемых ингибиторов контрольных точек (ИКТ). Препараты этой группы, образно говоря, отпускают «тормоза» иммунной системы. Однако они не могут бороться с карциномами поджелудочной железы самостоятельно: опухоли считаются иммунологически «холодными», то есть терапевтически важные Т-клетки просто не могут добраться до опухоли.
Когда исследователи заблокировали нейронную связь с опухолью поджелудочной железы в мышиной модели с помощью целевого нейротоксина, опухоль снова стала чувствительной к ингибитору контрольной точки ниволумабу, а масса опухоли сократилась до одной шестой массы у контрольных животных. «Блокируя нервы, нам удалось превратить иммунологически холодную опухоль в чувствительную к иммунотерапии», — говорит соавтор исследования Саймон Рендерс.
Препарат наб-паклитаксел является компонентом стандартной химиотерапии рака поджелудочной железы. Помимо ингибирования деления клеток, он также влияет на чувствительные нервы, поэтому периферическая нейропатия является одним из известных тяжелых побочных эффектов этого препарата.
Команда Трамппа показала, что при повторных циклах наб-паклитаксела сенсорные нервные волокна в опухоли резко сократились. Масса опухоли также уменьшилась, как и ожидалось. Влияние на сенсорные нервы, по-видимому, является частью эффективности препарата против рака поджелудочной железы. Однако оставшиеся нервные волокна сохранили свою генную активность, способствующую развитию рака, даже во время лечения.
Но что происходит, когда опухоль полностью отрезана от своих нейронных связей? Исследователи достигли этого, обрабатывая мышей наб-паклитакселом (для блокирования сенсорных нервов) и нейротоксином для отключения симпатических нейронов. Эта комбинация имела синергетический эффект и уменьшила массу опухоли более чем на 90 процентов.
«Результат подчеркивает, что оба типа нервных клеток имеют функциональную значимость для роста опухоли», — объясняет Вера Тиль. «Полная блокада связи между нервами и опухолью в сочетании с химиотерапией и/или ингибиторами иммунных контрольных точек является многообещающим подходом для более эффективной борьбы с раком поджелудочной железы в будущем. Например, можно уменьшить размер опухолей до такой степени, что они впоследствии станут резектабельными», — резюмирует Трампп. Его команда вместе с врачами из университетской больницы Гейдельберга уже планирует ранние клинические испытания для проверки этой стратегии на пациентах с раком поджелудочной железы.
Для исследования того, какие типы периферических нервов влияют на развитие рака поджелудочной железы, необходима полностью развитая нервная система неповрежденного организма. Кроме того, целью работы было изучение взаимодействия между нервной системой и опухолью как потенциальной мишенью для новых терапевтических подходов. Для того чтобы обнаружить возможные синергии с собственной защитной системой организма, также необходима иммунная система со всеми ее компонентами. Оба не могут быть воспроизведены в системах клеточных или органных культур.
Иллюстрация к статье:
материал med2.ru