Введение
Helicobacter pylori — это грамотрицательные микроаэрофильные изогнутые или S-образные бактерии, обладающие высокой подвижностью и колонизирующие слизистую оболочку желудка (СОЖ) человека, вызывая развитие хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, рака желудка, а также лимфомы лимфоидной ткани СОЖ (MALT-лимфомы) [1]. Впервые бактерия H. pylori была выделена в 1982 г. Б. Маршаллом и Р. Уорреном [2]. Это открытие стало началом новой эры в изучении патологии желудка. Язвенная болезнь, считавшаяся ранее исключительно кислотозависимым заболеванием, с этого момента стала считаться инфекционным заболеванием. Эрадикационная терапия инфекции H. pylori начала использоваться в клинической практике как стандартная терапия язвенной болезни желудка и двенадцатиперстной кишки. За это открытие Б. Маршалл и Р. Уоррен были удостоены Нобелевской премии по физиологии и медицине в 2005 г. В настоящее время продолжается поиск новых способов лечения инфекции H. pylori. Это связано с тем, что инфекция H. pylori по-прежнему широко распространена в мире, а рак желудка остается серьезной проблемой, занимая пятое место по уровню заболеваемости в мире и третье — в структуре смертности от онкологических заболеваний [3].
В 2020 г. в г. Тайбэе прошла встреча с целью достижения мирового соглашения в отношении скрининга и эрадикации H. pylori для профилактики развития рака желудка среди широких слоев населения [4]. В итоговом документе были представлены утверждения, имеющие разную степень доказательности. Наиболее актуальные из них подчеркивают тот факт, что несмотря на то, что в большинстве западных стран распространенность H. pylori уменьшается, она остается относительно высокой среди населения в странах с высокой заболеваемостью раком желудка. При этом H. pyloriявляется причиной рака желудка более чем в 85% случаев, следовательно, большинство случаев заболевания можно предотвратить, устранив инфекцию. Эрадикация H. pylori снижает риск развития рака желудка у инфицированных индивидуумов. При этом антихеликобактерную терапию для профилактики рака желудка рекомендуется проводить до развития атрофического гастрита и кишечной метаплазии. Наибольшую пользу в этом случае получают молодые люди, так как они могут полностью излечиться от хронического гастрита, ассоциированного с H. pylori, что существенно снижает риск развития рака желудка, и, кроме того, устраняется возможность передачи инфекции H. pylori их детям [4, 5]. Анализ ситуации с распространенностью инфекции H. pylori и заболеваемостью раком желудка в нашей стране подчеркивает актуальность положений Тайбэйского консенсуса [5]. В целом консенсус призывает проводить скрининг и лечение инфекции H. pylori как можно раньше и как можно шире.
Современные подходы к эрадикационной терапии
Традиционно схемы эрадикационной терапии состоят из комбинации нескольких антибактериальных препаратов и ингибитора протонной помпы (ИПП). Однако с учетом тенденции к снижению эффективности стандартных схем эрадикационной терапии, наблюдающейся в различных регионах мира, а также отсутствия принципиально новых препаратов для лечения инфекции H. pylori особую актуальность приобретают аспекты оптимизации существующих схем эрадикации [6, 7]. В связи с этим одним из многообещающих дополнительных компонентов, повышающих эффективность эрадикационных схем лечения заболеваний, ассоциированных с инфекцией H. pylori, является использование средств, оказывающих цитопротективное действие по отношению к СОЖ [8, 9].
Ребамипид
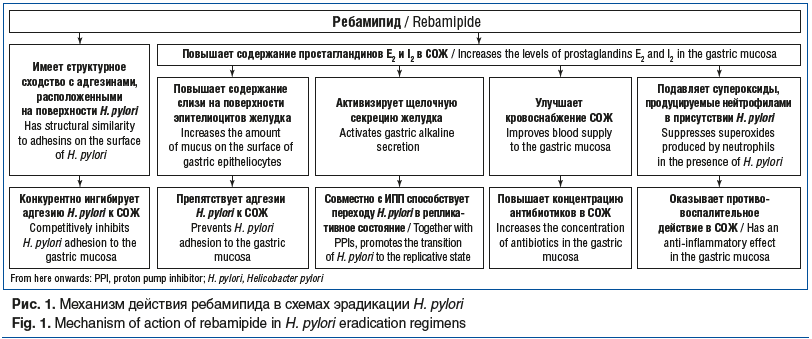
Одним из препаратов, обладающих цитопротективным действием, является ребамипид. Ребамипид представляет собой оптически активное производное α-аминокислоты 2(1H)-хинолинона, которое было внедрено в клиническую практику в Японии в 1990 г. [10, 11]. Противоязвенный эффект ребамипида был доказан на модели язвы желудка, индуцированной уксусной кислотой, у крыс [12]. Механизм действия ребамипида связан с индукцией синтеза простагландинов Е2 и I2 в СОЖ, что приводит к улучшению кровотока, снижению проницаемости, повышению секреции желудочной слизи, увеличению экспрессии эпидермального фактора роста, что усиливает регенерацию. Кроме того, ребамипид обладает противовоспалительным потенциалом, способствует выведению активных радикалов кислорода и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами (рис. 1) [13]. Однако действие препарата не ограничивается только вышеуказанными механизмами. Одна из основных точек приложения ребамипида — изменение проницаемости СОЖ посредством увеличения экспрессии белков zonula occludens-1 и клаудинов [14]. K. Hashimoto et al. [15] сообщили, что перекись водорода увеличивает проницаемость эпителия желудка за счет деградации клаудина-3 в эпителиоцитах и что эти изменения устраняются ребамипидом. В исследовании T. Gweon et al. [16] установлено, что ребамипид увеличивает экспрессию клаудина-3 и клаудина-4, являющихся структурными компонентами плотных контактов эпителиоцитов СОЖ. Таким образом, ребамипид может повышать барьерную функцию СОЖ, снижая ее проницаемость. Было также установлено, что ребамипид улучшает кровоснабжение в СОЖ и оказывает регенераторное действие за счет активации в эпителиальных клетках желудка генов проангиогенного фактора роста и прямого ангиогенного действия на эндотелиальные клетки сосудов [17].
Клинические исследования подтвердили возможность лечения ребамипидом атрофического гастрита с целью профилактики рака желудка. В рандомизированном клиническом исследовании (РКИ) 2015 г. X. Han et al. [18] было показано, что длительное применение ребамипида у пациентов с хроническим гастритом приводит к снижению степени атрофии и кишечной метаплазии СОЖ, что подтверждалось уменьшением уровня экспрессии CDX2 и TFF3. В проспективном рандомизированном исследовании 2020 г., направленном на оценку эффективности ребамипида в лечении атрофического гастрита и кишечной метаплазии, также были получены данные о том, что прием ребамипида уменьшает степень атрофии и кишечной метаплазии в антральном отделе желудка, особенно у пациентов без инфекции H. pylori [19].
В настоящее время доказано, что добавление ребамипида к антихеликобактерным схемам повышает эффективность эрадикации H. pylori. Метаанализ 11 РКИ (n=1227) показал, что включение ребамипида в схемы эрадикации в 1,75 раза повышает успешность эрадикационной терапии (отношение шансов (ОШ) 1,753, 95% доверительный интервал (ДИ) 1,312–2,333, p<0,001) [20]. Полученные данные практически сопоставимы с результатами более раннего метаанализа, в которых анализировались исследования из азиатских стран (n=611). Добавление ребамипида в схемы эрадикации позволяло увеличить частоту уничтожения H. pylori на 11,9% (ОШ 1,737, 95% ДИ 1,194–2,527, p=0,0049) [21]. По данным другого метаанализа 6 РКИ (n=531), частота эрадикации H. pylori у больных, принимавших ребамипид в составе антихеликобактерной терапии, составила 90,38% (95% ДИ 86,31–93,56), а у пациентов, получавших схемы эрадикации без ребамипида, — 81,68% (95% ДИ 6,499–86,141). Метаанализ показал, что добавление ребамипида в схемы эрадикации статистически значимо повышает эффективность лечения (в 2,162 раза, 95% ДИ 1,268–3,685, p=0,005). При этом различий между результатами отдельных исследований не было получено. Даже при исключении из анализа исследования, в котором ребамипид использовался в схеме тройной терапии с добавлением висмута, статистически значимое превосходство ребамипида в схемах эрадикации по-прежнему сохранялось (ОШ 1,924, 95% ДИ 1,088–3,404, p=0,025) [22].
При исследовании частоты эрадикации H. pylori, скорости эпителизации эрозий и заживления язв у пациентов с язвенной болезнью желудка и двенадцатиперстной кишки при добавлении ребамипида в дозе 100 мг 3 р/сут к стандартной тройной эрадикационной терапии, состоящей из ИПП, кларитромицина и амоксициллина, в одном из РКИ (n=94) были убедительно продемонстрированы преимущества аддитивного эффекта ребамипида. Успешность эрадикации H. pylori возросла (ОШ 1,5, 95% ДИ 0,34–6,7), а более выраженная положительная динамика заживления эрозивно-язвенных изменений СОЖ и двенадцатиперстной кишки была отмечена к 28-му дню терапии при продлении лечения ребамипидом до 1 мес. после окончания курса антихеликобактерной терапии. При этом активность воспалительной инфильтрации СОЖ (антральный отдел) через 6 нед. от старта терапии статистически значимо снизилась по результатам гистологического исследования биоптатов, что доказывало противовоспалительную активность препарата [23].
Предположительно, обладая эффектом увеличения кровотока в СОЖ, ребамипид увеличивает концентрацию основных компонентов антихеликобактерной терапии в ней, прежде всего антибиотиков, обеспечивая более высокую частоту эрадикации H. pylori. Однако есть и другое предположение, объясняющее положительный антихеликобактерный эффект ребамипида в схемах эрадикации. В исследовании in vitro был показан антиадгезивный эффект ребамипида в отношении прикрепления H. pylori к эпителиоцитам желудка. По мнению исследователей, ребамипид может иметь некоторое структурное сходство с адгезинами, расположенными на поверхности H. pylori, тем самым конкурентно ингибировать адгезию H. pylori к СОЖ. В случае недостаточной эрадикации H. pylori может снова закрепиться на поверхности эпителиоцитов и реколонизировать СОЖ. Дополнительное свойство ребамипида — повышение секреции слизи на поверхности эпителиоцитов желудка — создает дополнительное препятствие H. pylori для его адгезии. В этой связи антиадгезивный эффект ребамипида при длительном приеме может быть использован в качестве профилактики реколонизации H. pylori и повышения эффективности антихеликобактерной терапии (рис. 1) [24].
Таким образом, в настоящее время имеются данные о потенциально канцеропревентивном действии ребамипида при долгосрочном применении и аддитивном эффекте (повышение успешности эрадикации H. pylori) при добавлении его к схемам антихеликобактерной терапии.
Эффективное подавление секреции соляной кислоты в желудке и повышение pH >5,0 имеют решающее значение для успеха эрадикации H. pylori. Связано это по крайней мере с двумя причинами. С одной стороны, менее кислая среда в желудке позволяет бактериям переходить в репликативное состояние, что делает их более чувствительными к действию антибиотиков [25]. Использование препаратов, усиливающих щелочную секрецию желудка, например ребамипида, создает дополнительные благоприятные условия в желудочной слизи для увеличения популяции делящихся микроорганизмов, которые становятся субстратом для активного воздействия антимикробных лекарственных препаратов (см. рис. 1). Ночной кислотный прорыв вследствие короткого периода полувыведения ИПП является одним из факторов неудачи антихеликобактерной терапии, так как часть H. pylori остается в нереплицируемом, но жизнеспособном состоянии, что делает их устойчивыми к терапии [26]. С другой стороны, недостаточное ингибирование кислоты во время эрадикационной терапии делает противомикробные препараты, в частности кларитромицин и амоксициллин, нестабильными в желудке, снижает их биодоступность, а впоследствии и концентрацию в СОЖ [27]. Таким образом, показатель успешности эрадикации H. pylori зависит от степени подавления кислотности желудочного сока ИПП. В этой связи синергизм ИПП и антимикробных лекарственных препаратов, кларитромицина и амоксициллина, обеспечивает успех эрадикационной терапии первой линии инфекции H. pylori (рис. 2).

Ингибиторы протонной помпы второго поколения: фокус на рабепразол
Как известно, большинство ИПП в значительной степени метаболизируются в печени посредством цитохрома P450 (cytochrome P450, CYP) в изоферменте CYP2C19, в меньшей степени — в CYP3A4. Однако ферментативная активность CYPC219 подвержена значительной генетической гетерогенности, влияющей на фармакокинетику ИПП и, следовательно, на клиническую эффективность схем эрадикации H. pylori. Выделяют 3 клинических фенотипа генетического статуса CYP2C19: быстрый и ультрабыстрый метаболизатор, промежуточный метаболизатор и медленный метаболизатор. Известно, что индивидуумы с ультрабыстрым и быстрым метаболизмом ИПП обладают высокой активностью изофермента CYP2C19, что сопровождается низкой концентрацией ИПП в плазме крови и низким значением внутрижелудочного рН, что объясняет более высокий риск терапевтической неудачи антихеликобактерной терапии при использовании ИПП первого поколения [28]. В качестве мер, повышающих эффективность лечения, рекомендуется рассмотреть удвоение дозы ИПП первого поколения или использовать ИПП второго поколения с меньшей зависимостью от метаболизма CYP2C19, такие как рабепразол или эзомепразол [29–31].
Рабепразол (Рабиет®) является необратимым ингибитором Н+/ К+-АТФ-азы. Вследствие различий в параметрах фармакокинетики и фармакодинамики рабепразол обладает рядом преимуществ с клинической точки зрения в сравнении с другими ИПП. Прежде всего, рабепразол характеризуется быстрой абсорбцией в кишечнике, в результате чего время достижения максимальной концентрации в плазме крови после однократного приема составляет ~3,5 ч. Это обеспечивает выраженное подавление кислотности, начиная с первого приема препарата, которое сохраняется до 48 ч. В свою очередь, это сопровождается более быстрым устранением симптомов заболевания, связанных с повышенной кислотной продукцией. Поскольку преобразование рабепразола происходит преимущественно путем неферментативного восстановления в тиоэфирный метаболит без значимого метаболизма в CYP2C19 и CYP3A4, на рабепразол в меньшей степени влияет генетический полиморфизм CYP2C19 быстрых, промежуточных и медленных метаболизаторов, что обеспечивает предсказуемый антисекреторный эффект и объясняет низкий потенциал межлекарственных взаимодействий [32–35].
Таким образом, одним из факторов, определяющих результаты эрадикационной терапии инфекции H. pylori с использованием ИПП в составе стандартной тройной схемы, считается статус метаболизма CYP2C19 [36]. Авторы обновленного метаанализа 7 РКИ и 29 наблюдательных исследований 2022 г. установили, что частота эрадикации H. pylori статистически значимо различалась между генотипами CYP2C19 у людей с быстрым и медленным метаболизмом (OШ 0,58, 95% ДИ 0,47–0,71) и быстрым и промежуточным метаболизмом (OШ 0,71, 95% ДИ 0,59–0,86) при использовании в стандартной тройной эрадикационной терапии ИПП первого поколения. Так, частота уничтожения H. pylori у пациентов с генотипом CYP2C19 быстрого метаболизма была значительно ниже, чем у пациентов с промежуточным метаболизмом, получавших омепразол (66,4% против 84,1%), лансопразол (76,1% против 85,6%), но не в случае использования рабепразола, эзомепразола или пантопразола. Исследователи сделали вывод, что носители аллелей варианта CYP2C19 промежуточного и медленного метаболизма демонстрируют значительно большую частоту эрадикации H. pylori, чем носители аллелей варианта CYP2C19 быстрого метаболизма (84,7% против 79,2%), и что стандартная тройная терапия на основе рабепразола может быть использована для эрадикации инфекции H. pylori у любого индивидуума наиболее успешно без необходимости учета статуса его генетического полиморфизма CYP2C19 [37].
Другой метаанализ 35 исследований (n=5998) также показал более высокую эффективность эрадикации инфекции H. pylori при включении в схемы ИПП второго поколения, чем при использовании ИПП первого поколения. Так, частота эрадикации H. pylori схемами антихеликобактерной терапии на основе эзомепразола составила 82,3% против 77,6% при применении ИПП первого поколения (OШ 1,32, 95% ДИ 1,01–1,73, число больных, которых необходимо лечить (number needed to treat, NNT) 21). При включении рабепразола в схемы терапии эффективность эрадикации H. pylori достигла 80,5% против 76,2% при использовании ИПП первого поколения (OШ 1,21, 95% ДИ 1,02–1,42, NNT=23). При сравнении эффективности антихеликобактерной терапии с применением эзомепразола или рабепразола в пяти исследованиях статистически значимых различий не было обнаружено: 78,7% против 76,7% (OШ 0,90, 95% ДИ 0,70–1,17). У быстрых метаболизаторов ИПП второго поколения показали более высокую частоту эрадикации H. pylori (OШ 1,37, 95% ДИ 1,02–1,84). Авторы исследования сделали вывод, что эзомепразол и рабепразол показывают лучшие результаты эрадикации H. pylori, чем ИПП первого поколения. Это клиническое преимущество более выражено у быстрых метаболизаторов по CYP2C19 [38].
Заключение
Инфекция H. pylori является причиной развития хронического гастрита, который может прогрессировать с развитием тяжелой гастродуоденальной патологии, включая рак желудка. Ребамипид повышает успешность эрадикации H. pylori при добавлении его к стандартной тройной терапии. При выборе ИПП с целью проведения антихеликобактерной терапии рабепразол демонстрирует превосходство в сравнении с другими ИПП. Использование рабепразола (Рабиет®) и ребамипида (Гастростат®) в схемах эрадикации является эффективной стратегией в лечении инфекции H. pylori.
СВЕДЕНИЯ ОБ АВТОРАХ:
Дехнич Наталья Николаевна — д.м.н., доцент, профессор кафедры факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения ФГБОУ ВО СГМУ Минздрава России; 214019, Россия, г. Смоленск, ул. Крупской, д. 28; ORCID iD 0000-0002-6144-3919.
Козлова Маргарита Дмитриевна — ассистент кафедры факультетской терапии ФГБОУ ВО СГМУ Мин-здрава России; 214019, Россия, г. Смоленск, ул. Крупской, д. 28.
Коваленко Татьяна Николаевна — клинический ординатор кафедры факультетской терапии ФГБОУ ВО СГМУ Минздрава России; 214019, Россия, г. Смоленск, ул. Крупской, д. 28; ORCID iD 0009-0003-9829-1060.
Контактная информация: Дехнич Наталья Николаевна, e-mail: n.dekhnich@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.03.2024.
Поступила после рецензирования 22.04.2024.
Принята в печать 20.05.2024.
ABOUT THE AUTHORS:
Natalya N. Dekhnich — Dr. Sc. (Med.), Associate Professor, professor of the Department of Faculty Therapy, Vice-Rector for Additional Professional Education and Regional Health Development, Smolensk State Medical University; 28, Krupskaya str., Smolensk, 214019, Russian Federation; ORCID iD 0000-0002-6144-3919.
Margarita D. Kozlova — assistant of the Department of Faculty Therapy, Smolensk State Medical University; 28, Krupskaya str., Smolensk, 214019, Russian Federation.
Tatyana N. Kovalenko — clinical resident of the Department of Faculty Therapy, Smolensk State Medical University; 28, Krupskaya str., Smolensk, 214019, Russian Federation; ORCID iD 0009-0003-9829-1060.
Contact information: Natalya N. Dekhnich, e-mail: n.dekhnich@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 28.03.2024.
Revised 22.04.2024.
Accepted 20.05.2024.
Информация с rmj.ru