Введение
На сегодняшний день изучению патофизиологии и вопросам профилактики спайкообразования в акушерстве и гинекологии уделяется огромное внимание, в особенности с позиции сохранения репродуктивной функции и качества жизни женщины. Формирование спаек имеет клиническое значение у 60–90% пациенток после гинекологических операций [1, 2]. У 43–78% пациенток c воспалительными заболеваниями органов малого таза (ОМТ) в анамнезе выявляется спаечный процесс даже в отсутствие оперативного вмешательства [3]. У 70–90% женщин, подвергшихся оперативному вмешательству на органах брюшной полости, выявляется адгезивный процесс [4, 5]. В исследовании M.P. Diamond et al. [6] упоминается, что после гинекологической лапаротомии спайки de novoвозникают у 51% пациенток, а после гинекологической лапароскопии — у 12%. У женщин, перенесших повторную лапароскопию после гинекологических операций, спайки образуются в 55–100% случаев, причем этот показатель одинаков у мужчин и женщин, перенесших общехирургические операции [7]. В настоящее время установлено, что спайки образуются после всех видов интраабдоминальных вмешательств независимо от хирургического доступа (лапаротомия или лапароскопия) и вероятность повторного образования спаек очень высока [7].
На активность образования спаек влияет множество факторов, однако в большей степени она зависит от баланса между параллельно происходящими процессами репарации и фибринолиза [2, 8, 9]. Триггерами адгезивного процесса считаются: наружный генитальный эндометриоз, инфекционно-воспалительные заболевания, вызванные патогенной и условно-патогенной флорой. Основным этиологическим фактором, инициирующим воспалительный процесс, считается хламидийная, гонококковая и микоплазменная инфекция [9]. Патогенетически это обусловлено ответной реакцией иммунной системы организма на белок теплового шока, находящийся на поверхности хламидийной клетки. Результатом этой реакции является развитие иммунопатологического процесса с выработкой аутоантител и, как следствие, хронического воспалительного процесса — формирования спаек с последующим трубно-перитонеальным бесплодием [10].
Содержание статьи
Патогенез спаечного процесса
Патофизиология образования спаек уже давно является актуальной темой для научных исследований, однако на сегодняшний день определено, что независимо от этиологического фактора спайкообразование — универсальный локальный процесс, возникающий в результате механического или воспалительного повреждения листков брюшины [10, 11].
Обширные исследования привели к более глубокому пониманию процесса формирования адгезии, центральную роль в котором играет гипоксия. Гипоксия стимулирует каскад реакций, который приводит к окислительному стрессу, анаэробному метаболизму, образованию свободных радикалов и в конечном итоге к фенотипу адгезии [7]. Травматизация базальной мембраны, субэндотелиального слоя соединительной ткани, мезотелиальных клеток и внеклеточного матрикса брюшины запускают последовательный процесс воспаления, повышения сосудистой проницаемости, ишемии, экссудации, отложения фибрина, нарушения фибринолиза и неоангиогенеза [12]. Внеклеточный матрикс содержит множество компонентов, необходимых для заживления, включая коллаген, в частности I и III типа, фибронектин, гликопротеины, фибробласты, макрофаги, а также кровеносные и лимфатические сосуды [7]. Среди факторов неоангиогенеза выделяют окись азота (N2O), инсулиноподобный фактор роста 1, эпидермальный фактор роста, фактор роста эндотелия сосудов, фактор роста фибро-бластов, ангиогенин, тромбоцитарный фактор роста и др. [10, 13]. M.P. Diamond et al. [14] выделили фенотип спаек, представленный адгезивными фибробластами, которые обладают промежуточными свойствами между гладкомышечными клетками и фибробластами и имеют выраженную спаечную активность.
Важную роль играют активаторы плазминогена, сериновых протеаз, превращающие плазминоген в плазмин и ограничивающие развитие адгезии мезотелиальных клеток, выстилающих листки брюшины. Данные ферменты секретируются многими типами клеток и участвуют в механизмах регуляции протеолиза, включая ремоделирование тканей, миграцию клеток, фибринолиз, метастазирование опухолей и инвазивность. При потере мезотелиальных клеток и снижении активности активаторов плазминогена активируется процесс спайкообразования [15]. Патофизиологически это описывается как ангиогенный, пролиферативный и иннервационный стресс, влекущий за собой чрезмерную активацию фибробластов, усиливающих коллагеногенез, образование цитокинов и прооксидантную активность клеток [13].
Обнаружено, что частота возникновения спаечного процесса зависит от генетической предрасположенности. Так, у пациенток с генотипом Р-А2 гена GP IIIα в 3,5 раза чаще выявляется спаечный процесс [16]. Несмотря на небольшое количество обнаруженных однонуклеотидных полиморфизмов и мутаций, связанных с формированием спаечной болезни, различные генетические компоненты, сигнализирующие о формировании адгезии, могли бы помочь в выявлении пациентов с риском развития адгезии до операции, чтобы обеспечить им антиадгезионные мероприятия. Другим новым подходом к профилактике после-операционных спаек может стать рекомбинантная терапия, направленная против профибротического транскрипционного фактора и цитокинов, участвующих в процессе формирования спаек [17].
Исследование Л.В. Ткаченко и соавт. [18] посвящено изучению эволюционно обусловленного конституционального фермента N-ацетилтрансферазы, представленного двумя фенотипами: 1) быстрым ацетилированием и 2) медленным ацетилированием. Выявлено, что именно N-ацетилтрансфераза непосредственно влияет на формирование патологической соединительной ткани в брюшной полости. Следовательно, при быстром типе ацетилирования вероятность развития спаечной болезни в поврежденной брюшине значительно выше.
Условно процесс формирования спаечной болезни делится на фазы: реактивную (продолжительностью в несколько часов); экссудативную (до нескольких суток, с повышением проницаемости сосудов, миграцией факторов воспаления в очаг повреждения); адгезивную (непосредственное отложение элементов фибрина, коллагеновых волокон в результате дифференцировки фибробластов); ангиогенную (продолжительностью до нескольких недель, с формированием рыхлых спаек и новых сосудов в очаге воспаления; эта завершающая фаза характеризуется наличием зрелых, плотных спаек). Механизмами реализации спаек принято считать два основных процесса: de novo и adhesion reformation [19].
Описание адгезивного процесса в брюшной полости, как правило, базируется на МКБ 10-го пересмотра и классификации Американского общества фертильности (AFS-R, 1988). AFS-R базируется на оценке распространенности, локализации, характера спаек и включает окклюзию маточных труб 1–4-й степени: минимальную (0–5 баллов), среднюю (6–10 баллов), умеренную (11–20 баллов) и тяжелую (21 и более баллов). Проведенная оценка позволяет прогнозировать возможность наступления неиндуцированной беременности [20].
Способы профилактики адгезивного процесса
Важным этапом лечения спаечной болезни является ее профилактика. «Золотой стандарт» профилактики спайкообразования — это квалифицированная хирургическая техника, уменьшение травмы тканей, особенно брюшины [10, 21]. G. Ahmad et al. [22] приводят данные исследования, где описано, что ушивание брюшины увеличивает риск образования спаек.
По данным Международного общества по борьбе со спаечной болезнью, антиадгезивные барьеры применяются лишь в 10% вмешательств. В основе столь низкой применяемости противоспаечных средств лежит неосведомленность хирургов и пациентов об антиадгезивных средствах и областях их применения. Согласно коммюнике Royal College of Obstetricians and Gynaecologists любое оперативное вмешательство на ОМТ инициирует образование спаек, что диктует необходимость включения противоспаечных барьеров в протоколы оказания медицинской помощи [22, 23].
Препятствие образованию спаек заключается в предотвращении острого воспаления в брюшной полости и полости малого таза, для этого необходимо бережное обращение с тканями, добавление более 5% N2O к CO2 пневмоперитонеума, охлаждение брюшной полости до 30 °C, проведение антидезикационных мероприятий (нагретые, увлажненные газы CO2, N2O или He), короткая продолжительность операции, тщательный гемостаз, промывание и наложение барьера на места повреждения, а также введение дексаметазона [24].
На сегодняшний день изучена эффективность множества методов профилактики, среди которых — адъювантная терапия и противоспаечные барьеры. С учетом патогенеза и патофизиологии формирования спаек определены цели профилактики: минимизация площади травматизации брюшины, супрессия воспалительного процесса и уменьшение интенсивности отложения фибриновых компонентов на поверхности ОМТ, а также создание барьера между поверхностями брюшины [13].
Классификация противоспаечных барьеров
Противоспаечные барьеры бывают газообразные, механические, жидкие, твердые, гелеобразные, сурфактантоподобные.
Группа жидких препаратов включает 3 подгруппы:
-
растворы, создающие эффект гидрофлотации (например, изотонический раствор). Однако на сегодняшний день они не имеют практического значения ввиду недоказанности их эффективности в профилактике спаечного процесса;
-
растворы кортикостероидов, антикоагулянтов, антигистаминных препаратов, кристаллоидов. Их эффект в снижении риска спайкообразования также не доказан;
-
декстраны, применяемые для создания искусственного асцита. Как и две первые подгруппы, эти препараты не нашли подтверждения клинического эффекта.
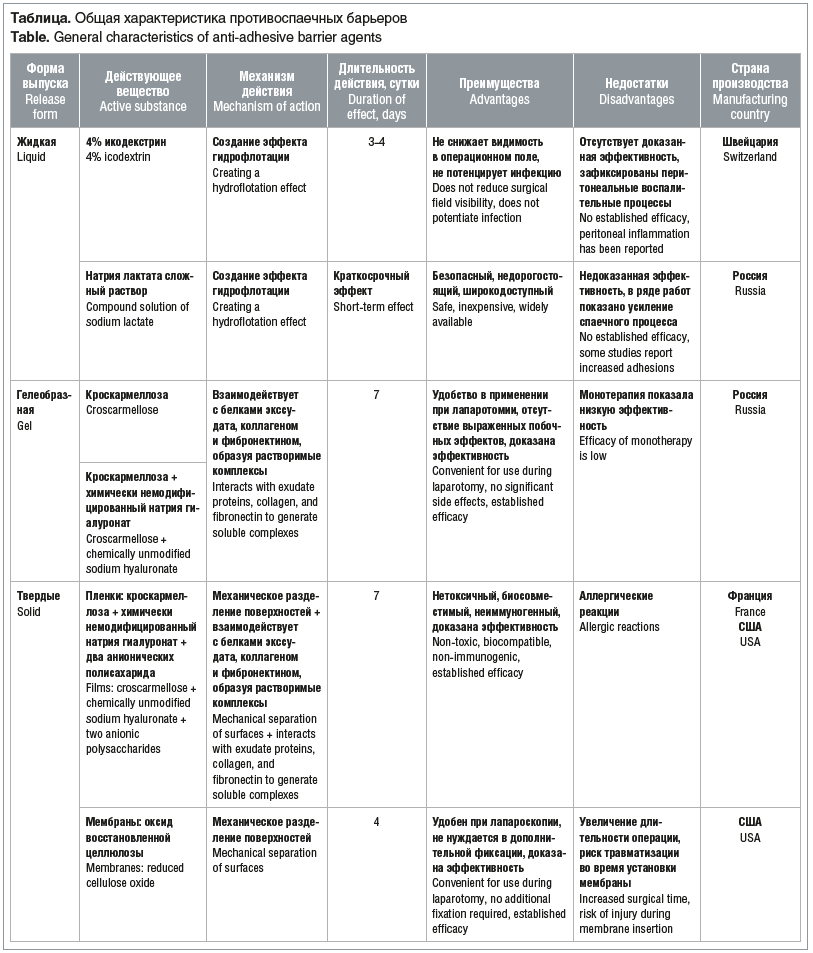
Обобщенная характеристика противоспаечных препаратов представлена в таблице.
В хирургии ОМТ традиционно применяются барьерные средства, разделяющие соседние серозные поверхности [18].
Анализ результатов нестероидной противовоспалительной, антигистаминной, антикоагулянтной и глюкокортикостероидной терапии не показал достоверного профилактического влияния на спайкообразование [8, 10, 22].
Основной мерой профилактики спаек считается предупреждение кровотечения и проведение гемостаза, однако целесообразность применения антикоагулянтов с целью профилактики формирования спаек не нашла достаточного подтверждения в фундаментальных исследованиях [2, 4]. В исследовании A.E. Schindler [25] показана эффективность применения агонистов гонадотропин-рилизинг-гормона в снижении образования спаек, что объясняется механизмом подавления эстрогензависимых модуляторов, факторов воспаления и роста, а также снижением уровня продуктов распада фибрина.
Эффективна и безопасна в применении рассасывающаяся коллагеновая противоспаечная мембрана, механически разделяющая поверхности соприкасающихся в полости органов и тканей. Она вводится через троакар, не требует дополнительной фиксации, а среднее время укладки мембраны — несколько минут, поэтому может применяться как при лапароскопических, так и при лапаротомных доступах [22]. Мембрана, полученная путем ренатурирования лошадиного коллагена I типа, характеризуется низкой способностью вызывать выработку антител и аутоантител, что связано со свойствами самого коллагена, а биотрансформация происходит в течение одного месяца [10].
Вместе с тем у барьерной методики профилактики спайкообразования имеются недостатки: сайт-специфичность, высокая стоимость, побочные эффекты, включая вероятность индукции реакции на чужеродное тело (образование внутрибрюшинного абсцесса) [5].
Наиболее детально исследован противоспаечный эффект гиалуроновой кислоты в различных соединениях, а также 4% раствор икодекстрина [26, 27]. Предполагается, что предварительное покрытие тканей защитным раствором гиалуроната натрия уменьшит образование спаек de novo за счет минимизации высыхания тканей и уменьшения их травматизации. В исследованиях на животных предварительное покрытие тканей раствором для разделения поверхностей после их травматизации (USA) значительно снижало образование спаек de novo в сопоставлении с контрольными животными, не подвергавшимися обработке. Важно отметить, что в исследованиях на животных препарат не показал своей эффективности в снижении спайкообразования в местах хирургических повреждений. Эти наблюдения позволяют предположить, что данный раствор снижает образование спаек de novo не за счет фармакологического действия, а за счет ограничения травматизации тканей в момент их повреждения [28].
Иммуносупрессия предложена как наиболее эффективный, патогенетически обоснованный метод предотвращения образования спаек. Адекватная дозировка препарата, продолжительность комплексной терапии и бережная хирургическая тактика могут снизить риски спайкообразования. Эффективность иммуносупрессивных препаратов была доказана в экспериментах, проведенных с применением 5-фторурацила и циклофосфамида. Оба препарата оказывают выраженное цитотоксическое действие на клетки иммунной системы, что необходимо для коррекции иммунного статуса. Введение препаратов в организм осуществлялось напрямую в перитонеальную полость, а в некоторых случаях дополнялось эндолимфатическим путем введения [27].
Авторы работ [2, 4] выявили, что форменные элементы крови в большей степени, чем плазма крови, способны инспирировать спайкообразование. В случае острого воспаления совокупность факторов, инициирующих адгезивный процесс, играет не менее важную роль, чем отложение фибрина. Также авторы демонстрируют, что смешивание чистого СО2 с 10% N2O, или 4% кислородом, или двумя газами одновременно оказывает антиадгезивный эффект. Антиадгезиогенное действие 10% N2O обусловлено его противовоспалительным свойством и блокадой хемотаксиса.
В работе Ж.Ж. Серикпаева и соавт. [29] показано, что создание кратковременного пневмоперитонеума при установленном внутрибрюшном давлении от 5 до 10 мм рт. ст. не инициирует адгезивный процесс, при этом воздействие в течение 1 мин пневмоперитонеума с внутрибрюшным давлением 15 мм рт. ст. вызывает слипчивый процесс в брюшной полости.
Заключение
Спайкообразование представляет значительную опасность для здоровья пациентов, однако существующие способы профилактики и лечения ограничиваются использованием антиадгезионных барьеров, которые имеют различный клинический успех и предназначены для предотвращения как первичного образования спаек, так и их повторного формирования. Хотя мы до сих пор не до конца понимаем патогенез развития спаек, очевидно, что основную роль в этом играют гипоксия и травматизация тканей. Общепризнано, что наилучшим подходом к снижению развития послеоперационных спаек является строгое соблюдение хирургической техники и атравматическая работа с тканями, включая тщательный гемостаз, использование тонких шовных материалов с низкой реактивностью, предотвращение высыхания тканей, а также избегание введения инородных тел.
СВЕДЕНИЯ ОБ АВТОРАХ:
Гудзь Оксана Валерьевна — ассистент кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-48881-6792.
Сулима Анна Николаевна — д.м.н., профессор кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-2671-698.
Глазков Илья Сергеевич — д.м.н, профессор кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; главный врач ГБУЗ РК «Симферопольский КРД № 2»; 295024, Россия, г. Симферополь, ул. 60-летия Октября, д. 30; ORCID iD 0000-0002-7432-5161.
Румянцева Зоя Сергеевна — к.м.н., доцент, заведующая кафедрой акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-1711-0210.
Миклин Олег Петрович — к.м.н., доцент кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-4863-602X.
Ермачкова Полина Андреевна — студентка кафедры акушерства, гинекологии и перинатологии № 1 Медицинского института им. С.И. Георгиевского ФГАУ ВО «КФУ им. В.И. Вернадского»; 295051, Россия, г. Симферополь, б-р Ленина, д. 5/7; ORCID iD 0000-0002-8782-4007.
Контактная информация: Сулима Анна Николаевна, e-mail: gsulima@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.12.2023.
Поступила после рецензирования 26.01.2024.
Принята в печать 20.02.2024.
ABOUT THE AUTHORS:
Oksana V. Gudz’ — assistant of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-48881-6792.
Anna N. Sulima — Dr. Sc. (Med.), professor of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-2671-6985.
Ilya S. Glazkov — Dr. Sc. (Med.), professor of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; Head Doctor, Simferopol Clinical Maternity Hospital No. 2; 30, 60 let Oktyabrya str., Simferopol, 295024, Russian Federation; ORCID iD 0000-0002-7432-5161.
Zoya S. Rumyantseva — C. Sc. (Med.), Associate Professor, Head of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-1711-0210.
Oleg P. Miklin — C. Sc. (Med.), associate professor of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-4863-602X.
Polina A. Ermachkova — student of the Department of Obstetrics, Gynecology, and Perinatology No. 1 of the S.I. Georgievsky Medical Institute, V.I. Vernadskiy Crimean State University; 5/7, Lenin Blvd., Simferopol, 295051, Russian Federation; ORCID iD 0000-0002-8782-4007.
Contact information: Anna N. Sulima, e-mail: gsulima@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 26.12.2023.
Revised 26.01.2024.
Accepted 20.02.2024.
Информация с rmj.ru