Введение
Витилиго — это депигментирующее заболевание кожи, которое встречается примерно у 2% населения Земли. Заболевание проявляется появлением участков депигментации из-за гибели меланоцитов [1–4]. Патогенез заболевания на сегодняшний день не имеет единого объяснения, но известно, что важную роль в формировании патологии играют аутоиммунные механизмы, окислительный стресс и факторы окружающей среды, которые так или иначе приводят к деструкции меланоцитов [1, 5]. В отношении терапевтических подходов авторы подчеркивают «сиротский статус» витилиго, сопоставляя частоту появления лекарственных схем для его лечения с таковой у других кожных заболеваний [2–4, 6, 7]. Изучение генетических вариантов, лежащих в основе наследственности витилиго, помогает выявить актуальные маркеры для прогнозирования течения заболевания, оценки клинического риска, ответа пациентов на лечение [8, 9].
Цель обзора: определить генетические факторы развития витилиго и оценить перспективу создания генетической панели для внедрения в рутинную диагностику заболевания.
Поиск публикаций осуществляли в базах открытого доступа: PubMed/Medline, Current Contents, Popline, EMBASE, eLibrary. В обзор включено 25 источников. Материалы статей были проанализированы, сопоставлены и обобщены.
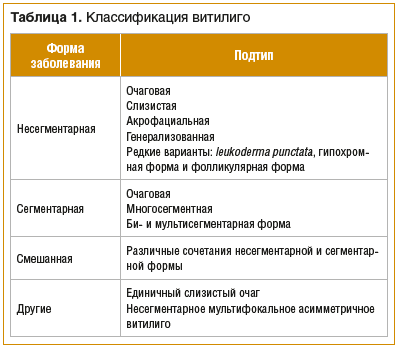
На сегодняшний день общепринятой является классификация витилиго, утвержденная в 2011 г. The Vitiligo Global Issues Consensus Conference [1, 2, 10].
Эпидемиология и семейный анамнез
В зависимости от этнической принадлежности распространенность витилиго колеблется в популяциях от 0,5 до 2%. Сегментарная форма заболевания, по данным разных авторов, встречается с частотой 5–16%. Витилиго чаще развивается в детском и подростковом возрасте. Заболевание не наследуется в рамках классического менделевского распределения и поражает представителей обоих полов с одинаковой частотой [1, 2]. Некоторые исследователи также выделяют «простые» формы витилиго, которые не имеют отягощенного семейного анамнеза и чаще связаны с моногенными и/или частыми аллелями, и «сложные» — которые ассоциированы с аллелями более низкого риска и характеризуются отягощенным семейным анамнезом. При этом для «сложных» форм можно отметить закономерность: чем больше родственников пациента поражено заболеванием, тем выше вероятность его развития у пробанда [11, 12]. Витилиго часто ассоциировано с другими аутоиммунными заболеваниями, такими как аутоиммунный тиреоидит, системная красная волчанка, ревматоидный артрит, псориаз и др. [1, 11].
Гены, ассоциированные с развитием заболевания
Проблема поиска генов, которые так или иначе связаны с развитием заболевания, очень актуальна. Однако очевидно, что витилиго — полигенное заболевание.
Гены, ассоциированные с витилиго, мы предлагаем разделять на три большие группы:
-
ответственные за синтез и накопление меланина;
-
связанные с апоптозом и/или метаболизмом активных форм кислорода (АФК);
-
ассоциированные с иммунной системой.
Гены, ответственные за синтез и накопление меланина
Среди генов, связанных с синтезом меланина, можно выделить TYR, TYRP1 и TYRP2, которые кодируют тирозиназу и тирозин-связанные белки. Данные ферменты последовательно превращают L-тирозин в допахинон, который представляет собой молекулярный маркер основного этапа синтеза меланина [12]. Часто именно тирозиназа выступает в роли аутоантигена при развитии витилиго [1], но возможна и мутация данного гена в меланоцитах [6, 13]. Мутации или недостаточная экспрессия TYRP1 и TYRP2 также могут быть причиной развития витилиго [6, 13, 14]. TYRP2 (син.: DCT) — допахромтаутомераза — более активно экспрессируется в стволовых клетках меланоцитов, чем в меланоцитах [14]. Возможно, уровень экспрессии данного гена может быть прогностическим критерием: чем он выше, тем выше риск обратного развития репигментации [13, 15–17]. Кроме того, TYRP1 имеет общий регулятор FOXJ2 с MC1R, геном, кодирующим рецептор к меланокортину 1 [6].
Рецептор меланокортина — продукт гена MC1R — является регулятором меланогенеза, его экспрессия повышается у больных витилиго в неповрежденных болезнью участках кожи (возможно, по механизму отрицательной обратной связи). Кроме того, белок обладает противовоспалительным и иммунорегулирующим действием. В поврежденных участках он экспрессируется меньше, чем в контрольной группе с равномерной пигментацией кожных покровов [6, 11, 16]. Ген MLANA, он же MART1, кодирует антиген меланомы, распознаваемый Т-клетками 1 (melanoma antigen recognized by T-cells 1). Это один из основных антигенных маркеров меланоцитов, который в норме участвует в формировании меланосом [14, 16, 18]. В коже больных витилиго его экспрессия снижена [6], а в крови обнаруживаются аутореактивные T-киллеры с Т-клеточным рецептором к антигену MART1 [18].
Среди значимых генов, связанных с синтезом меланина, также можно выделить MYG1, который ответственен за пролиферацию меланоцитов и является частью пути меланокортина. Экспрессия гена MYG1 выше в коже больных витилиго, чем в контрольной группе (как в поврежденных, так и неповрежденных участках) [14, 19]. Экспрессия гена POMC, детерминирующего белок PMEL, который продуцируется только в пигментных клетках и связан с формированием амилоида, значимо меньше в поврежденной заболеванием коже [5, 6, 16, 20].
Витилиго ассоциируется со значительным снижением экспрессии SOX10, кодирующим транскрипционный фактор SOX-10, который при нормальной пигментации кожи контролирует пролиферацию меланоцитов [6, 14].
Гены, связанные с апоптозом и/или метаболизмом АФК
По данным C. Bergqvist et al. [1], имеет смысл рассматривать указанные в названии раздела группы генов вместе, так как большинство белков, связанных с апоптозом, весьма чувствительны к АФК. Уровень p53 повышается в меланоцитах под воздействием АФК, кроме того, для меланоцитов больных витилиго характерна аномальная структура митохондрий, а многие белки внутреннего пути активации апоптоза чувствительны к АФК [21]. При витилиго повышается экспрессия p53, MUC1, S100A8, S100A9. Белок MUC1 блокирует BAX-белки, которые обладают проапоптотической функцией. Продукты генов S100A8 и S100A9 принадлежат к группе белков S100, которые подвергаются окислительной модификации АФК [14]. По данным исследований широкомасштабного поиска ассоциаций GWAS было выявлено, что гены SOD2 (супероксиддисмутаза 2), GSTP1 (глутатион-S-трансфераза), RERE (дипептидные повторы аргинин-глутаминовой кислоты), XPB1 (ген хеликаза-XPB1-подобного белка репарации ДНК) связаны с апоптозом меланоцитов [5].
Некоторые исследования сообщают о гене GZMB (гранзим B) [11, 12], который также связан с апоптозом и ассоциирован с витилиго. По данным проекта Vitiligo GWAS 123, с этим заболеванием найдены с разной частотой ассоциации следующих генов: CASP7 (каспаза 7), BCL2L11 (BCL2 like 11), PLCB3 (фосфолипаза C β 3), NEK6 (NIMA related kinase 6), C1QTNF6 (C1q and TNF related 6) [12].
Белок SUOX (сульфит оксидаза) связан с метаболизмом серы и катализирует окисление сульфитов в сульфаты. Белок располагается в межмембранном пространстве митохондрий, и нарушение его функции может быть связано с окислительным стрессом и дисфункцией митохондрий, что впоследствии приводит к гибели меланоцитов.
Роль гена RERE значительна в период эмбрионального развития: он выполняет функцию транскрипционного репрессора. В постэмбриональном периоде он контролирует выживаемость клеток. Повышение уровня его экспрессии рекрутирует BAX-белок, что приводит к апоптозу через активацию каспазы 3 в ядре. У больных витилиго этот ген активно экспрессируется в клетках лимфоидной ткани [20]. Другой ген, связанный с апоптозом, — NALP1 (NLR family pyrin domain containing 1). Белок, кодируемый этим геном, взаимодействует с каспазой 1, каспазой 5 и белком-адаптером ASC (Gene ID: 29108), формируя NALP1-инфламмасому, которая превращает про-IL-1b в IL-1b, запускающий реакции воспалительно-регуляторного каскада. При витилиго значимо повышается экспрессия NALP1 в субпопуляции T-хелперы-17 (Th-17) лимфоцитов и регуляторных T-лимфоцитов (Treg) периферической крови [22].
Гены, ассоциированные с иммунной системой
Доказано, что экспрессия ряда генов в CD8+ Т-лимфоцитах периферической крови и поврежденных участках кожи различается. Уровень экспрессии генов HIF-1α (гипоксией индуцированный фактор 1α) и PIK3CB повышен у CD8+ Т-лимфоцитов и периферической крови, и пораженной кожи. Трипсиноподобный рецептор F2RL1 активнее экспрессировался только лимфоцитами периферической крови. HIF-1α играет важную роль в адаптации лимфоцитов к гипоксии, а также в механизмах врожденного и приобретенного иммунитета. Регулируя экспрессию IL-6, IL-17 и FOXP3, он регулирует активность Treg, Th-17, B-лимфоцитов, усиливает цитотоксичность СD8+ Т-лимфоцитов через перфорин-гранзимовый механизм. Кроме того, его экспрессия значимо повышается при таких аутоиммунных заболеваниях, как ревматоидный артрит и псориаз.
Предположительно, через молекулу PIK3CB CD8+-клетки инициируют гибель меланоцитов. Эта сигнальная молекула отвечает за рост и развитие клетки, но ее точная роль в клетках иммунной системы неизвестна. У нейтрофилов PIK3CB связана с продукцией АФК. В ответ на окислительной стресс активированные кератиноциты могут синтезировать ИЛ-8 через увеличение экспрессии гена белка F2RL1, инициируя воспаление и привлекая T-клетки. F2RL1 — белок, ассоциированный с внутриклеточным сигналингом через G-белок [23].
Кроме того, в CD8+-клетках активно экспрессируются гены, связанные с синтезом интерферона γ (IFNγ), а также NKG2D (killer cell lectin like receptor K1). Уровень PD-1 и CTLA-4 CD8+-клеток положительно коррелирует с активностью витилиго, а в норме эти белки предотвращают развитие аутоиммунного воспаления в коже [5, 11]. Важную роль в развитии витилиго играют в том числе и клетки Th-17 и Treg. Клетки Th-17 поддерживают аутоиммунное воспаление, в то время как Treg подавляют активность CD4+- и CD8+-клеток, что препятствует распространению депигментации [22, 23]. Уровень NALP1 и RORγt, регуляторов синтеза IL-17 и IL-1b, повышается в Th-17 больных витилиго. Транскрипционные факторы Treg, EOS, HELIOS, FOXP3 у пациентов с витилиго снижены. Это свидетельствует о дисбалансе различных популяций лимфоцитов у больных витилиго [22].
Следует отдельно отметить, что и эпигенетический фактор, такой как метилирование ДНК, изменяющее экспрессию гена, может играть роль в развитии витилиго [23]. Примером может служить белок, экспрессия которого изменяется при витилиго, — HBD-1 (бета-1-дефенсин), который кодируется геном DEFB1 [24]. Дефенсины — это семейство микробицидных и цитотоксических пептидов, вырабатываемых нейтрофилами. Бета-1-дефенсин — антимикробный пептид, участвующий в формировании устойчивости эпителиальных поверхностей к микробной колонизации. Экспрессия DEFB1 значительно снижена у больных витилиго, причем чем выраженнее симптомы витилиго, тем ниже уровень экспрессии гена DEFB1 [24].
Некоторые аллели гена PTPN22 тесно коррелируют с развитием генерализованной формы витилиго, однако его роль в развитии данного заболевания не ясна. PTPN22 регулирует IFNγ-опосредованный иммунный ответ, снижает активность Treg на периферии, повышает выживаемость аутореактивных T- и В-лимфоцитов, способствует передаче сигналов киназы JAK-STAT в миелоидных клетках и оказывает множество других эффектов на звенья врожденного и приобретенного иммунитета. Полиморфизмы этого гена обнаруживают ассоциацию не только с витилиго, также выявлена четкая связь между мутациями этого гена и развитием таких заболеваний, как ревматоидный артрит и идиопатический ювенильный артрит [20, 25].
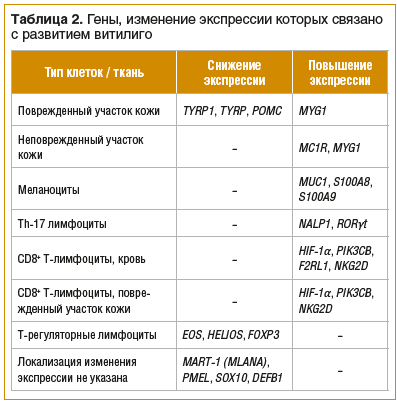
На основании данных публикаций научных групп R.A. Spritz и L.A. Ochoa-Ramırez были систематизированы данные об изменении экспрессии ряда генов при витилиго и других заболеваниях с доказанным аутоиммунным компонентом [11, 12, 24]. В таблице 2, резюмирующей эти и другие упомянутые в настоящей статье исследования, показано: экспрессия генов тирозинкиназ снижается в поврежденных участках кожи, в различных тканях повышается экспрессия проапоптотической группы генов, а также генов, предположительно связанных с запуском гибели меланоцитов.
Заключение
Перспектива исследования вновь выявленных молекулярных маркеров витилиго в различных тканях, с одной стороны, заключается в выявлении способов эпигенетической модификации экспрессии генов, ассоциированных с витилиго, с целью разработки достоверных способов профилактики заболевания. С другой стороны, накопление и обобщение информации об изменении генной экспрессии — один из шагов в разработке персонализованного подхода к фармакотерапевтическому лечению этого заболевания.
Информация с rmj.ru






