Введение
Патология плечевого пояса является одной из распространенных и актуальных проблем, с которыми сталкиваются люди разных возрастных групп. Она может быть вызвана различными факторами, включая травмы, перегрузку мышц и связок, а также дегенеративные изменения в суставах [1].
Плечевой пояс — это сложная анатомическая структура, состоящая из нескольких суставов, связок, мышц и костей. Эти компоненты играют важную роль в поддержании стабильности и функциональности плечевого сустава. Если одна или несколько из этих структур повреждаются или ослабляются, возникает риск различных нарушений двигательных функций и болевых ощущений [2, 3].
Патологические изменения в плечевых суставах можно разделить на заболевания, поражающие костно-хрящевые структуры сустава, и заболевания, которые проявляются изменениями в связках и периартикулярных мягких тканях.
Патология плечевого пояса встречается с частотой 3–5% в общей популяции, повышаясь до 20% у больных сахарным диабетом, и является одним из самых частых заболеваний опорно-двигательного аппарата. В большинстве случаев патология плечевого пояса встречается у лиц в возрасте от 50 до 70 лет, при этом женщины болеют чаще мужчин (соотношение 3:1–5:1) [4, 5].
Заболевания плечевого пояса могут привести к значительным ограничениям в повседневной жизни пациента, сказываться на работоспособности, спортивных достижениях и общем благополучии человека [6].
Одной из основных причин патологии плечевого пояса являются травмы. Часто такие травмы возникают при падении на вытянутую руку или неудачном движении во время спортивных тренировок или физических нагрузок. Кроме травм, патология плечевого пояса может быть связана с такими заболеваниями, как артрит или остеоартрит [7].
Одним из самых распространенных симптомов патологии плечевого пояса является боль. Боль может быть как острая, возникающая после травмы или физической нагрузки, так и хроническая, постоянно присутствующая и усугубляющаяся при движении или нагрузке на сустав. Кроме боли, могут наблюдаться отечность и онемение в области плеча и руки.
Ограничение подвижности также является одним из основных симптомов патологии плечевого пояса. Пациенты могут испытывать сложности при поднятии руки или выполнении поворотных движений. Такие ограничения подвижности могут быть вызваны воспалением, мышечной слабостью или нарушениями в структуре суставов. Кроме того, пациенты с патологией плечевого пояса могут испытывать слабость мышц руки и плеча, что проявляется как затруднение при выполнении повседневных задач, таких как поднятие предметов или удержание чего-либо в руке. Слабость мышц также может привести к неустойчивости и потере контроля над движением руки [8].
Классификация патологии плечевого пояса основывается на различных факторах: причина возникновения (травма, дегенеративное состояние), механизм развития и тип поражения (бурсит, синовит).
Врач проводит беседу с пациентом, выясняет характер его жалоб и анализирует анамнез заболевания. Одним из основных методов диагностики является клинический осмотр, в ходе которого врач проводит пальпацию области плечевого пояса для выявления болезненных точек или изменений в структуре тканей.
Дополнительно используются лабораторные методы исследования, такие как общий анализ крови и мочи, определение С-реактивного белка (СРБ), ревматоидного фактора, мочевой кислоты. Они помогают выявить наличие воспалительных процессов или других нарушений организма, которые могут быть связаны с патологией плечевого пояса.
Однако наиболее информативными методами диагностики являются инструментальные исследования: рентгенография, ультразвуковое исследование (УЗИ), магнитно-резонансная томография (МРТ), артроскопия. Они позволяют получить визуальное представление о состоянии плечевого пояса и выявить возможные изменения [9, 10].
Для дополнительной оценки функционального состояния пациента может быть назначена электромиография (ЭМГ). Это метод, который позволяет измерить электрическую активность мышц верхней конечности и выявить нарушения в их работе. ЭМГ может использоваться для подтверждения диагноза или определения степени поражения мышц [11, 12].
В зависимости от клинических проявлений и результатов предыдущих обследований может потребоваться дополнительное консультирование узких специалистов, например, невролога или ревматолога.
Лечение хронической боли в области плечевого пояса является сложным процессом, требующим сочетания консервативных методов, хирургического вмешательства и последующей реабилитации.
Консервативное лечение играет важную роль на первичных стадиях заболевания или при отсутствии серьезной структурной поврежденности. Немедикаментозная терапия является одним из основных компонентов консервативного лечения. Она может включать упражнения для укрепления мышц-стабилизаторов, различные методы мануального терапевтического воздействия (массаж, мануальная терапия и др.) и применение физиотерапевтических процедур, таких как ультразвуковая терапия, электростимуляция и лазеротерапия [13, 14].
Консервативное лечение обычно начинается с назначения противовоспалительных препаратов, таких как нестероидные противовоспалительные препараты или глюкокортикоиды. Препараты этих групп помогают уменьшить воспаление и боль в области плеча. Однако в случае серьезных повреждений или при отсутствии положительной динамики после достаточного периода консервативного лечения может потребоваться хирургическое вмешательство. Это может быть репарация (восстановление) поврежденных суставных структур, аугментация (усиление) мышц-стабилизаторов или реконструкция капюшона плеча. После операции следует провести реабилитацию для восстановления функциональности плеча и предотвращения возможного рецидива патологии. Реабилитация должна начинаться немедленно после операции и включать активные двигательные упражнения под контролем специалиста [15, 16].
Интерес к изучению патологии плечевого пояса также связан с возможностью разработки новых методов лечения.
Актуальность данной темы объясняется высокой распространенностью заболевания и его негативным влиянием на жизнь человека. Продолжение исследований в этой области поможет улучшить диагностику, выбор методов лечения и реабилитации, а также предотвратить возникновение осложнений у пациентов с данными проблемами.
Цель исследования: оценить эффективность и безопасность внутрисуставного и периартикулярного введения имплантата инъекционного в виде геля на основе полинуклеотидов и имплантатов коллагенсодержащих у пациентов с адгезивным капсулитом / импинджмент-синдромом / шейным спондилоартрозом (наличие унковертебрального артроза, спондилеза) с клиническими рефлекторными, рефлекторно-компрессионными проявлениями, изменениями в ортопедическом статусе.
Содержание статьи
Материал и методы
В проспективное многоцентровое продольное 6-месячное исследование было включено 100 пациентов (мужчин и женщин). Исследование проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (в редакции 2000 г. с разъяснениями, данными на Генеральной ассамблее ВМА, Токио, 2004), правилами Качественной клинической практики Международной конференции по гармонизации (ICH GCP), этическими принципами, изложенными в директиве Европейского союза 2001/20/ЕС и требованиями законодательства РФ. Каждый пациент подписал информированное согласие на участие в исследовании.
Критерии включения: возраст от 18 до 70 лет; длительность наличия симптомов >3 мес.; наличие рентгеновского снимка; отсутствие признаков разрыва вращательной манжеты на всю толщину при УЗИ/МРТ; наличие шейного спондилоартроза (унковертебральный артроз, спондилез шейного отдела позвоночника (ШОП)); для группы с клиническими проявлениями брахиалгии, плечелопаточным периартритом, адгезивным капсулитом (диагноз основан на консенсусном определении): а) первичный или вторичный адгезивный капсулит; б) потеря активного движения плеча >30% во всех направлениях; двусторонняя боль в плече или снижение подвижности, влияющие на повседневную жизнь; предшествующая операция на плече; неэффективность ранее проведенного консервативного лечения; факторы, которые повлияли на развитие заболевания: занятия спортом (волейбол, тренажерный зал), работа, связанная с интенсивными физическими нагрузками и поднятием тяжестей, офисная работа.
Критерии невключения: наличие секвестрированных грыж дисков ШОП и выраженных компрессионных проявлений; травмы ШОП, краниовертебральные генетические аномалии; системные заболевания.
Пациенты были разделены на 4 группы по 25 человек в зависимости от диагноза. Используемая терапия определялась диагнозом и наличием воспалительных явлений в суставе.
Группа 1. Диагноз: шейный спондилоартроз, унковертебральный артроз, спондилез с клиническими рефлекторными, рефлекторно-компрессионными проявлениями, изменениями в ортопедическом статусе без воспалительного процесса. Схема терапии: периартикулярное введение имплантата коллагенсодержащего паравертебрально в ШОП по 1–2 мл в триггерную точку (всего 10 мл) № 3 с интервалом 10 дней. Курс лечения — 30 дней (3-кратное локальное введение).
Группа 2. Диагноз: импинджмент-синдром без воспалительного процесса. Схема терапии: периартикулярное введение имплантата коллагенсодержащего однократно (надостная мышца, подостная мышца, субакромиальное введение, круглая связка плеча, проксимальная порция двуглавой мышцы плеча по 2 мл (всего 10 мл) № 3 с интервалом 10 дней. Курс лечения — 30 дней (3-кратное локальное введение).
Группа 3. Диагноз: импинджмент-синдром при наличии воспалительного процесса. Схема терапии: периартикулярное введение имплантата коллагенсодержащего однократно (надостная мышца, подостная мышца, субакромиальное введение, круглая связка плеча, проксимальная порция двуглавой мышцы плеча по 2 мл) + паравертебрально по 1–2 мл (всего 10 мл) № 3 с интервалом 10 дней. Курс лечения — 30 дней (3-кратное локальное введение). Также пациентам осуществлялось внутрисуставное введение имплантата инъекционного в виде геля на основе полинуклеотидов по 2 мл 3-кратно с интервалом 10 дней между введениями. Введение препаратов проводилось под контролем УЗИ.
Группа 4. Диагноз: адгезивный капсулит с явлениями синовита. Схема терапии: субакромиальное или внутрисуставное введение в плечевой сустав имплантата инъекционного в виде геля на основе полинуклеотидов 2 мл 3-кратно с интервалом 10 дней между введениями при использовании УЗ-навигации.
Выполнены следующие исследования: клиническое обследование с оценкой болевого синдрома, измерение объема движений в плечевом суставе, диагностические тесты на импинджмент-синдром (тест отрыва Gerber, тест надостной мышцы, симптом падающей руки, симптом импинджмента Neer, «болезненная средняя дуга»), оценка по опроснику по боли «Pain detect».
Для оценки функции суставов и выраженности боли использовались [17]:
Шкала Константа (Constant Shoulder Score, CS) является «золотым стандартом» в оценке функции плечевого сустава и состоит из секций как объективной, так и субъективной оценки, разделенных на подпункты, включающие боль (максимум 15 баллов), ежедневную активность (максимум 20 баллов), объем движений (максимум 40 баллов) и силу конечности (максимум 25 баллов). Чем выше показатель, тем лучше функция плечевого сустава (минимум 0 баллов, максимум 100 баллов).
Шкала оценки плечевого сустава Университета Калифорнии, Лос-Анджелес (The University of California — Los Angeles (UCLA) Shoulder Scale) включает в себя баллы по оценке боли (от 1 до 10) и функции (от 1 до 10). Дополнительно переднее активное сгибание оценивается от 0 до 5 баллов, сила активного сгибания — от 0 до 5, удовлетворенность пациента — от 0 до 5. Сила и объем движений оцениваются специалистом, остальные параметры оценивает сам пациент. Наивысший показатель может достигать 35 баллов, результат выше 27 баллов оценивается как хороший/отличный (удовлетворительный), ниже 27 — как плохой (неудовлетворительный). Уровень распространенности болевых ощущений был определен на основании ответов на соответствующие вопросы опросника UCLA у пациентов групп 2, 3, 4.
Простой тест на состояние плеча (Simple Shoulder Test, SST) создан для оценки функционального статуса поврежденного плеча. Он состоит из 12 ответов «да», «нет», полученных на основании имеющихся жалоб. Каждый вопрос сфокусирован на функции плеча и специфике выполняемого вида физической активности.
Опросник по боли «Pain detect», который учитывает все параметры боли и позволяет оценивать болевой синдром в динамике. Сумма 19 баллов и выше свидетельствует о наличии выраженного невропатического компонента.
Оценочный опросник состояния плеча американских хирургов плечевого и локтевого суставов (Shoulder Score Index American Shoulder And Elbow Surgeons (ASES) Shoulder Outcome Score, SSI-ASES) состоит из пунктов самооценки пациентом и оценки врачом. Часть опросника с оценкой пациентом делится на 3 части: оценка боли (1), нестабильности (2) и повседневной активности (3). Для этого дано 10 вопросов с 4-балльной оценкой (от 0 до 3) и максимальным количеством баллов 30. Полученные данные затем конвертируются по 100-балльной шкале по формуле: SSI = (10 — [количество баллов по шкале боли]) × 5 + (5/3 × [общее количество баллов по повседневной активности]. Чем выше балл, тем лучше результат.
Визуальная аналоговая шкала боли (ВАШ), которая представляет собой отрезок прямой длиной 10 см. Его начало соответствует отсутствию болевого ощущения — «боли нет», а конечная точка отражает мучительную нестерпимую боль — «невыносимая боль». Линия может быть как горизонтальной, так и вертикальной. Пациенту предлагается сделать на ней отметку, соответствующую интенсивности испытываемых им в данный момент болей. Расстояние между началом отрезка («боли нет») и сделанной отметкой измеряют в сантиметрах и округляют до целого. Каждый сантиметр на линии соответствует 1 баллу. При отметке до 2 см боль классифицируется как слабая, от 2 до 4 см — умеренная, от 4 до 6 см — сильная, от 6 до 8 см — сильнейшая и до 10 см — невыносимая.
Применялись также объективные методы обследования: обследование при помощи гониометра, рентгенография, УЗИ, МРТ для исключения разрыва вращательной манжеты, связок, суставной капсулы, полости сустава, сухожилий и мышц, ЭМГ верхних конечностей с целью исключения компрессионных радикулопатий.
Оценку функционального состояния плеча и выраженности боли с помощью опросников, лабораторные (клинический и биохимический анализы крови), а также инструментальные исследования проводили до и после лечения. Для оценки эффективности лечения было использовано несколько критериев: снижение интенсивности боли, улучшение функциональной активности плечевого сустава и изменение объема движений в плечевом суставе и ШОП. Безопасность терапии оценивали по наличию побочных эффектов препаратов.
Полученные данные были обработаны с помощью программного обеспечения SPSS. Применялись стандартные методы статистической обработки данных.
Количественные данные представлены центральными тенденциями и рассеянием: среднее значение (М) и стандартное отклонение (s) признаков, имеющих приближенно нормальное распределение, медиана (Me) и интерквартильный размах [Q1; Q3] в случае распределения величин, отличного от нормального. Изучение взаимосвязи двух количественных признаков проводилось с помощью непараметрического метода Спирмена. Выбранный критический уровень значимости равнялся 5% (0,05), что является общепринятым в медико-биологических исследованиях.
Результаты и обсуждение
Средний возраст участников составлял 45 лет (в диапазоне от 30 до 60 лет), количество пациентов женского пола в исследовании составило 79%, мужского пола — 21%. Средняя продолжительность болевого симптома и ограничений движений составляла 3,2±1,8 мес. (от 1,5 до 9,2 мес.).
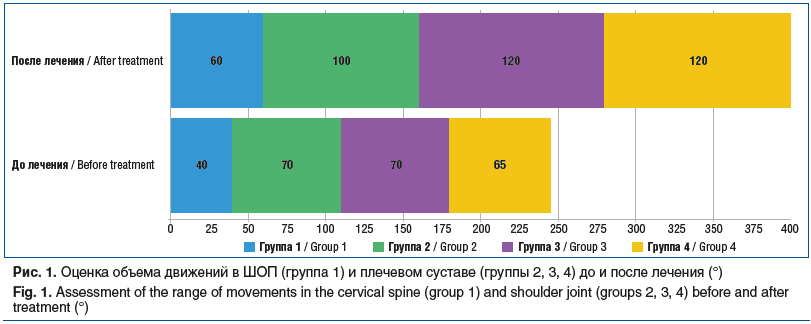
В группе 1 у пациентов выявили существенное улучшение состояния уже в первые дни лечения. После проведения курса лечения препаратами коллагена наблюдали существенное увеличение объема движений в ШОП (ограничение объема движений «наклоны вперед/назад» от 30° до 60°; ограничение объема движений «наклоны в сторону» от 20° до 40°; ограничение объема движений «повороты в сторону» от 30° до 70°). Увеличение объема движений было зафиксировано как в активном, так и в пассивном диапазоне. В активном диапазоне движений количество выведенных градусов поворота головы увеличилось на 25% по сравнению с начальными значениями (p<0,05). В пассивном диапазоне движений общая подвижность шейного сегмента увеличилась на 30% (p<0,01) (рис. 1).
Средняя интенсивность боли по ВАШ снизилась с 8 до 4 баллов по группе (p<0,05), что указывает на анальгетический эффект проводимого лечения (табл. 1).
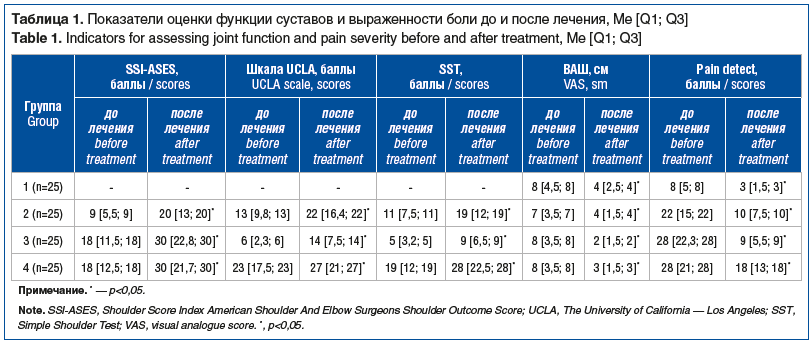
О положительном результате лечения пациентов с шейным спондилоартрозом препаратами коллагена для внутрисуставного и периартикулярного введения свидетельствует изменение значений опросника «Pain detect». Исходные значения составляли в среднем 8 по 10-балльной шкале. После лечения данный показатель снизился до 3, что говорит о значимом уменьшении интенсивности болевых ощущений у больных (см. табл. 1).
У 20 (80%) пациентов наблюдалось снижение степени распространенности боли после лечения. До начала лечения 25 (50%) пациентов отметили средний или высокий уровень распространенности боли (4 и более по 10-балльной шкале), после лечения доля таких пациентов снизилась до 20%.
После окончания курса лечения констатировали существенное улучшение (статистически значимое снижение) показателя скорости оседания эритроцитов (СОЭ) (табл. 2).

В группе 2 средний объем движений в плечевом суставе до лечения составлял 70°, а после терапии — 100° (см. рис. 1), т. е. повысился в среднем на 30°, что свидетельствует об улучшении функциональной активности и восстановлении подвижности сустава.
Боль по ВАШ уменьшилась c 7 до 4 баллов (см. рис. 2), что говорит о значительном положительном эффекте лечения. При этом существенное улучшение наступало уже после 1-й недели терапии, а максимальный эффект достигался через 3–4 нед. Динамика оценок по SSI-ASES, шкале UCLA, SST также указывала на выраженный положительный эффект терапии. Средняя оценка по опроснику «Pain detect» снизилась с 22 до 10 баллов, свидетельствуя о значительном уменьшении боли у большинства пациентов после проведения терапии. Назначенная терапия оказала выраженное противовоспалительное действие, что подтверждается снижением СОЭ и уровня СРБ (см. табл. 2).
В группе 3 после проведения курса терапии пациенты сообщали о снижении интенсивности болевых ощущений по ВАШ на 80%. Средний объем движений в плечевом суставе до лечения составлял 70°, а после лечения — 120° (см. рис. 1), т. е. объем движений увеличился на 50°, что указывает на улучшение функциональной активности и восстановление подвижности сустава. Это свидетельствует о том, что выбранная схема лечения способствует не только устранению воспалительных процессов, но и снижению болевого синдрома, что, возможно, объясняется активацией репаративных процессов и регенерации тканей.
Уменьшение боли и воспаления, увеличение объема движений в плечевом суставе обеспечило существенное улучшение общего состояния пациентов. Это дает основания предположить, что включение геля на основе полинуклеотидов и препаратов коллагена в схему лечения патологии плечевого пояса позволит повысить эффективность терапии и качество жизни таких пациентов.
Согласно данным опросника SSI-ASES после завершения терапии в 20 (80%) случаях наблюдалось значительное улучшение состояния плечевого сустава: средняя оценка выросла с 18 до 30 баллов. По шкале UCLA до лечения большинство пациентов имели низкую степень функциональности плечевого сустава (6 баллов или менее). После лечения количество пациентов с низкой степенью функциональности сократилось c 22 (88%) до 3 (12%), а со средней степенью функциональности увеличилось с 3 (12%) до 16 (64%). Пациентов с высокой степенью функциональности до лечения не было, после лечения ее констатировали в 6 (24%) наблюдениях.
В пользу повышения функциональности сустава и улучшения общего состояния также свидетельствовало увеличение (p<0,05) оценки по SST.
За период лечения СОЭ и уровень СРБ у пациентов из группы 3 существенно снизились (см. табл. 2). Кроме того, исследование выявило связь между результатами SST и изменением СОЭ (r=0,358, р=0,011), а также уровня СРБ (r=0,349, р=0,013).
Также была проанализирована связь между результатами SST и объемом движений в плечевом суставе (r=-0,269, р=0,008). У пациентов, у которых был достигнут высокий балл по SST (более 8), наблюдалось значительное увеличение объема движений, особенно в абдукции и экстензии плеча.
Оценка динамики по CS выявила значительное улучшение функциональности и снижение интенсивности болевых ощущений в плечевом суставе. Измерения до и после лечения показали, что изменение составило в среднем 30%, что свидетельствует о достигнутом эффекте в восстановлении двигательной активности пациентов. После проведения комплексного лечения большинство — 20 (80%) — пациентов отметили снижение интенсивности боли по CS. Кроме этого, результатом проведенного курса лечения стало увеличение диапазона движений на 75%. Это дает основание рассматривать данную схему терапии как один из эффективных способов лечения пациентов с проблемами плечевого сустава.
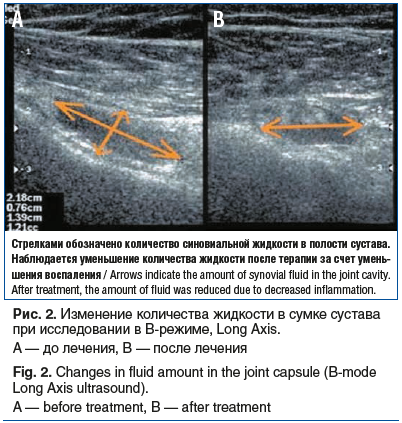
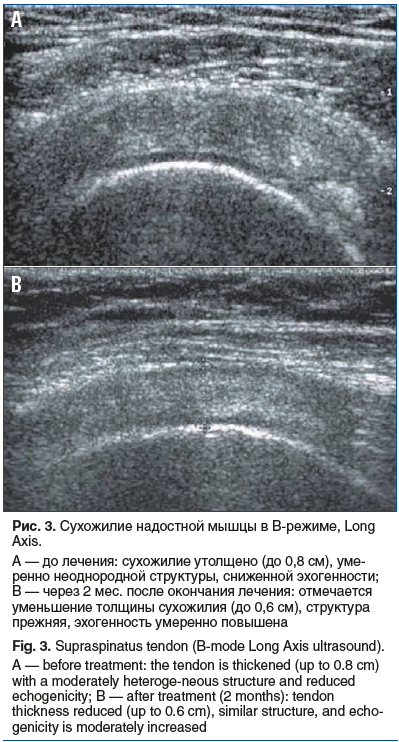
Результаты оценки боли по опроснику «Pain detect» свидетельствовали об улучшении состояния пациентов — выраженность боли снизилась на 70%, что указывает на высокую эффективность терапии препаратами коллагена для внутрисуставного и периартикулярного введения и геля на основе полинуклеотидов и подтверждено результатом УЗИ (см. рис. 2, 3).
В группе 4, в которой лечение проводилось только с применением геля на основе полинуклеотидов, выявлено уменьшение боли по ВАШ с 8 до 3 баллов. Существенное улучшение наступало уже после 1-й недели терапии, а максимальный эффект достигался через 3–4 нед.
Средний объем движений в плечевом суставе до лечения составлял 65°, а после лечения — 120° (см. рис. 1). Измерения показали, что после проведения терапии объем движений увеличился в среднем на 55°, что указывает на улучшение функциональной активности и восстановление подвижности сустава. У пациентов данной группы отметили улучшение по SSI-ASES, шкале UCLA, SST, а также уменьшение интенсивности боли по опроснику «Pain detect» на фоне проводимой терапии. Кроме того, лечение способствовало существенному снижению СОЭ и уровня СРБ (см. табл. 2).
Имплантаты и гель на основе полинуклеотидов хорошо переносились большинством пациентов и не вызывали значимых побочных эффектов.
Полинуклеотиды in vitro способны стимулировать рост хрящевой ткани за счет воздействия на хондроциты с возможностью регенерации атрофированных тканей, восстановления физиологической микросреды здорового хряща. Также они могут индуцировать выработку коллагена, миграцию некоторых типов клеток, в том числе мезенхимальных и стволовых, обладают противовоспалительным эффектом, что помогает уменьшить болевые ощущения. Применение препаратов коллагена способствует регенерации поврежденных тканей и восстановлению функции сустава [18].
В проведенном нами исследовании выбор препаратов и дозы был обусловлен индивидуальными особенностями пациентов. Критериями выбора той или иной схемы из четырех вариантов являлись количественное вовлечение мышц и связок в патологический процесс и их состояние (гипотония мышц, отсутствие или наличие гипотрофии связок, отечность и болезненность периартикулярных тканей, отсутствие или наличие контрактур, степень их выраженности); наличие признаков воспалительного процесса, выявленных в результате осмотра пациента; данные, полученные при оценке ортопедического статуса и УЗИ.
Результаты нашего исследования не противоречат данным литературы: ранее в клинических исследованиях было показано, что инъекции препаратов на основе полинуклеотидов демонстрировали хорошую переносимость и эффективность [18].
Ключевой момент — выбор оптимальной для конкретной клинической ситуации схемы лечения для использования в программе реабилитации. Тропоколлаген способствует регенерации поврежденных тканей и стимулирует синтез коллагена, что помогает восстановлению функции сустава. Полинуклеотиды, в свою очередь, обладают противовоспалительным и регенераторным действием, обеспечивая уменьшение выраженности воспаления и болевых ощущений. Добавление полинуклеотидов в схему лечения при патологиях плеча с выраженным воспалительным компонентом позволило быстро улучшить функциональное состояние плеча, уменьшить болевой синдром и добиться быстрого восстановления, что не только было отмечено при осмотре и по субъективной оценке пациента, но и нашло отражение в динамике лабораторных показателей. Данные схемы должны быть гибкими и модифицируемыми в зависимости от индивидуальных потребностей пациента. Если наблюдается значительное улучшение функциональности или возникают новые ограничения, то необходимо пересмотреть данные схемы и адаптировать их под новую ситуацию. В конечном итоге использование данных схем в программе реабилитации имеет целью достичь оптимального результата лечения у пациентов. Это требует тщательного выбора подходящих схем, которые будут интегрированы в индивидуализированную программу реабилитации, а также постоянного мониторинга прогресса и внесения изменений при необходимости. Такой подход позволит улучшить результаты лечения пациентов и повысить эффективность и безопасность программы реабилитации.
Заключение
Исследование показало, что использование имплантатов коллагенсодержащих и имплантата в виде геля на основе полинуклеотидов при патологии плечевого пояса является эффективным и безопасным. В ходе исследования большинство пациентов отмечали улучшение функциональности плеча, увеличение объема движений в ШОП и плечевых суставах, уменьшение боли и быстрое восстановление. Дальнейшие клинические исследования могут расширить наше понимание механизмов действия препаратов коллагена и полинуклеотидов и потенциал их применения для лечения других заболеваний позвоночника.
СВЕДЕНИЯ ОБ АВТОРАХ:
Щербаков Григорий Ильич — к.м.н., врач-ревматолог ООО «ХК «Элигомед»; 650000, Россия, г. Кемерово, пр-т Советский, д. 74; ORCID iD 0009-0004-1948-4014.
Ковтун Светлана Николаевна — врач-невролог ООО «Медицинская практика»; 650002, Россия, г. Кемерово, пр-т Шахтеров, д. 47.
Поткина Татьяна Николаевна — травматолог-ортопед, ГАУЗ КГКП № 5; 650036, Россия, г. Кемерово, пр-т Ленина, д. 107.
Контактная информация: Щербаков Григорий Ильич, e-mail: ilich.shherbakov@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.10.2023.
Поступила после рецензирования 20.11.2023.
Принята в печать 11.12.2023.
ABOUT THE AUTHORS:
Grigoriy I. Shcherbakov — C. Sc. (Med.), rheumatologist, LLC «Eligomed»; 74, Sovetskiy av., Kemerovo, 650000, Russian Federation; ORCID iD 0009-0004-1948-4014.
Svetlana N. Kovtun — neurologist, LLC «Medical Practice»; 47, Shakhterov av., Kemerovo, 650002, Russian Federation.
Tatyana N. Potkina — orthopedic-traumatologist, Kemerovo City Clinical Polyclinics No. 5; 107, Lenin av., Kemerovo, 650036, Russian Federation.
Contact information: Grigoriy I. Shcherbakov, e-mail: ilich.shherbakov@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 30.10.2023.
Revised 20.11.2023.
Accepted 11.12.2023
Информация с rmj.ru


