Содержание статьи
Клинико-фармакологические ниши применения антиагрегантов
А. М. Шилов, доктор медицинских наук, профессор
А. С. Скотников, кандидат медицинских наук
Е. С. Шульгина
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Обилие сердечно-сосудистых заболеваний, широко распространенных в структуре
соматической патологии, а также неопровержимость их главенствующей роли в
прогрессировании коморбидности вот уже многие годы диктуют практической медицине
свою значимость. В связи с огромным спектром заболеваний у одного человека, мы
видим так называемую вынужденную полипрагмазию, фиксируем нежелательные явления
фармацевтических субстанций, устанавливаем возможные варианты взаимодействий
лекарств с учетом ферментных систем, генотипа и других особенностей каждого
больного, а затем рекомендуем пациенту очередной препарат…
Между тем выбор и назначение лекарственных средств, осуществляемые ежедневно
каждым врачом, — это часть медицинского искусства, одна из наиболее изящных и
утонченных сторон врачевания. Грубостандартизованный, небрежный, поспешный и
«конвейерный» подход к назначению больным медикаментов, подчеркнем, являющихся
сложными химическими соединениями, обладающими не только положительными, но и
отрицательными свойствами (подчас в большей степени), недопустим и ошибочен. В
идеале такая практика должна приравниваться к невежеству, а на деле — она
является своеобразной нормой, которую большинство из участников врачебного
сообщества не замечает. Зато ее очень хорошо чувствуют на себе пациенты.
Проблема неоспорима и не решаема как одной, так и двадцатью статьями, —
потребуется много больше: во-первых, ее понимание и осознание, во-вторых, время
на приобретение опыта, а в-третьих, конкретные инструкции по каждому направлению
медикаментозной терапии, по каждой фармакологической группе, по каждому
лекарственному препарату. В качестве одного из возможных примеров рассмотрим
обширную группу средств, влияющих на первичный сосудисто-тромбоцитарный
гемостаз.
Как хорошо известно, при повреждении того или иного сосуда запускается каскад
реакций, направленных на формирование первичного тромбоцитарного тромба. Цепочка
процессов включает в себя адгезию, активацию и агрегацию тромбоцитов, где
адгезия — это первичная реакция на возникновение дефекта эндотелия (прилипание
тромбоцитов к субэндотелиальным структурам), активация — изменение формы
тромбоцитов и секреция биологически активного содержимого гранул, а агрегация —
изменение формы и слипание тромбоцитов. Многочисленность представителей данной
группы обусловлена большим количеством рецепторов на мембране тромбоцита — их
основной точки приложения, активация которых приводит к тому или иному процессу.
Так, стимуляция рецепторов PAR-1 (protease activated receptors) усиливает
гемостаз, тромбоз и воспаление; активация рецепторов Р2 Y12 приводит к усилению
агрегации тромбоцитов и интенсификации адгезии тромбоцитов к поврежденной стенке
сосуда; возбуждение рецепторов к тромбоксану А2 — к вазоконстрикции,
агрегации тромбоцитов и спазму артерий; а гликопротеиновых рецепторов GPIIb,
GPIIIa и GPV — к взаимодействию с фибриногеном, тромбином, коллагеном и
организации первичного тромбоцитарного тромба (рис.).
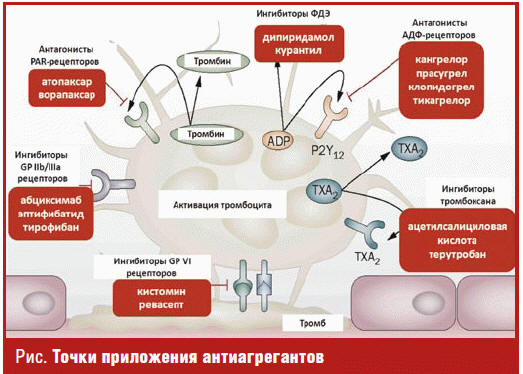
Каждая фармакологическая группа обладает своими уникальными механизмами
действия и включает в себя несколько собственно лекарственных препаратов,
отличных друг от друга по ряду клинико-фармакологических характеристик, но
схожих по основным мишеням и клиническим ситуациям, при которых показано их
назначение.
К наиболее частым кардиологическим показаниям антиагрегантов относятся острый
коронарный синдром (ОКС) и инфаркт миокарда c подъемом сегмента ST; ОКС и
инфаркт миокарда без подъема сегмента ST; нестабильная стенокардия;
постинфарктный кардиосклероз; стабильная стенокардия напряжения; ревматический
митральный порок с мерцательной аритмией и эпизодами системной эмболии на фоне
приема оральных антикоагулянтов (при МНО 2,0–3,0); пролапс митрального клапана;
транзиторные ишемические атаки; сочетание механических протезов клапанов сердца
с мерцательной аритмией, инфарктом миокарда, расширением левого желудочка,
поражением эндокарда, низкой фракцией выброса; биологические протезы клапанов и
синусовый ритм при отсутствии инфаркта миокарда, расширения левого желудочка,
поражения эндокарда, низкой фракции выброса.
Кардиохирургическими показаниями являются ангиопластика с последующим
стентированием или без него, а также аортокоронарное шунтирование.
Антиагреганты широко применяются в неврологии с целью лечения ишемического
инсульта, установленного с помощью компьютерной томографии (КТ) и
продолжительностью более трех часов; профилактики некардиоэмболического
ишемического инсульта или транзиторных ишемических атак; терапии асимптомного и
рецидивирующего стеноза сонных артерий; профилактики ишемических инсультов,
связанных с атеросклерозом аорты и ее ветвей, открытым овальным окном, наличием
тромбов в дуге аорты; профилактики кардиоэмболического ишемического инсульта или
транзиторных ишемических атак при мерцательной аритмии при малом риске их
развития (CHA2DS2-VASc ≤ 1); профилактики церебральных ишемических эпизодов и
проведения каротидной эндартерэктомии.
Кроме того, антиагреганты назначают при ишемической болезни сосудов нижних
конечностей; реконструктивных операциях на них; с целью предотвращения тромбозов
при сахарном диабете (СД) и антифосфолипидном синдроме; а также для первичной
профилактики сердечно-сосудистых заболеваний.
Как следует из общности показаний, хоть антитромбоцитарная эффективность
лекарственных средств, влияющих на первичный гемостаз, и различна для каждого из
представителей разбираемой группы, однако в целом она достаточно высока для
уверенного снижения частоты возникновения тромбозов разных локализаций. И все же
поговорим о каждой группе отдельно.
Ингибиторы аденозиндезаминазы и фосфодиэстеразы
Ингибитор аденозиндезаминазы тромбоцитов дипиридамол и ингибитор
фосфодиэстеразы тромбоцитов пентоксифиллин препятствуют разрушению цАМФ,
приумножают его концентрацию в тканях, уменьшают агрегацию тромбоцитов,
увеличивают скорость выхода тромбоцитов из костного мозга и удлиняют срок их
жизни.
Положительными сторонами этих препаратов также являются участие в активации
фибринолиза и снижении концентрации плазменного фибриногена, что позволяет
считать их лекарственными средствами, косвенно влияющими на вторичный
коагуляционный гемостаз, а также умеренный вазодилатирующий эффект,
способствующий дополнительному снижению артериального давления (АД) у пациентов
с сочетанной сосудистой патологией [1]. Кроме того, с накоплением цАМФ — мощного
биологического антивоспалительного агента связана способность дипиридамола и
пентоксифиллина регулировать величину провоспалительного потенциала нейтрофилов,
Т-лимфоцитов, макрофагов и т. д., уменьшая интенсивность системного воспаления.
Торможение агрегации тромбоцитов и эритроцитов опосредованно способствует
улучшению микроциркуляции, что вкупе с сосудорасширяющим эффектом препаратов
объясняет появление у них свойств антиоксидантов. При этом пентоксифиллин в
большей степени проявляет возможность дилатации коронарных и периферических
артерий, а дипиридамол — церебральных сосудов [2].
Точками приложениями пентоксифиллина должны являться нарушения
микроциркуляции и трофики тканей различных периферических локализаций (сосуды
нижних конечностей, сетчатки и сосудистой оболочки глаза, внутреннего уха и т.
д.).
Следует помнить, что назначение дипиридамола при развившейся ишемической
болезни сердца (ИБС) нежелательно, т. к. препарат способствует феномену «межкоронарного
обкрадывания», расширяя преимущественно непораженные сосуды сердца и ухудшая
кровоснабжение ишемизированного участка миокарда.
Таким образом, клинико-фармакологическими нишами дипиридамола являются
лечение тромбозов мелких сосудов, лечение и профилактика острых нарушений
мозгового кровообращения (ОНМК) по ишемическому и атеротромботическому типу,
предотвращение тромбоэмболических осложнений (в первую очередь,
кардиоэмболических инсультов) при механических искусственных клапанах сердца и
ревматическом митральном пороке, а также в связи с гемодиализом.
С другой стороны, избыток цАМФ (особенно в условиях повышенных концентраций
катехоламинов), создавая очаги ритмической активности, способствует реализации
проаритмогенного эффекта, который обусловлен замедлением входящего кальциевого
тока, торможением нарастания деполяризации и уменьшением скорости проведения
возбуждения по сердцу [3].
Дипиридамол и пентоксифиллин противопоказаны при остром инфаркте миокарда,
нестабильной стенокардии, распространенном стенозирующем атеросклерозе
коронарных артерий, субаортальном стенозе аорты, декомпенсированной хронической
сердечной недостаточности (ХСН) и тяжелой артериальной гипертензии. Выраженный
антитромбоцитарный эффект данных препаратов также ограничивает их применение в
клинических ситуациях, сопровождающихся геморрагическим синдромом или риском
кровотечения из той или иной локализации.
Ингибиторы гликопротеиновых рецепторов IIb/IIIa
Ингибиторы гликопротеиновых рецепторов IIb/IIIa абциксимаб, эптифибатид и
тирофибан неконкурентно блокируют конечный путь агрегации, который заключается в
перекрестном связывании гликопротеиновых рецепторов тромбоцитов под влиянием
фибриногена [4].
Обладая умеренным влиянием на последний этап гемостаза — фибринолиз, они
также предотвращают связывание первичного тромба с этим адгезивным протеином.
Быстрота наступления антитромбоцитарного и фибринолитического эффектов, а также
длительность последних являются основными отличительными особенностями данной
фармакологической группы [5].
Негативной стороной применения ингибиторов гликопротеиновых рецепторов IIb/IIIa
являются высокий риск развития кровотечения и удлинения его времени, а также
риск тромбоцитопении, в связи с которой при их назначении следует контролировать
параметры коагулограммы и число тромбоцитов. Кроме того, безальтернативность
парентеральных форм этих препаратов ограничивает сферу их применения, сужая ее
до стационарного этапа оказания медицинской помощи [6].
Таким образом, эптифибатид, абциксимаб и тирофибан нашли возможность своего
применения при нестабильной стенокардии и ОКС (с подъемом и без подъема сегмента
ST) как до решения вопроса о необходимости реваскуляризационных вмешательств,
так и после проведения чрескожной реваскуляризация миокарда (ЧКВ). Ввиду того,
что хирургическое удаление атеросклеротической бляшки запускает механизмы
агрегации тромбоцитов, основная цель ингибиторов гликопротеиновых рецепторов IIb/IIIa
— профилактика внутрикоронарного тромбоза при высоком риске реокклюзии
оперированного сосуда [7].
Блокаторы рецепторов аденозиндифосфата (АДФ)
Блокаторы рецепторов АДФ или тиенопиридины, среди которых наиболее
востребованы тиклопидин, прасугрел, элиногрел и клопидогрел, необратимо
блокируют АДФ-активированную агрегацию тромбоцитов без воздействия на
циклооксигеназу (ЦОГ). Они обладают мощным и длительным антитромбоцитарным
эффектом, превосходящим по силе большинство известных антиагрегантов. Вместе с
тем скорость наступления этого эффекта на фоне приема терапевтических (75 мг)
доз клопидогрела невелика, а потому лечение больных, как правило, начинают с
однократных нагрузочных доз (300 или 600 мг). Также некоторое неудобство
пациенту и врачу может доставить более высокая стоимость клопидогрела по
сравнению с «соплеменниками», а также контроль над числом лейкоцитов и
тромбоцитов, который следует проводить каждые две недели на протяжении первых
трех месяцев лечения блокаторами рецепторов АДФ.
В то же время обширная доказательная база и высокий профиль безопасности в
отношении нежелательных явлений в области желудочно-кишечного тракта (ЖКТ),
объясняемый стимуляцией образования простациклина и простагландинов Е1 и D2, а
также выраженным ангиогенезом, обеспечивающим регенерацию поврежденных слизистых
оболочек желудка и кишечника, укрепили, прежде всего, клопидогрел на одной из
ведущих позиций врачебного рейтинга популярности антиагрегантов [8].
Необходимо отметить, что желудочно-кишечные расстройства и аллергические
реакции чаще сопровождают прием тиклопидина, нежели клопидогрела, в связи с чем
применение первого не должно быть длительным. Учитывая параметры безопасности и
памятуя о превосходстве тиенопиридинов по выраженности антитромбоцитарного
эффекта, клинико-фармакологическими нишами тиклопидина могут являться терапия
острого инфаркта миокарда (ранние этапы и реабилитационный период), лечение ОНМК,
тяжелый периферический атеросклероз, перемежающаяся хромота, а также состояния
после протезирования клапанов сердца и шунтирования сосудов.
Учитывая вышесказанное, прежде всего преимущества в безопасности клопидогрела
позволили добавить его к ацетилсалициловой кислоте (АСК) с целью проведения
двойной антитромбоцитарной терапии (ДАТ), которая показана всем больным ОКС (с
подъемом и без подъема сегмента ST), независимо от выбора стратегии их ведения (инвазивно
или консервативно) сроком на 12 месяцев [9]. Максимально возможная длительность
двойной антитромбоцитарной терапии пока не определена, а поэтому ее продолжение
может обсуждаться в случаях имплантации стента, выделяющего лекарство, в левой
основной коронарной артерии; сахарного диабета (СД) 2-го типа; при условии
низкого риска кровотечения, определенного по шкале CRUSADE [10]. Применение
тиклопидина в сочетании с АСК является сопоставимо эффективным клопидогрелу в
предупреждении кардиоваскулярных событий, однако вызывает большее случаев
нейтропении и кровотечений, а двукратный прием и позднее начало действия
тиклопидина делают эту комбинацию проигрышной.
Предпочтение клопидогрелу следует отдавать при необходимости неопределенно
долгой терапии больных, перенесших ишемический инсульт, острый инфаркт миокарда
и ОКС с подъемом или без подъема сегмента ST; в случаях профилактики
тромбоэмболических осложнений у пациентов с неклапанной формой фибрилляции
предсердий (ФП) (риск CHA2 DS2-VASc ≤ 1); при окклюзионной болезни
периферических артерий; а также при аспиринорезистентности и непереносимости АСК.
Однако в клинической практике довольно широко распространены случаи, когда
клопидогрел не демонстрирует достаточного антитромбоцитарного эффекта или вовсе
не оказывает влияния на пациента и его прогноз. Резистентность к клопидогрелу
обусловлена большим количеством составляющих (гендерных, социальных,
фармакологических и т. д.), но путей ее преодоления не так много. Среди них —
увеличение нагрузочной и поддерживающих доз клопидогрела, соблюдение которых не
всегда возможно по ряду причин в соматическом статусе коморбидного больного.
Другим способом преодоления невосприимчивости к клопидогрелу является
назначение прасугрела, который ингибирует тромбоциты с низкой вариабельностью
эффекта между пациентами. Противопоказаниями к назначению прасугрела являются
острое патологическое кровотечение; транзиторное нарушение мозгового
кровообращения или инсульт в анамнезе, что обусловлено более высокой частотой
геморрагических событий, особенно у пожилых лиц, перенесших ранее ОНМК [11].
Таким образом, курс терапии прасугрелом должен быть назначен в связи с
планированием выполнения ЧКВ у пациентов молодого и среднего возраста с низким
риском кровотечения, не получавших ранее терапию P2Y12-блокаторами.
Относительно новыми лекарственными средствами, как и тиенопиридины, влияющими
на P2Y12-рецепторы тромбоцитов, являются производные
циклопентил-тиазоло-пиримидина — тикагрелор и кангрелор. Одними из ключевых
особенностей данных препаратов являются быстрое начало действия, короткий период
полувыведения и обратимый характер связывания с соответствующими рецепторами,
что удобно в неотложных ситуациях, а также в случаях вынужденной отмены
препарата незадолго до внепланового аортокоронарного шунтирования (АКШ) и
реваскуляризации [12] (кроме ранней ЧКВ [13]). С другой стороны, короткий период
полувыведения диктует необходимость назначения тикагрелора (имеется только
пероральная форма) в поддерживающей дозе дважды в сутки, что, вероятно,
несколько снижает комплайенс пациентов по сравнению с однократным приемом
препарата.
Следующими дискутабельными моментами, свойственными приему тикагрелора,
являются одышка, желудочковые паузы, брадикардия и повышение уровней креатинина
и мочевой кислоты преходящего характера, генез которых может быть связан с
временным подавлением захвата аденозина и увеличением его концентрации, с
участием тикагрелора в пуриновом обмене, а также обратимостью связи с
рецепторами P2Y12 [13].
Из данных ограничений следует осторожность и избирательность его назначения,
особенно пациентам с хронической обструктивной болезнью легких (ХОБЛ),
бронхиальной астмой (БА), подагрой, атриовентрикулярными блокадами, хронической
почечной недостаточностью (ХПН) и, конечно же, эрозивно-язвенными поражениями
ЖКТ. Нужно заметить, что профиль безопасности тикагрелора в отношении
геморрагических осложнений принципиально не отличается от большинства
антиагрегантов, однако для препарата со столь высоким уровнем ингибирования
функции тромбоцитов вероятность развития кровотечения сравнительно невелика
[14].
Таким образом, клинико-фармакологической нишей для применения тикагрелора
являются ОКС с подъемом и без подъема сегмента ST вне зависимости от применяемой
стратегии ведения (инвазивная или консервативная), а также 12-месячная ДАТ в
комбинации с АСК у пациентов, перенесших ОКС.
«Визитной карточкой» кангрелора являются его высокий профиль безопасности, а
также мгновенное мощное антитромбоцитарное действие и такое же стремительное
прекращение этого эффекта уже через полчаса после внутривенной инфузии
препарата.
Основное отличие элиногрела от всех уже существующих ныне антиагрегантов
заключается в возможности как внутривенного, так и перорального введения при
крайне высокой антитромбоцитарной активности, но при наличии гепатотоксичности
[15].
Таким образом, на сегодняшний день кангрелор и элиногрел сравнительно мало
изучены, но не вызывает сомнения, что местом их применения должны стать
ургентные клинические ситуации, связанные с безотлагательным проведением ЧКВ и
АКШ.
Ингибиторы рецепторов, активируемых протеазами 1 (PAR-1)
Фактов из жизни представителей данной подгруппы известно пока мало. Атопаксар
и ворапаксар предотвращают связывание первичного тромба с тромбином, блокируя
тромбиновые рецепторы, а также демонстрируют дозозависимое ингибирование
агрегации тромбоцитов в исследованиях in vitro. В литературе имеются
данные, свидетельствующие о том, что эти препараты проявляют свой
антитромбоцитарный эффект (инактивация более 90% тромбоцитов!) без увеличения
времени кровотечения даже на фоне проводимой ДАТ (АСК и клопидогрел) [16].
Клинические исследования продолжаются, а сфера потенциального применения
атопаксара и ворапаксара пока очерчена как «профилактика сердечных приступов,
инсульта или экстренной коронарной реваскуляризации».
Ингибиторы тромбоксана А2 (ТХA2)
К препаратам этой группы относятся АСК, а также специфический антагонист
рецепторов ТХA2, предназначенный для орального приема и обладающий
пролонгированным действием, — терутробан. По данным одних авторов, при более
низкой кровоточивости антиагрегантная активность терутробана эквивалентна
влиянию комбинации АСК и клопидогрела при исследовании ex vivo крови
больных, перенесших ишемический инсульт или имеющих стеноз сонных артерий,
превосходя дезагрегантную активность монотерапии АСК [17].
Препарат в эксперименте подавлял АДФ и коллаген-стимулированную агрегацию
тромбоцитов так же эффективно, как и клопидогрел [18]. Однако по другим данным —
его эффективность значительно уступает АСК [19].
Как и терутробан, остальные препараты из его группы (ифетробан, сулотробан,
раматробан), в настоящий момент отсутствуют на фармацевтическом рынке, находясь
на разных стадиях клинических исследований.
Наибольшую доказательную базу среди всех антиагрегантов безусловно имеет АСК
(более 200 исследований, 220 тысяч пациентов), которая является признанным
«золотым стандартом» антитромбоцитарной терапии и наиболее востребованным
препаратом данного сегмента. В силу своей универсальности и эффективности именно
АСК в дозах 75–150 мг в сутки предназначена как для первичной, так и для
вторичной профилактики сердечно-сосудистых заболеваний и их осложнений. Она
показана всем пациентам как группы высокого риска, так и уже страдающим
атеросклеротическими заболеваниями, в то время как остальные антитромбоцитарные
препараты должны назначаться в конкретных клинических ситуациях.
Антитромбоцитарный эффект АСК заключается в необратимом ингибировании
циклооксигеназы-1 (ЦОГ-1) тромбоцитов, катализатора синтеза эйкозаноидов —
метаболитов арахидоновой кислоты. Угнетение активности ЦОГ-1 сопровождается
снижением образования и концентрации ТХA2, ответственного за выделение
серотонина, аденозина дифосфата и других тромбоцитарных факторов, тем самым
предотвращается активация и агрегация тромбоцитов. Блокируются также
дополнительные эффекты ТХA2: увеличение размеров атеросклеротических бляшек под
влиянием тромбоцитарного фактора роста и процесса тромбообразования,
прогрессирование ишемии как следствие процесса агрегации тромбоцитов. В связи со
стойкой инактивацией ЦОГ-1 функция тромбоцитов необратимо блокируется на весь
срок их жизни.
Ежедневно пул тромбоцитов обновляется на 10%, а однократный прием малых доз
АСК (не более 300 мг) позволяет полностью блокировать активность тромбоцитов,
снижая риск развития побочных внетромбоцитарных эффектов. После прекращения
приема АСК функциональная активность тромбоцитов восстанавливается через 7–10
дней.
В то же время более высокие дозы АСК оказывают значительно менее выраженный
антитромбоцитарный эффект, т. к. в существенной степени блокируют образование
ЦОГ-1 клетками эндотелия, что сопровождается уменьшением продукции
простагландина I и повышением активации тромбоцитов.
Клинико-фармакологическая ниша АСК очень широка и включает в себя вторичную
профилактику большинства сердечно-сосудистых заболеваний и их тромботических
осложнений, а также первичную профилактику кардиоваскулярных и
цереброваскулярных событий у пациентов, имеющих такие факторы риска, как
курение, ожирение, гиперлипидемия, АГ и СД.
Что касается безопасности АСК, то существует ряд ограничений к ее назначению
и это, в первую очередь, развитие эрозивно-язвенных поражений желудка. В основе
их развития лежит снижение образования простагландинов в слизистой оболочке
желудка вследствие ингибирования ЦОГ-1 АСК. Простагландины обеспечивают
резистентность слизистой к различным повреждающим агентам, к таким как соляная
кислота, пепсин и желчные кислоты. Они стимулируют секрецию гидрокарбонатов и
слизи, активизируют пролиферацию клеток, регулируют местный кровоток.
Этот нежелательный эффект АСК неотъемлем от ее механизма действия и
свойственен всем без исключения ее формам, в том числе парентеральным,
ректальным, быстрорастворимым, кишечнорастворимым и буферным. Исходя из
патогенеза эрозивно-язвенных дефектов, ассоциированных с приемом АСК, данное
лекарственное средство гипотетически способно приводить к их образованию даже в
дозах ниже 75 мг в сутки.
Дополнительными повреждающими факторами являются повышение проницаемости
слизистой желудка для ионов водорода и натрия на фоне приема АСК, способность
последней стимулировать апоптоз клеток эпителия, а также местное раздражение
слизистой оболочки ЖКТ при пероральном приеме АСК. Кроме того, на фоне снижения
синтеза простагландинов наблюдается очевидное снижение регенеративных
способностей слизистой оболочки желудка и замедление эпителизации и рубцевания
уже имеющихся язвенных дефектов.
Основа контингента пациентов, принимающих АСК, — это пожилые люди, как
правило, перенесшие сосудистую катастрофу или находящиеся под ее
непосредственной угрозой. Описывая «портрет» таких больных, невозможно отрицать
наличие у них длительной артериальной гипертензии, дислипидемии, нарушения
метаболизма углеводов, а также мультифокального атеросклероза. Хроническая
ишемия гастродуоденальной области, как одна из его локализаций, у больных с
сочетанной патологией, через механизм подавления факторов защиты, вырабатываемых
в желудке, способствует гиперацидности желудочного содержимого — независимого и,
бесспорно, дополнительного фактора в развитии эрозий и язв слизистой оболочки
ЖКТ.
Таким образом, можно заключить, что в условиях коморбидности на
предрасположенную к язвообразованию слизистую регулярно воздействуют препараты,
оказывающие дополнительный системный и местный гастротоксичный эффект. С учетом
того, что большинство больных с высоким риском развития сердечно-сосудистых
событий обречено получать антитромбоцитарную терапию пожизненно, вопрос
комплексной безопасности сотен тысяч пациентов выходит на первый план.
Защищенные формы АСК
Среди препаратов АСК, обладающих способностью несколько уменьшать свое
местное воздействие на ЖКТ, присутствуют кишечнорастворимые (КР) и ощелачивающие
буферные (забуференные) формы. Механизмы их защитного действия предельно просты.
Так, многослойная лаковая или пленочная кишечнорастворимая (энтеросолюбильная)
оболочка первой формы позволяет высвобождать АСК не в желудке, а в щелочной
среде кишечника, а гидроксид магния, не способный к всасыванию в ЖКТ, в составе
второй формы (Кардиомагнил), в свою очередь, нейтрализует раздражающее действие
назначенной дозы АСК.
Величины их защитного эффекта на слизистую ЖКТ практически эквивалентны, а
прием данных препаратов по сравнению с АСК в чистом виде характеризуется
некоторым снижением количества субъективных жалоб на изжогу, боль в области
желудка и чувство его переполнения. В то же время, несмотря на положительную
клиническую динамику, применение кишечнорастворимых или буферных форм АСК, по
данным ряда научных работ, не уменьшает риск возникновения у этих пациентов
кровотечений из ЖКТ [20–22].
Кроме того, не следует забывать о возможности повреждений тонкого и толстого
кишечника под действием АСК, которые также могут осложняться перфорациями,
кровотечениями и стриктурами [23, 24]. Таким образом, совершенно очевидно, что
пациентам из группы высокого риска возникновения осложнений со стороны ЖКТ (а
таких большинство), несмотря на высокий профиль безопасности отдельных
антиагрегантов в целом и защищенность конкретных форм АСК в частности, с
профилактической целью всегда следует назначать гастропротекторные препараты.
Испытанным способом заживления эрозивно-язвенных поражений ЖКТ после
бесконтрольного и безразборчивого приема антитромбоцитарных лекарственных
средств, а также гораздо более действенным методом профилактики геморрагических
событий желудочно-кишечной локализации на фоне проведения антиагрегантной
терапии является применение препаратов из группы ингибиторов протонной помпы (ИПП)
[25].
Посредством угнетения активности протонного насоса в стимулированных
париетальных клетках желудка, ИПП уменьшают выделение соляной кислоты,
профилактируют первичное формирование эрозий и язв слизистой ЖКТ, предотвращают
их рецидивы у больных, продолжающих принимать антиагреганты. Следует принимать
во внимание, что ИПП последних поколений не вступают в межлекарственные
взаимодействия (в т. ч. с антиагрегантами) на уровне биотрансформации в системе
цитохромов P450. Ввиду пожизненного приема антиагрегантов большинство сосудистых
больных нуждается в ИПП и максимально пролонгированной гастропротекции.
В связи с этим курс ИПП может быть очень продолжительным (месяцы и годы),
однако конкретные рекомендации на данный счет в настоящее время отсутствуют. В
то же время единичные клинические исследования и здравый смысл подсказывают, что
длительность курсов профилактического приема ИПП должна составлять от 26 до 52
недель [26], а в случае проведения ДАТ, вероятно, и больше. Вопреки расхожим
мнениям, долгосрочное применение ИПП не сопряжено с увеличением риска побочных
эффектов.
Ранее с целью гастропротекции предпринимались попытки назначения аналогов
простагландина и блокаторов Н2-рецепторов. Однако было доказано, что длительная
терапия мизопростолом хоть и предотвращает развитие язв желудка и
двенадцатиперстной кишки, индуцированных антиагрегантами, уменьшая при этом риск
возникновения опасных для жизни кровотечений, но плохо переносится, часто
вызывая диарею и кишечные колики [27–29]. Ранитидин и фамотидин в стандартных
дозах оказывают умеренное протекторное влияние на развитие язв
двенадцатиперстной кишки при лечении производными АСК, но при этом не снижают
частоту образования язв желудка, что остается серьезной проблемой [30, 31].
Итак, клинико-фармакологические ниши защищенных форм АСК аналогичны таковым у
самой АСК, однако данные препараты с целью первичной и вторичной профилактики
сосудистых событий показаны исключительно в период стабильного компенсированного
течения кардио- и цереброваскулярных заболеваний и не подходят для
антитромбоцитарной терапии как в лечении ОКС (в т. ч. ДАТ), так и в ходе
оказания медицинской помощи при других ургентных ситуациях.
Общность показаний АСК и ее защищенных форм объясняется практически полной
эквивалентностью их фармакокинетических показателей. После приема внутрь
препараты АСК достаточно полно всасываются в верхнем отделе тонкого кишечника.
Абсорбированная часть очень быстро гидролизуется специальными эстеразами,
поэтому период полувыведения (Т1/2) всех форм АСК составляет не более
15–20 мин. В организме АСК, как истинный «кислый» лекарственный препарат,
циркулирует в связи с альбумином, при этом связывание с белками плазмы равняется
66–98% в зависимости от дозы АСК. Распределяется АСК в тканях в виде аниона
салициловой кислоты (СК).
Время полужизни СК в плазме крови повышается при увеличении дозы, так как
происходящие метаболические процессы частично имеют кинетику насыщения для всех
реакций с образованием салицилмочевой кислоты, а также салицилфенольных
глюкуронидов. При употреблении АСК в терапевтических дозах от 600 до 1200 мг
время полужизни СК в плазме крови составляет 3–4 часа.
Объем распределения (Vd) составляет 0,2 л/кг при применении низких
(кардиологических) доз, 0,3 л/кг — при применении средних терапевтических доз и
0,5 л/кг — при применении токсических доз. Объем распределения АСК не связан с
полом и также повышен у пожилых больных. Максимальная концентрация (Cмакс)
АСК достигается примерно через 2 часа. При биотрансформации в печени образуются
метаболиты, обнаруживаемые во многих тканях и моче. Экскреция салицилатов
осуществляется преимущественно путем активной секреции в канальцах почек.
Биодоступность (F) АСК составляет порядка 70%, что обусловлено пресистемной
элиминацией.
Сравнение фармакокинетических показателей приема 300 мг АСК и СК в составе
различных препаратов представлено в табл. 1 и 2 соответственно.

Как следует из данных, представленных в табл. 1, при практически полной
сопоставимости показаний и фармакодинамических характеристик, основные формы АСК,
назначенные в одинаковых дозах, имеют фармакокинетические отличия.
Так, Cмакс АСК кишечнорастворимых (КР) форм на 42,4% ниже данного
показателя у классической АСК и на 58,7% ниже, чем у ее буферной формы. Эти
различия очень интересны, т. к. низкодозовые препараты АСК, как упоминалось
ранее, необратимо блокирующие тромбоциты на весь период их жизни и быстро
выводящиеся из организма, можно считать препаратами короткого действия. Из этого
следует, что чем выше у них Смакс, тем более выражены как
терапевтические, так и токсические эффекты (данная закономерность особенно
актуальна для препаратов с коротким периодом полужизни).
На первый взгляд, препараты АСК с низкой Cмакс должны обладать
более высоким профилем безопасности, однако следует помнить, что выраженность
побочных эффектов АСК, в первую очередь, зависит не от Cмакс, а от
величины ее связывания с альбуминами, а вернее, — от количества свободных
(несвязанных) АСК и ее метаболитов. Поэтому в обычных условиях, вне дефицита
общего белка и его фракций, когда связывание АСК с альбуминами достигает 98%,
выбор антитромбоцитарного препарата не должен быть основан на разнице в Cмакс.
Кроме того, объем распределения (Vd) АСК в дозах 75 мг и 150 мг в составе
буферных форм (0,2 л/кг) сопоставим с Vd альбуминов, равному (0,14 л/кг), а
потому риск реализации токсических эффектов на фоне высокой Cмакс
крайне мал. В то же время справедливости ради следует отметить, что при
патологических состояниях, обусловленных либо низким уровнем альбуминов
(хроническая почечная и печеночная недостаточность различной этиологии, ожоги,
опухоли), либо влиянием на способность белков плазмы к связыванию (хирургические
вмешательства, применение ингаляционных анестетиков), концентрация свободной
фракции АСК возрастает, а выраженность ее фармакологических эффектов (в т. ч.
нежелательных) увеличивается.
Таким образом, в перечисленных ситуациях, с позиции безопасности, несколько
поступясь антитромбоцитарным эффектом, более правильно отдать предпочтение
АСК-содержащим антиагрегантам, обладающим меньшей Cмакс. Однако,
выбирая АСК для пациентов с хронической болезнью почек (ХБП), отталкиваясь от Cмакс,
не стоит забывать, что и здесь есть «подводные камни»: даже преходящее
незначительное увеличение свободной фракции АСК и СК приведет к компенсаторному
повышению их внутреннего почечного клиренса, что в условиях сниженной скорости
клубочковой фильтрации (СКФ) на фоне коморбидности нежелательно. Данные
аргументы подчеркивают необходимость контроля и поддержания постоянства
концентраций альбуминов, а также подтверждают значимость белковых фракций в
гомеостазе с позиций клинической фармакологии.
Разные формы АСК различаются также по времени достижения максимальной
концентрации (Tмакс), принципиальное значение которой заключается в
определении врачом времени назначения лекарственного препарата, пик действия
которого в идеале должен прийти на прогнозируемое время максимально выраженного
патологического процесса. Зачастую Tмакс совпадает со временем
максимального терапевтического эффекта, однако для ряда препаратов, в т. ч. для
антиагрегантов группы АСК, это правило не действует: их Tмакс в
среднем составляет 2–2,5 часа, а значимые клинические эффекты развиваются через
несколько суток.
Важно отметить, что Tмакс АСК КР, как правило, несколько больше,
поскольку, вследствие покрытия таблеток кислотоустойчивой оболочкой, АСК
высвобождается не в желудке, а в щелочной среде двенадцатиперстной кишки. Таким
образом, абсорбция АСК КР замедлена на 3–6 часов по сравнению с таблетками без
данной оболочки.
Согласно данным, представленным в табл. 1, Tмакс буферных форм АСК
на 37,9% меньше данного показателя стандартной АСК и на 89,5% меньше, чем Tмакс
АСК КР. В условиях длительного регулярного приема АСК данные различия не
представляют большой значимости, однако, если смоделировать ситуацию, при
которой пациенту, по той или иной причине ранее прекратившему прием
антиагрегантов, в короткие сроки потребуется полноценная антитромбоцитарная
терапия, то препаратом логичного выбора должна стать буферная форма АСК.
Подобная динамика отмечается также в фармакокинетике СК — первичного
метаболита АСК, образующегося под воздействием гидролаз путем отщепления
ацетильной группы. Превращение АСК в СК не зависит от принятой дозы АСК, а
активность эстераз, участвующих в этом процессе, не связана с возрастом и полом
пациента и не может быть увеличена повторными дозами АСК.
При схожести тенденций, касающихся наиболее высоких Cмакс СК у
буферных форм и Tмакс СК у кишечнорастворимых форм (табл. 2),
фармакокинетика СК отличается от фармакокинетики АСК по такому показателю, как
площадь под фармакокинетической кривой (AUС0–12). Фармакокинетика как
основного вещества, так и его активного метаболита в составе сравниваемых
защищенных форм АСК должна быть максимально биоэквивалентна таковой у
стандартной формы препарата. На деле же их кривые «концентрация/время»
расходятся, что объясняет разницу в AUС0–12 данных лекарственных
средств. AUС0–12 отражает количество вещества, поступившее в кровь
после однократного введения препарата.
Как видно из табл. 1 и 2, в процентном эквиваленте, при равнозначных режимах
дозирования, AUС0–12 АСК буферной формы на 34,1% больше, чем AUС0–12
АСК в кишечнорастворимой форме, и на 6,2% больше, чем AUС0–12 АСК в
стандартной форме.
В свою очередь, AUС0–12 СК кишечнорастворимой формы на 14,6%
больше, чем AUС0–12 СК из буферной формы, и на 27,3% больше, чем AUС0–12
СК из стандартной формы АСК. Таким образом, за одинаковый временной период и при
равнозначности доз буферная форма обеспечивает поступление в кровь наибольшего
количества АСК, а кишечнорастворимая форма — ее активного первичного метаболита
(СК).
Говоря об элиминации препаратов, следует сравнить их периоды полувыведения (T1/2)
— время, необходимое для снижения концентрации лекарственных средств в плазме
крови на 50%. Кроме того, что T1/2 позволяет определить кратность
назначения препаратов и время их полного выведения из организма, с помощью него
можно также рассчитать время установления равновесной концентрации (Css),
т. е. максимально стабильного клинического эффекта. При завершении терапии
препарат обычно полностью покидает организм через 4–5 своих T1/2, а в
случае продолжения терапии примерно через это же время наступает его Css.
Период полувыведения АСК в среднем составляет 15–20 минут, а его активного
метаболита СК — значимо дольше, 3–4 часа. Это означает, что, в целом, полная
элиминация и установление Css наступают для АСК через 60–100 минут, а
для СК — через 12–20 часов.
T1/2 АСК буферной формы на 87,5% меньше, чем T1/2 АСК
кишечнорастворимой формы, и на 9,4% меньше, чем T1/2 АСК стандартной
формы. Полная элиминация и установление Css наступают для АСК
буферной формы через 1,16–1,45 часа, для АСК кишечнорастворимой формы — через
9,28–11,6 часа, а для АСК стандартной формы — через 1,28–1,6 часа. Подобная
динамика прослеживается и в отношении СК.
Так, T1/2 СК буферной формы на 58,4% меньше, чем T1/2
АСК кишечнорастворимой формы, и на 18,4% меньше, чем T1/2 АСК
стандартной формы. Соответственно, полная элиминация и установление Css
наступают для АСК буферной формы через 9,96–12,45 часа, для АСК
кишечнорастворимой формы — через 23,96–29,95 часа, а для АСК стандартной формы —
через 12,2–15,25 часа.
Видимое невооруженным взглядом, большее время нахождения в организме АСК и СК
кишечнорастворимой формы можно интерпретировать как преимущество у
низкокомплайентных пациентов, склонных пропускать очередной прием антиагреганта,
который, согласно исследованиям хроночувствительности АСК, целесообразнее всего
выполнять в вечерние часы. Однако, с другой стороны, более короткий срок
пребывания в организме АСК и СК буферной формы делает очевидным меньшую
реализацию их возможных системных нежелательных явлений.
Подводя промежуточные итоги, можно заключить, что кишечнорастворимые формы
длительно и размеренно работают на низких концентрациях АСК и СК, а буферные
формы — относительно коротко и быстро на высоких. Тем не менее, после
проведенного сопоставления, кривую «концентрация/время» обычной АСК (как по АСК,
так и по СК) в большей степени повторяет кривая именно буферной формы (Кардиомагнил),
а в меньшей — кишечнорастворимой.
После проведенного сравнения может показаться, что буферные формы несколько
уступают кишечнорастворимым по профилю безопасности, однако это не так. Как было
упомянуто ранее, побочные эффекты АСК и СК не связаны с процессом их абсорбции и
обусловлены, прежде всего, низкодозовым селективным ингибированием ЦОГ-1, а
затем и ряда простагландинов, несущих регуляторную функцию. Поэтому долгое
нахождение АСК и СК, которые способны очень быстро, еще при первом прохождении
через печень — на уровне воротной вены, инактивировать тромбоциты на весь их
жизненный цикл, в ослабленном многими факторами риска организме коморбидного
больного зачастую нежелательно. Кроме того, разработка буферных форм, содержащих
в себе гидроокись магния (Mg(OH)2), позволила закрыть вопрос
устранения местного раздражающего, а в последующем ульцерогенного, эффекта АСК
на слизистую оболочку ЖКТ.
Невсасывающийся гидроксид магния является мягким основанием, которое в виде
водного раствора («магнезиальное молоко») широко используется в
гастроэнтерологии для снижения кислотности желудочного сока. При этом, несмотря
на свою мягкость, Mg(OH)2 нейтрализует кислоты в 1,37 раза больше,
чем гидроксид натрия (NaOH), и в 2,85 раза больше, чем гидрокарбонат натрия
(NaHCO3). Гидроксид магния является наиболее быстродействующим антацидным
агентом, действуя быстрее гидроксида алюминия (Al(OH)3) и не влияя на
всасываемость АСК в желудке [32].
Трудно утверждать о способности 15,2 мг и даже 30,39 мг Mg(OH)2,
дополняющих 75 мг и 150 мг АСК соответственно, значимо адсорбировать соляную
кислоту, полноценно снижать протеолитическую активность желудочного сока, весомо
повышать pH среды, комплексно инактивировать пепсин, адекватно обволакивать
слизистую ЖКТ. Все перечисленное — клинико-фармакологическая ниша больших доз Mg(OH)2
в лечении кислотозависимых заболеваний ЖКТ. Миссия этого небольшого количества
гидроксида магния в составе буферной формы предельно проста и заключается в
устранении потенциально возможного местного негативного эффекта соответствующей
дозы АСК.
Однако, помимо нейтрализующего эффекта, гидроксид магния даже в небольших
концентрациях оказывает антиспастическое действие: улучшает запирательную
функцию кардиального отверстия пищевода, стимулирует перистальтику желудка,
воздействует на кишечные пептиды, повышая экскрецию желчи, а также усиливает
перистальтику кишечника, способствуя устранению запоров функционального генеза
[33]. Также Mg(OH)2 обладает гастропротективным эффектом, который,
прежде всего, обусловлен повышением образования простагландинов в стенке
желудка, усилением секреции бикарбонатов, увеличением гликопротеинов желудочной
слизи, местной вазодилатацией, локальным усилением микроциркуляции и улучшением
регенерации эпителия [34].
Таким образом, возвращаясь к особенностям фармакокинетики буферных форм АСК,
находим им объяснение в компонентах лекарственного препарата, способствующих
более быстрому выведению салицилатов из организма. При этом, памятуя слова
учителей, вспоминаем постулаты В. Х Василенко: «… для уменьшения ульцерогенного
действия и желудочных кровотечений следует принимать ацетилсалициловую кислоту
только после еды, таблетки рекомендуется тщательно измельчать и запивать большим
количеством жидкости (лучше молоком или минеральными щелочными водами)» и М. Д.
Машковского: «… за рубежом таблетки ацетилсалициловой кислоты выпускаются часто
из мелкокристаллического порошка с ощелачивающими (буферными) добавками…», а
затем проводим параллели.
Литература
-
Verro P., Gorelick P. B., Nguyen D. Aspirin Plus Dipyridamole
Versus Aspirin for Prevention of Vascular Events After Stroke or TIA. A
MetaAnalysis // Stroke. 2008; 39: 1358. -
Halkes P. H., van Gijn J., Kappelle L. J., Koudstaal P. J., Algra A.
ESPRIT Study Group. Aspirin plus dipyridamole versus aspirin alone after
cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial //
Lancet. 2006; 367 (9523): 1665–1673. -
Ройтберг Г. Е., Струтынский А. В. Внутренние болезни.
Сердечно-cосудистая система. М.: Бином-пресс, 2007. -
Грацианский Н. А. Место эптифибатида в лечении больных коронарной
болезнью сердца // Клиническая фармакология и терапия, 2006. № 3. С. 24–31. - The EPILOG investigators. Platelet glycoprotein IIb/IIIa receptor blockade
and low–dose heparin during percutaneous coronary revascularization // N Engl
J Med. 1997; 336: 1689–1696. - The PURSUIT Trial Investigators. Inhibition of platelet glycoprotein IIb/IIIa
with eptifibatide in patients with acute coronary syndromes // N Engl J Med.
1998; 339: 436–443. - The Platelet Receptor Inhibition in Ischemic Syndrome Management in
Patients Limited by Unstable Signs and Symptoms (PRISM–PLUS) Study
Investigators. Inhibition of the platelet glycoprotein IIb/IIIa receptor with
tirofiban in unstable angina and non–Q–wave myocardial infarction // N Engl J
Med. 1998; 338: 1488–1497. -
Yusuf S., Mehta S. R., Zhao F. et al. On Behalf of the CURE (Clopidogrel
in Unstable angina to prevent Recurrent Events) Trial Investigators. Early and
Late Effects of Clopidogrel in Patients With Acute Coronary Syndromes //
Circulation. 2003; 107: 966–972. -
Eisenstein E. L., Anstrom K. J., Kong D. F., Shaw L. K., Tuttle R. H.,
Mark D. B., Kramer J. M., Harrington R. A., Matchar D. B., Kandzari D. E.,
Peterson E. D., Schulman K. A., Califf R. M. Clopidogrel use and
long-term clinical outcomes after drug-eluting stent implantation // JAMA.
2006, Dec 5: E1–E10. - Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE)
investigators. Effects of dopidogrel in addition to aspirin in patients with
acute coronary syndromes without ST-segment elevation // N. Engl. J. Med.
2001; 345: 494–498. -
Wiviott S. D., Braunwald E., McCabe C. H., Montalescot G., Ruzyllo W.,
Gottlieb S., Neumann F. J., Ardissino D., De Servi S., Murphy S. A., Riesmeyer
J., Weerakkody G., Gibson C. M., Antman E. M. TRITON-TIMI 38
Investigators // N Engl J Med. 2007; 357: 2001–2015. -
Wallentin L., Becker R. C., Budaj A. Ticagrelor versus
clopidogrel in patients with acute coronary syndromes // N Engl J Med. 2009;
361. -
Serebruany V. L., Atar D. The PLATO trial: do you believe in
magic? // European Heart Journal. 2010, 31, 764–767. -
Сумароков А. Б., Бурячковская Л. И., Учитель И. А. Кровотечения у
больных с ишемической болезнью сердца при проведении терапии антиагрегантами
// CardioСоматика. 2011; 3: 29–35. -
Ramaraj R., Movahed M. R., Hashemzadeh M. Novel antiplatelet
agent ticagrelor in the management of acute coronary syndrome // J Int
Cardiology. 2011; 24 (3): 199–207. -
Goto Sh., Yamaguchi T., Ikeda Y. Safety and exploratory efficacy
of the novel thrombin receptor (PAR-1) antagonist SCH530348 for NSTE ACS // J
Atheroscler Thromb. 2010; 17: 156–164. -
Bousser M. G., Amarenco P., Chamorro A. Terutroban versus aspirin
in patients with cerebral ischaemic events (PERFORM): a randomised,
double-blind, parallel-group trial // Lancet. Vol. 377, Iss. 9782, p.
2013–2022. -
Hennerici M. G., Bots M. L., Ford I. Rationale, design and
population baseline characteristics of the PERFORM vascular project: an
ancillary study of the prevention of CV events of ischemic origin with
terutroban // Cardiovasc. Drugs Ther. 2010; 24: 175–180. -
Fiessinger J., Bounameaux H., Cairols M. On behalf of the TAIPAD
Investigators. Thromboxane antagonism with terutroban in peripheral arterial
disease: the TAIPAD study. // J. Thromb. Haemost. 2010, 8, 2369–2376. -
De Abajo F. J., Garcia Rodriguez L. A. Risk of upper
gastrointestinal bleeding and perforation associated with low-dose aspirin as
plain and enteric-coated formulations // BMC Clin Pharmacol. 2001; 1: 1. -
Kelly J. P., Kaufman D. W., Jurgelon J. M. et al. Risk of
aspirin-associated major upper-gastrointestinal bleeding with enteric-coated
or buffered product // Lancet. 1996; 348: 1413–1416. -
Garcia Rodriguez L. A., Hernandez-Diaz S., de Abajo F. J.
Association between aspirin and upper gastrointestinal complications:
systematic review of epidemiologic studies // Br J Clin Pharmacol. 2001; 52:
563–571. -
Smale S., Tibble J., Sigthorsson G., Bjarnason I. Epidemiology
and differential diagnosis of NSAID-induced injury to the mucosa of the small
intestine // Best Pract. Res. Clin. Gastroenterol. 2001. 15. P. 723–738. -
Schneider A. R., Benz C., Riemann J. F. Adverse effects of
nonsteroidal anti-inflammatory drugs on the small and large bowel // Endoscopy.
1999. 31. P. 761–767. -
Muller P., Simon B. The action of the proton pump inhibitor
pantoprazol against acetylsalicylic acid-induced gastroduodenopathy in
comparison to ranitidine. An endoscopic controlled double blind comparison //
Arzneimittelforschung. 1998. 48. P. 482–485. -
Yeomans N., Lanas A., Labenz J. Efficacy of esomeprazole (20 mg
once daily) for reducing the risk of gastroduodenal ulcers associated with
continuous use of low-dose aspirin // Am J Gastroenterol. 2008; 103:
2465–2473. -
Silverstein F. E., Graham D. Y., Senior J. R. Misoprostol reduces
serious gastrointestinal complications in patients with rheumatoid arthritis
receiving nonsteroidal anti-inflammatory drugs: a randomised, double-blind,
placebo-controlled trial // Ann. Intern. Med. 1995. 123. P. 241–249. -
Agrawal N. M., Van K. E., Erhardt L. J., Geis G. S. Misoprostol
coadministered with diclofenac for prevention of gastroduodenal ulcers. A
one-year study // Dig. Dis. Sci. 1995. 40. P. 1125–1131. -
Raskin J. B., White R. H., Jackson J. E. Misoprostol dosage in
the prevention of nonsteroidal anti-inflammatory drug-induced gastric and
duodenal ulcers: a comparison of three regimens // Ann. Intern. Med. 1995.
123. P. 344–350. -
Taha A. S., Hudson N., Hawkey C. J. Famotidine for the prevention
of gastric and duodenal ulcers caused by nonsteroidal anti-inflammatory drugs
// N. Engl. J. Med. 1996. 334. P. 1435–1439. -
Swift G. L., Heneghan M., Williams G. T. et al. Effect of
ranitidine on gastroduodenal mucosal damage in patients on long-term
non-steroidal anti-inflammatory drugs // Digestion. 1989. 44. P. 86–94. -
Кукес В. Г., Остроумова О. Д. Кардиомагнил. Новый взгляд на
ацетилсалициловую кислоту: пособие для врачей. М., 2004. -
Остроумова О. Д. Возможности применения кардиомагнила у пациентов
с сахарным диабетом // Русский медицинский журнал. 2004; 12 (5): 350. -
Сыркин А. Л., Добровольский А. В. Кардиомагнил — новая
эффективная форма ацетилсалициловой кислоты // Русский медицинский журнал.
2005. № 2. С. 92–93.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru






