Содержание статьи
Пропедевтика лучевых методов обследования желчного пузыря
В. А. Петухов*, доктор медицинских наук, профессор
Д. А. Чуриков**, кандидат медицинских наук
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГУЗ ГКБ № 1 им. Н. И. Пирогова, Москва
Ведущим методом диагностики патологических изменений желчного пузыря (ЖП) является ультразвуковое исследование (УЗИ).
Ультразвуковое исследование
Несомненными его преимуществами являются неинвазивность, возможность быстрого и портативного проведения исследования; отсутствие действия ионизирующей радиации и необходимости внутривенного введения контрастных веществ; независимость от физиологического состояния желудочно-кишечного тракта и гепатобилиарной системы [1–3].
Особенности синтопии желчного пузыря — прилежание его задней стенки в области тела и дна к правым отделам толстого кишечника и луковице двенадцатиперстной кишки диктуют необходимость подготовки пациентов к ультразвуковому обследованию с целью уменьшения пневматизации соответствующих отделов пищеварительного тракта. Для этого необходимо, как минимум, 6-часовое голодание накануне проведения диагностической манипуляции, а оптимальным считается проведение исследования натощак после ночного сна. Такие условия требуются еще и для наиболее детальной визуализации строения стенки желчного пузыря и его содержимого, поскольку он представляет собой полый орган, заполненный желчью и способный сокращаться в ответ на гуморальную стимуляцию при приеме пищи, что приводит к уменьшению его размеров, резкому утолщению стенок и невозможности детализировать внутрипросветные изменения [2, 3].
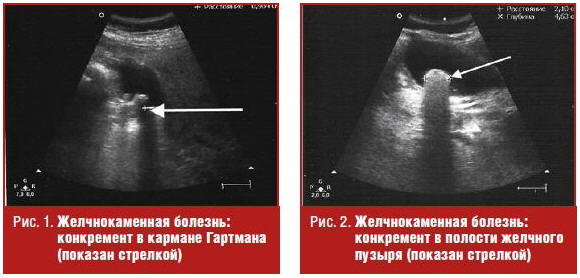
Анатомическое строение желчного пузыря несложно. В нем выделяют узкую шейку, соединяющуюся с пузырным протоком, тело пузыря, имеющее практически параллельные стенки, и куполообразное дно. В месте соединения шейки и пузырного протока стенка часто образует карман (или дивертикул) Гартмана, в котором могут скапливаться конкременты, блокирующие выход пузырной желчи [3–5] (рис. 1).
Для проведения ультразвукового исследования желчного пузыря датчик сканера (как правило, частотой 3,5 МГц) располагают в правом подреберье обследуемого — месте анатомической проекции. Улучшить визуализацию органа можно, уложив пациента на левый бок, что позволяет несколько оттеснить петли кишечника влево, этой же цели служит проведение исследование во время задержки дыхания при глубоком вдохе. Визуализация желчного пузыря через межреберья наиболее постоянна, но наименее информативна и используется в основном в ургентных ситуациях у неподготовленных пациентов. Для лучшей оценки характера внутрипузырных изменений (наличие мелких конкрементов, выявление их подвижности) возможно проведение обследования в вертикальном их положении или с наклоном туловища вперед [2–5].
В диагностике желчнокаменной болезни (ЖКБ) ультразвуковое сканирование по праву занимает ведущие позиции. Чувствительность ультразвукового исследования при выявлении желчных конкрементов превышает 95%, которые выглядят как гиперэхогенные структуры с акустической тенью [1, 5] (рис. 2).
В подавляющем большинстве случаев конкременты подвижны, но могут быть фиксированы к стенке или неподвижно располагаться в шейке пузыря. Другими инородными телами, имитирующими холелитиаз, могут быть сгустки крови или гноя, паразиты. Полипы желчного пузыря неподвижны или ограниченно подвижны в случае наличия у них ножки, всегда связаны со стенкой и, как правило, не дают акустической тени, обычно размер их не превышает 5 мм. Как правило, на фоне длительного отсутствия сокращений пузыря возможна визуализация расслоения желчи на два компонента с четкой границей раздела, один из которых анэхогенный и занимает верхние, по отношению к горизонтальной плоскости, отделы пузыря, другой — более плотный, располагающийся снизу. Это явление, называемое застоем желчи, или сладжем (англ. «sludge» — грязь, тина, ледяная каша, ил, взвесь), возникает вследствие присутствия в ней кристаллов холестерина и билирубината кальция и их способности обратимо формировать крупные агрегаты (рис. 3).
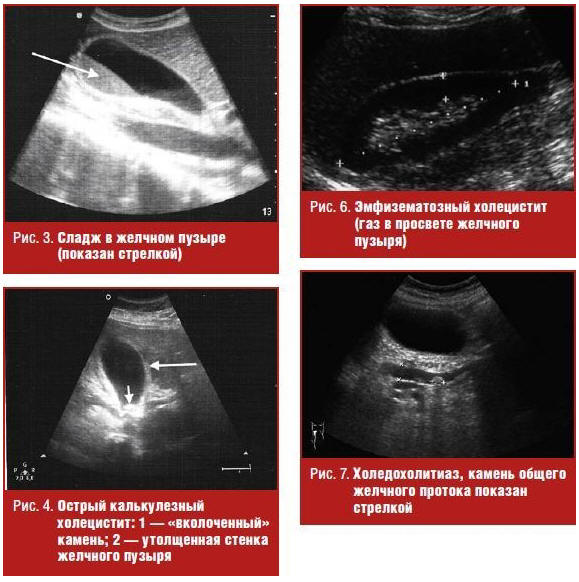
Наиболее частое осложнение желчнокаменной болезни — острый холецистит, причиной которого практически всегда является нарушение оттока желчи из желчного пузыря. Основными ультразвуковыми признаками этой патологии служат:
- наличие конкрементов в просвете пузыря (наиболее характерно обнаружение «вколоченного» конкремента в шейке) — рис. 4;
- утолщение стенки более 3 мм с появлением неоднородности ее структуры, расслоения (рис. 4);
- увеличение поперечного размера пузыря более 4 см; выявление наибольшей болезненности в месте ультразвуковой проекции желчного пузыря (ультразвуковой симптом Мерфи), которая может не определяться при гангренозном холецистите [3, 5] (рис. 4).
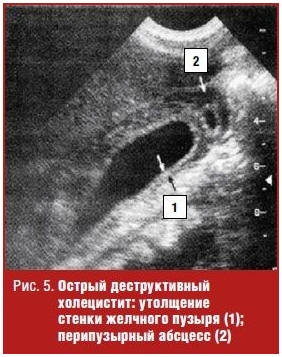
Сочетание указанных симптомов с обнаружением скопления жидкости около пузыря, особенно в сочетании с выявлением дефекта стенки, говорит о ее перфорации и, возможно, о формировании перипузырного абсцесса (рис. 5). Обнаружение ультразвуковых признаков скопления газа в просвете пузыря на фоне других признаков острого его воспаления указывает на такую тяжелейшую патологию, как эмфизематозный холецистит, вызываемый газообразующей анаэробной флорой [3, 5] (рис. 6).
Другое осложнение желчнокаменной болезни, проявляющееся нарушением пассажа желчи, — холедохолитиаз. Нарушение оттока желчи по общему желчному протоку вызывает его расширение более 7 мм, расширение внутрипеченочных желчных протоков (более 40% от диаметра прилежащей ветви воротной вены) (рис. 7). Бесспорным доказательством холедохолитиаза служит обнаружение конкрементов, которые чаще всего локализуются в дистальной части общего желчного протока, но могут быть визуализированы лишь в 70–80% случаев [1, 4, 5].
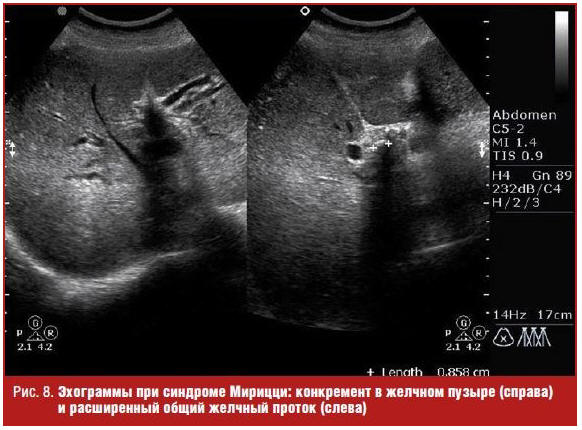
Расширение внутри- и внепеченочных желчных протоков отмечается и при таком осложнении желчнокаменной болезни, как синдром Мирицци (Mirizzi), который заключается в обструкции общего желчного протока в результате объемного эффекта воспалительной реакции тканей на камень, расположенный в шейке пузыря или пузырном протоке, при низком впадении его в холедох (рис. 8) [5].
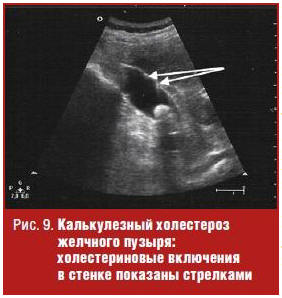
Нередко образованию конкрементов в желчном пузыре сопутствуют доброкачественные изменения его стенок, одной из основных которых выступает нарушение обмена холестерина. Эти изменения называются гиперпластической холецистопатией. Один из ее вариантов — холестериновая дистрофия проявляется такими ультразвуковыми признаками, как выявление в стенке пузыря гиперэхогенных отложений размером не более 1 мм, не дающими акустической тени, но сопровождающимися эффектом реверберации (пузырь отдаленно напоминает клубнику), которые являются липидными отложениями (рис. 9). Более выраженные изменения стенки, называемые аденомиоматозом, проявляются в ее утолщении, образовании интрамуральных дивертикулов (синусы Ашоффа–Рокитанского), содержащих гиперэхогенные холестериновые отложения с эффектом реверберации («хвост кометы») и микролиты, дающие акустическую тень (рис. 9). Гиперпластическая холецистопатия может поражать как весь пузырь, так и часть его стенки [2, 5].
Известно, что удаление ЖП по поводу ЖКБ не избавляет больных от метаболических нарушений, в том числе от гепатоцитарной дисхолии, сохраняющейся и после операции [6]. Выпадение физиологической роли ЖП, а именно концентрация желчи в печени в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения [6, 7].
Изменение химического состава и объема желчи, хаотическое ее поступление в двенадцатиперстную кишку после холецистэктомии (ХЭ) нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению и нарушению моторики двенадцатиперстной кишки, развитию синдрома избыточного бактериального роста в кишечнике (особенно в подвздошной кишке), расстройству печеночно-кишечной циркуляции и снижению синтеза желчных кислот в печени [6]. Как следствие — синдром нарушенного пищеварения, симптомы которого часто ошибочно трактуются как постхолецистэктомический синдром (ПХС), ассоциирующийся хирургами в первую очередь с нераспознанными до операции или не устраненными во время ХЭ механическими препятствиями желчеоттоку (оставленными или возникшими вновь камнями в холедохе, стенозом фатерова сосочка и т. д.) [6].
При подготовке к операции ХЭ большое внимание всегда уделяется диагностике механических препятствий желчеоттоку в двенадцатиперстную кишку. Совершенно иное дело обстоит с дооперационной верификацией внепеченочных билиарных дисфункций. Отсутствие косвенных признаков функциональных нарушений сфинктера Одди в виде расширения общего желчного протока при УЗИ, повышения печеночных ферментов, болевых приступов и т. д. совсем не исключает дисфункций фатерова сосочка, формирующихся задолго до поступления пациента. По нашим данным, у 45% пациентов с желчнокаменной болезнью при радионуклидной гепатобилисцинтиграфии (ГБСГ) устанавливаются функциональные нарушения транспорта радиофармпрепарата из общего желчного протока в двенадцатиперстную кишку, не требующие проведения ретроградной панкреатохолангиографии и эндоскопической коррекции.
Радионуклидные методы в ряде случаев являются просто безальтернативными из-за строгой специфичности включения радиофармпрепарата (РФП) в различные метаболические процессы (ГБСГ). Функциональное состояние гепатобилиарной системы при любой патологии гепатобилиарной системы, в том числе и при ЖКБ, изучается с помощью стандартной ГБСГ.
Гепатобилисцинтиграфия
ГБСГ позволяет объективно оценивать наиболее важные с позиций функционирования пищеварительно-транспортного конвейера процессы: желчесинтетическую и желчеэкскреторную функции печени, а также транспорт желчи в двенадцатиперстную кишку. Метод основан на регистрации пассажа короткоживущих радионуклидов Тс-99м+бромезида по билиарному тракту.
Исследование проводится натощак, в горизонтальном положении пациента после введения 3 мКм Тс-99м+бромезида внутривенно. Длительность процедуры составляет 60 минут. В качестве желчегонного завтрака пациенты принимают желтки куриных яиц или 200 мл 10% сливок через 30 минут от начала исследования.
Нормальными показателями ГБСГ считаются:
1) время полувыведения (Т1/2) радиофармпрепарата (РФП) из печени менее 35 минут;
2) время полувыведения (Т1/2) РФП из холедоха менее 50 минут;
3) время поступления РФП в двенадцатиперстную кишку менее 40 минут;
4) адекватным поступлением РФП в кишечник является преобладание активности РФП в двенадцатиперстной кишке по сравнению с таковой в холедохе к концу исследования.
Общепринятая стандартная методика радиоизотопного исследования с желчегонным завтраком не всегда позволяет конкретизировать характер функциональных изменений желчеоттока. Это объясняется тем, что пищевая нагрузка оказывает свое действие как посредством активации поступления в кровоток холецистокинина (ХК) при раздражении I-клеток слизистой оболочки двенадцатиперстной кишки и интрамурального нервного сплетения [8]. Активность пищеварительных ферментов и чувствительность сфинктерного аппарата желчевыводящих путей к интестинальным гормонам вариабельна и на практике трудноопределима [9]. Тонус интрамуральных нервных волокон зависит от физиологической активности органов верхних отделов пищеварительного тракта [10, 11].
В этой связи при радионуклидной диагностике внепеченочных билиарных дисфункций (ВБД) достаточно часто применяется внутривенное введение гормона холецистокинина, но релаксирующий эффект этого препарата зависит от состояния центральной нервной системы, гормонального фона пациента и нарушается при холестерозе ЖП, поскольку локализация рецепторов к холецистокинину совпадает с местами отложений эфиров холестерина в стенке пузыря и желчных протоках, что затрудняет точное определение дозы вводимого гормона [8, 10].
Для уточнения характера нарушений желчеоттока по общему желчному протоку в клинике факультетской хирургии им. С. И. Спасокукоцкого РНИМУ им. Н. И. Пирогова на базе Первой Градской больницы выполняются ГБСГ с аминокислотным холекинетическим тестом (ГБСГ-АХТ) и ГБСГ с Бускопан®-тестом (патент РФ № 2166333).
ГБСГ с аминокислотным холекинетическим тестом
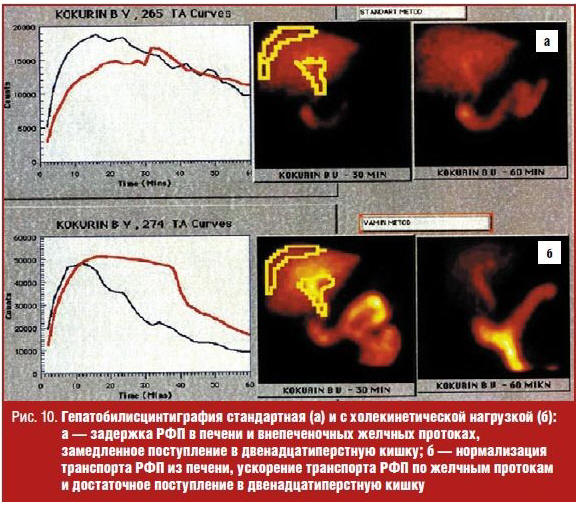
Исследование проводится натощак. Через 30 минут после введения РФП и начала исследования в периферическую вену вводится раствор аминокислот Вамин-14 или Фреамин, не содержащие глюкозы и электролитов. Последнее условие мы считаем весьма важным, так как возникающая при инфузии глюкозы гипергликемия полностью или частично ингибирует секрецию холецистокинина [8]. Доза препарата выбиралось из расчета 1,5–2 мл/кг массы тела (80–130 мл). Продолжительность инфузии составляет 5–7 минут, поскольку введение раствора аминокислот более 10 минут (независимо от дозы) не приводит к увеличению выброса эндогенного холецистокинина, а наоборот, снижает инкрецию гормона [9]. ВБД и причина замедленной экскреции радиофармпрепарата гепатоцитами оценивается на основании различий показателей стандартной ГБСГ и ГБСГ-АХТ (рис. 10).
ГБСГ с использованием гиосцина бутилбромида
Гиосцина бутилбромид (Бускопан®) — производное третичного аммониевого соединения гиосцина. Гиосцин — алкалоид, присутствующий в растении рода Duboisia. Его химически перерабатывают с помощью добавления бутиловой группы для получения четвертичной аммониевой структуры. Эта модификация формирует молекулу, которая по-прежнему обладает антихолинергическими свойствами, сравнимыми со свойствами гиосцина.
Но, в отличие от гиосцина, четвертичные аммониевые соединения, такие как гиосцина бутилбромид, ограничивают системное поглощение и значительно уменьшают число побочных реакций. Гиосцина бутилбромид — антихолинергический препарат с высокой степенью сродства к мускариновым рецепторам, расположенным на клетках гладких мышц желудочно-кишечного тракта, вызывает спазмолитический эффект. Кроме того, препарат связывается с никотиновыми рецепторами, что определяет эффект блокировки нервных узлов, что обуславливает его антисекреторное действие.
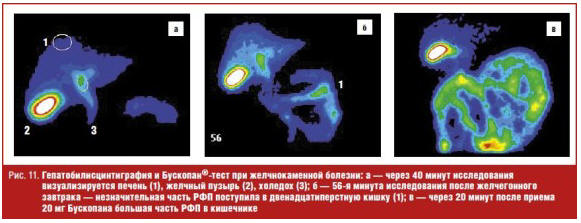
Техническая сторона исследования мало отличается от вышеизложенного АХТ-теста. По окончании стандартной гепатобилисцинтиграфии пациент вместо инфузии раствора аминокислот принимает per os 20 мг гиосцина бутилбромида. Через 20 минут выполняется повторная запись и обработка данных (рис. 11). Таким образом, применение Бускопан®-теста позволяет сократить время диагностики для врача и упрощает диагностическую процедуру для пациента.
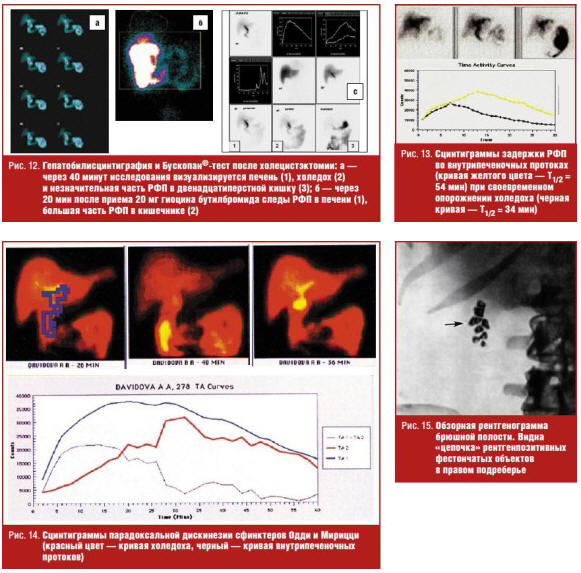
Наиболее эффективно ГБСГ с Бускопан®-тестом зарекомендовала себя при исследовании пациентов после холецистэктомии (рис. 12).
Ведущими факторами нарушения функции печени после холецистэктомии являются наличие и продолжительность дискинезии сфинктерного аппарата желчных путей. У пациентов значительно преобладает парадоксальный спазм сфинктера Одди как причина задержки РФП в холедохе. Функциональные нарушения оттока желчи обусловлены холестерозом желчных путей, в частности сфинктера Одди (рис. 13, 14).
Рентгенологические методы
Рентгенологические методы исследования желчного пузыря и внепеченочных желчных протоков сегодня практически не применяются, поэтому приводим их краткое описание в качестве исторической справки.
Обзорная рентгенография
Обзорная рентгенография брюшной полости проводится намного реже, чем УЗИ, из-за лучевой нагрузки. Но, тем не менее, она являлась достаточно информативным методом диагностики желчекаменной болезни. На рентгенограмме можно увидеть наличие, месторасположение и количество рентгенпозитивных камней, содержащих соли кальция (рис. 15).
Пероральная холецистография
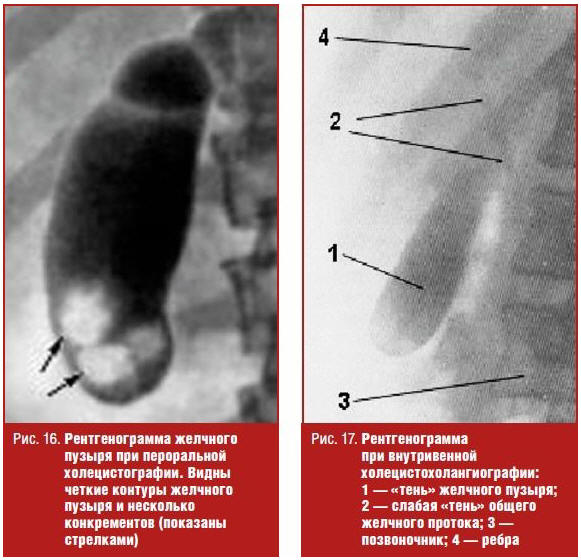
Пероральная холецистография проводится при подозрении на рентгеннегативные (холестериновые) камни. Метод основывается на всасывании в желудочно-кишечном тракте и выведении с желчью контрастного вещества (рис. 16).
При нарушении всасывания в кишечнике, снижении выделительной функции печени, закупорке пузырного протока камнем и прочем пероральная холецистография может быть отрицательной, т. е. на ней не определяется тень желчного пузыря.
Внутривенная холецистография
Внутривенная холецистография выполняется при отрицательном результате перорального рентгеноконтрастного метода. С помощью данной методики удается контрастировать желчный пузырь в 80–90% случаев (рис. 17).
Компьютерная томография и магнитно-ядерная (магнитно-резонансная) томография
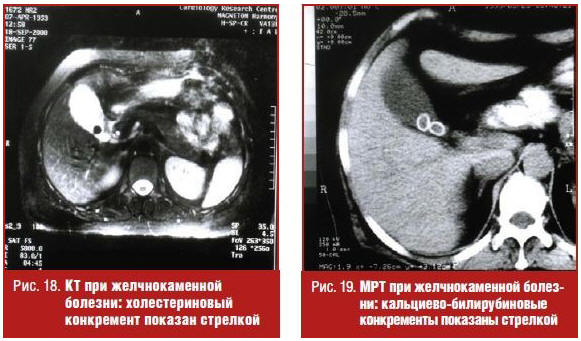
Недостатки классических рентгенологических исследований желчного пузыря с успехом восполняют компьютерная томография (КТ) и магнитно-ядерная томография (магнитно-резонансная томография, МРТ). При калькулезном холестерозе конкременты визуализируются в виде теней однородной структуры (холестериновые камни) (рис. 18) или представлены неоднородными тенями с чередованием участков смешанных камней — холестериновое ядро с кальциево-билирубиновой оболочкой (рис. 19).
Компьютерная томография и магнитно-ядерная томография позволяют заподозрить желчекаменную болезнь у пациентов, обследуемых по поводу другой патологии органов брюшной полости, так как описание изображения желчного пузыря является обязательной составляющей протокола этих исследований.
Литература
- Практическое руководство по ультразвуковой диагностике. Под ред. В. В. Митькова. М.: Видар-М, 2003. Т. 1. 720 с.
- Brant W. E., Helms C. A. Fundamentals of Diagnostic Radiology, 2 nd ed. Lippincott, Williams and Wilkins, p. 836–841.
- Kurtz A. B., Middleton W. D. Ultrasound: The Requisites. Philadeiphia, Hanley&Belfus, 1996, p. 35–71.
- Parulekar S. G. Transabdominal sonography of bile ducts // Ultrasound Q. 2002, (18) 3: 187–202.
- Rumack C. M., Wilson S. R., Charboneau J. W. (eds). Diagnostic Ultrasound, 2 nd ed. St. Louis, Mosby, 1998, p. 172–195.
- Савельев В. С., Петухов В. А. Желчекаменная болезнь и синдром нарушенного пищеварения. М.: БОРГЕС, 2010. 258 с.
- Савельев В. С., Петухов В. А., Болдин Б. В. Холестероз желчного пузяря. М.: ВЕДИ, 2002., 176 с.
- Высоцкая Р. А. Простагландины и гастроинтестинальные гормоны при хронических заболеваниях печени. Дисс. докт. биол. наук. М., 1992, 340 с.
- Houda R., Tooli J., Dodds W. J. Effect of enteric hormons on sphincter of Oddi and gastrointestinal myoelectric activity in fasted conscious opossums // Gastroenterol. 1983, vol. 84, p. 1–9.
- Weechsler-J. G. Bedeutung der Gallenblase in der Regulation des duodenogastralen Refluxes // Z-Gastroenterol. 1987, Aug. 25, Suppl 3: p. 15–21.
- Петухов В. А. Липидный дистресс-синдром. Под ред. В. С. Савельева, М.: МАКС ПРЕСС, 2010. 544 с.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





