Содержание статьи
Введение
Преждевременная овариальная недостаточность (ПОН) определяется как недостаточность яичников в возрасте до 40 лет [1]. Она характеризуется прекращением менструации не менее чем на 4 мес., что связано с повышением концентрации в крови сывороточного фолликулостимулирующего гормона (ФСГ) >40 МЕ/л [2]. Частота возникновения первичной (идиопатической) ПОН составляет 1% среди женщин в возрасте до 40 лет и 0,1% среди женщин в возрасте до 30 лет [3, 4]. Вторичная же (хирургически индуцированная) ПОН встречается значительно чаще и напрямую коррелирует с частотой заболеваний, требующих хирургического удаления обоих яичников. ПОН доказанно влияет на рост заболеваемости и смертности у страдающих ею женщин [5]. Данная патология сопровождается гипоэстрогенизмом, который оказывает негативное воздействие на различные органы и системы женского организма [1]. ПОН может иметь как спонтанный (идиопатический), так и индуцированный характер. Спонтанная ПОН имеет генетические, аутоиммунные, воспалительные, ферментные, метаболические или идиопатические причины [6, 7]. Ятрогенная ПОН в основном вызвана результатами лечения онкологических заболеваний, такими хирургическими вмешательствами, как билатеральная оофорэктомия, химиотерапия, радиотерапия и др. [6].
У больных, страдающих ПОН, развиваются две группы осложнений: краткосрочные, связанные с быстро наступающим дефицитом эстрогенов, и куда более опасные долгосрочные, обусловливающие дисфункцию и повреждение множества органов и даже систем. У женщин, страдающих ПОН, выявлен повышенный риск развития смерти от всех причин. В крупном скандинавском исследовании [8], в котором участвовала 19 731 женщина, было обнаружено, что менопауза, возникающая у женщин моложе 40 лет, повышает риск смертности на 1,06 (95% доверительный интервал (CI) 0,99–1,14) по сравнению с женщинами с физиологической менопаузой. Также было обнаружено, что раннее наступление менопаузы сокращает общую ожидаемую продолжительность жизни. По данным, полученным из проспективного когортного исследования с участием 68 154 взрослых женщин в США, было выявлено, что смертность от всех причин выше среди женщин, сообщивших о наступлении менопаузы в возрасте 40–44 лет, по сравнению с женщинами с физиологической менопаузой (относительный риск (RR) 1,04, 95% CI 1,00–1,08) [9]. Риск смерти у женщин, страдающих ПОН, в основном связан с увеличением риска смерти от таких причин, как ишемическая болезнь сердца (RR 1,09, 95% CI 1,00–1,18), патология дыхательных путей (RR 1,19, 95% CI 1,02–1,39), заболевания почек и мочевыводящих путей (RR 1,39, 95% CI 1,07–1,82), а также от различных внешних причин (RR 1,56, 95% CI 1,21–2,02) [10].
Из всего вышесказанного следует, что как можно более раннее выявление ПОН будет способствовать значительному улучшению прогноза этих пациенток. Однако своевременная постановка диагноза крайне затруднена, так как на раннем этапе развития заболевания жалобы либо отсутствуют, либо не специфичны, что не позволяет на протяжении продолжительного времени поставить верный диагноз. Поэтому пациентки часто обращаются к врачу уже при развитии у них одного или нескольких осложнений ПОН. Именно в этом вопросе и пытается помочь исследование генных полиморфизмов. Благодаря своевременному и быстрому скрининговому выявлению таких больных можно помочь им до развития у них тяжелых проявлений ПОН.
Ген AGT (OMIM: +106150) локализован в хромосоме 1q42.2. Он кодирует белок ангиотензиноген — сывороточный глобулин, вырабатываемый клетками печени, из которого под действием ренина образуется ангиотензин I. Участок ДНК гена AGT, в котором тимин (Т) заменяется на цитозин (С) в позиции 704, называется генетическим маркером T704C. В результате этой мутации происходит замена в белке ангиотензиногене в позиции 235, триптофан замещает метионин, что и нарушает нормальную работу гена, — данная мутация носит название Met235Thr [11]. Встречаемость С-аллеля в популяции белых европейцев составляет 41% [12]. Данная мутация ассоциирована с такими заболеваниями, как хроническая почечная недостаточность, ишемическая болезнь сердца (ИБС), артериальная гипертензия, а также эклампсия и преэклампсия.
Ген ITGA2 (OMIM: +192974) локализован в хромосоме 5q11.2. Он кодирует белок интегрин альфа-2 — мембранный гликопротеин, который экспрессируется на мембранах различных клеток: лейкоцитах, фибробластах, мегакариоцитах и тромбоцитах. Участок последовательности ДНК гена ITGA2, в которой происходит замена нуклеотида цитозина (С) на тимин (Т) в позиции 807, обозначается как генетический маркер C807T [13]. Частота встречаемости T-аллеля в популяции белых европейцев составляет примерно 40% [14]. Данная мутация ассоциирована с такими заболеваниями, как тромбоэмболия, инфаркт миокарда и ишемический инсульт.
Ген NOS3 (OMIM: +163729) локализован в хромосоме 7q36.1. Он кодирует белок эндотелиальную синтазу азота 3-го типа. Участок ДНК гена NOS3, в котором происходит замена тимина (T) на цитозин (С) в позиции 786, называется генетической аномалией T(-786)C [15]. Частота встречаемости С-аллеля в популяции белых европейцев составляет примерно 35% [16]. Данная мутация ассоциирована с заболеваниями, протекающими со спазмом коронарных артерий.
Ген FGB (OMIM: *134830) локализован в хромосоме 4q31.3. Он кодирует β-полипептидную цепь белка фибриногена, растворимого белка плазмы крови, который относится к группе глобулинов (фактор I свертывания крови). Участок ДНК гена FGB, в котором происходит замена гуанина (G) на аденин (А) в позиции 455, обозначается как генетическая аномалия G(-455)A. Патологическая замена гуанина на аденин отрицательно влияет на интенсивность синтеза фибриногена [17]. Частота встречаемости А-аллеля в популяции белых европейцев составляет примерно 20% [18]. Данная мутация ассоциирована с такими заболеваниями, как ИБС, ишемический инсульт, тромбозы, тромбоэмболия легочной артерии (ТЭЛА), а также с патологией беременности: привычным невынашиванием, фетоплацентарной недостаточностью и т. д. Ген ITGB3 (OMIM: *173470) локализован в хромосоме 17q21.32. Он кодирует белок интегрин бета-3 (ITGB3) — мембранный гликопротеин, известный как тромбоцитарный гликопротеин IIIа (platelet glycoprotein GPIIIa). На мембране тромбоцитов GPIIIa образует комплекс с GPIIb (альфа-субъединица, кодирующаяся геном ITGA2B), представляющий собой тромбоцитарный рецептор фибриногена. Участок ДНК гена ITGB3, где происходит замена нуклеотида тимин (T) на цитозин (С) в позиции 1565, обозначается как генетическая аномалия T1565C. В результате данной мутации биохимические свойства белка GPIIIa значительно изменяются, что крайне негативно влияет на выполняемую им функцию [19]. Частота встречаемости С-аллеля в популяции белых европейцев составляет примерно 13% [20]. Данная мутация ассоциирована с такими заболеваниями, как инфаркт миокарда, ИБС, ТЭЛА, тромбоцитопения у новорожденных, посттрансфузионная пурпура, раннее прерывание беременности.
Ген SERPINE1 (OMIM: *173360) локализован в хромосоме 7q22.1. Данный ген кодирует белок — эндотелиальный ингибитор активатора плазминогена 1 (ИАП-1), принадлежащий семейству серпинов. Белок ИАП-1 ингибирует работу тканевого активатора плазминогена и урокиназы, которые в свою очередь активируют переход плазминогена в плазмин, расщепляющий фибрин в тромбах. Таким образом, данная аномалия негативно влияет на фибринолиз, препятствуя растворению тромбов, что повышает риск развития сердечно-сосудистых осложнений, а также различных тромбоэмболий.
Полиморфизм гена SERPINE1 заключается в изменении количества последовательностей гуанина (G) в промоторной области гена. Существует два вида данной патологии, что связано с разным количеством повторов гуанина в позиции 675:
5G обозначает наличие последовательности из пяти оснований гуанина;
4G обозначает наличие последовательности из четырех оснований гуанина.
При аномалии 4G происходит мутация, приводящая к ослаблению фибринолитической активности крови [21]. Частота встречаемости 4G-аллеля в популяции белых европейцев составляет примерно 53–61% [22]. Данная мутация ассоциирована с такими заболеваниями, как ИБС, инфаркт миокарда, тромбоз глубоких вен, ТЭЛА, ишемический инсульт, гипертоническая болезнь, преэклампсия, атеросклероз, тромбоэмболические осложнения беременности, повышенная инсулинорезистентность и ожирение.
Ген IL6 (OMIM: *147620) локализован в хромосоме 7p15.3. Он кодирует белок интерлейкин 6, который участвует в развитии иммунного ответа, запуская острую фазу воспаления. Участок ДНК гена IL6, в котором происходит замена гуанина (G) на цитозин (С) в позиции 572, называется генетической аномалией G(-572)C [23]. Частота встречаемости C-аллеля в популяции белых европейцев составляет примерно 5% [23]. Данная мутация ассоциирована с такими заболеваниями, как острый коронарный синдром, острое нарушение мозгового кровообращения, остеопороз и хронический периодонтит.
Ген EDN1 (OMIM: *131240) локализован в хромосоме 6p24.1. Ген эндотелина-1 (EDN1) кодирует белок, играющий ключевую роль в гомеостазе эндотелия сосудов, данный белок обладает сосудосуживающим действием наподобие ангиотензина. Эндотелин также индуцирует накопление коллагена и стимулирует митогенез миофибробластов и фибробластов — подобная активность играет значительную роль при регенерации тканей и формировании рубца.
В 5-м экзоне гена была обнаружена Lys198Asn, представляющая собой трансверсию G>T в 5665-м нуклеотиде, приводящую к замене лизина (Lys) на аспарагин (Asn) в 198-м положении аминокислотной последовательности. Частота встречаемости C-аллеля в популяции белых европейцев составляет примерно 23% [24]. Данная мутация ассоциирована с такими заболеваниями, как артериальная гипертензия, дилатационная кардиомиопатия, легочная гипертензия, сердечная недостаточность, ишемический инсульт, гипертрофия левого желудочка.
Цель исследования: выявить ассоциации между ПОН идиопатического и ятрогенного происхождения и рядом генных полиморфизмов неинфекционных заболеваний и их неблагоприятных исходов.
Материал и методы
Женщины с диагнозом ПОН были отобраны из различных лечебных учреждений Рязани и Рязанской области. ПОН определялась как возникновение вторичной аменореи ≥4 мес. в возрасте до 45 лет при уровне ФСГ выше 40 МЕ/л. Контрольная группа была сформирована, исходя из критериев сопоставимости по полу и возрасту, и состояла из женщин без признаков ПОН, таким образом, мы ставили целью выявить различие в генных полиморфизмах в этих группах женщин.
Вся информация до пациенток была донесена в доступной и понятной для них форме, все они подписали информированное добровольное согласие на проведение медицинских манипуляций.
Материалом для исследования служила свежесобранная венозная кровь. Метод исследования — полимеразная цепная реакция (ПЦР). Детекцию продуктов ПЦР осуществляли стандартизированным электрофоретическим методом в агарозном геле. Использовали наборы реагентов для определения полиморфизмов в геноме человека методом ПЦР c электрофоретической схемой детекции результата «SNP-ЭКСПРЕСС».
Анализу подвергалась геномная ДНК человека, выделенная из лейкоцитов цельной крови с помощью реагента «ДНК-экспресс-кровь». С образцом выделенной ДНК параллельно проводились две реакции амплификации с двумя парами аллель-специфичных праймеров. Результаты анализа позволяют дать три типа заключений: гомозигота по аллели 1, гетерозигота, гомозигота по аллели 2. Изучены следующие гены и их полиморфизмы: ген AGT полиморфизм (Met235Thr), ген ITGA2 полиморфизм (C807T), ген NOS3 полиморфизм (C786T), ген FGB полиморфизм (455G-A), ген ITGB3 полиморфизм (Leu59Pro), ген SERPINE (PAI) 1 полиморфизм (5G(‑675)4G), ген IL6 полиморфизм (G(-572)C), ген EDN1 полиморфизм (Lys198Asn).
Статистический анализ проводили с помощью программы Statistica 14.0. Нормальность распределения признаков оценивали с помощью критериев Шапиро — Уилка и Колмогорова — Смирнова. Описательная статистика представлена средними значениями и стандартными отклонениями средних (M±m) при нормальном распределении и медианой (Ме) с межквартильным интервалом Me (Q25; Q75) при ненормальном распределении. Несколько групп сравнивали с помощью многомерного критерия Краскела — Уоллиса. Для сравнения двух групп в случае распределений значений признака, отличного от нормального, был использован критерий Манна — Уитни. С целью выявления взаимосвязей изучаемых признаков рассчитывали отношение шансов (OR) и RR. Значения RR оценивали следующим образом: RR=1 — нет разницы в риске между двумя сравниваемыми группами, RR<1 — в экспериментальной группе событие развивается реже, чем в контрольной; RR>1 — в экспериментальной группе событие развивается чаще, чем в контрольной группе. Значение OR, превышающее 1, свидетельствует о том, что наличие признака А ассоциируется с признаком Б в том смысле, что наличие признака Б повышает (по отношению к отсутствию признака Б) шансы наличия признака A. Во всех случаях статистически значимыми считались различия при p<0,05.
Результаты исследования
В рамках исследования было сформировано три группы пациенток по 133 человека: пациентки с первичной ПОН идиопатического генеза, пациентки со вторичной ПОН ятрогенного генеза и здоровые женщины. Такое количество женщин в каждой группе было обусловлено материально-техническим аспектом исследования.
Как видно из таблицы, группа пациенток с первичной ПОН достоверно отличалась от группы здоровых женщин по частоте выявления всех генных полиморфизмов.
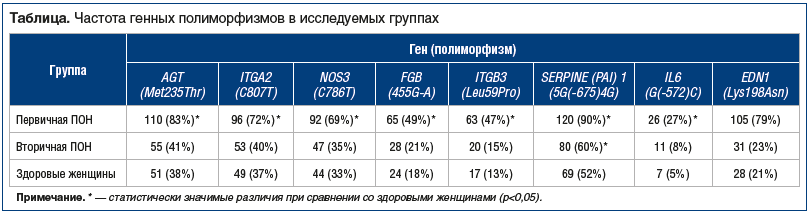
Выявлено существенное различие в относительном риске, а также степени ассоциации, между первичной (идиопатической) ПОН и генными полиморфизмами: ген AGT полиморфизм (Met235Thr) — RR=2,2, OR=7,7; ген ITGA2 полиморфизм (C807T) — RR=2,0, OR=4,5; ген NOS3 полиморфизм (C786T) — RR=2,1, OR=4,4; ген FGB полиморфизм (455G-A) — RR=2,8, OR=4,4; ген ITGB3 полиморфизм (Leu59Pro) — RR=3,6, OR=6,0; ген SERPINE (PAI) 1 полиморфизм (5G(‑675)4G) — RR=1,7, OR=8,6; ген IL6 полиморфизм (G(-572)C) — RR=3,9, OR=4,3; ген EDN1 полиморфизм (Lys198Asn) — RR=3,8, OR=13,9.
Установлено незначительное повышение относительного риска, а также степени ассоциации у пациенток со вторичной (ятрогенной) ПОН и генными полиморфизмами: ген AGT полиморфизм (Met235Thr) — RR=1,1, OR=1,1; ген ITGA2 полиморфизм (C807T) — RR=1,1, OR=1,1; ген NOS3 полиморфизм (C786T) — RR=1,1, OR=1,1; ген FGB полиморфизм (455G-A) — RR=1,2, OR=1,2; ген ITGB3 полиморфизм (Leu59Pro) — RR=1,2, OR=1,4; ген SERPINE (PAI) 1 полиморфизм (5G(‑675)4G) — RR=1,2, OR=1,4; ген IL6 полиморфизм (G(-572)C) — RR=1,6, OR=1,8; ген EDN1 полиморфизм (Lys198Asn) —RR=1,1, OR=1,4.
Из вышеизложенного видно, что риск возникновения генных полиморфизмов выше в группе пациентов с первичной ПОН. Благодаря расчету OR было обнаружено наличие ассоциации между идиопатической ПОН и рядом генных полиморфизмов, пусть и в разной степени выраженности, но всегда превышающей референсное значение в 1.
Что же касается вторичной (ятрогенной) ПОН, то тут хотя и получено превышение референсного значения в 1, но оно составило от <0,1 до 0,8 в обоих исследуемых статистических параметрах, что в силу ограниченности выборки не может служить достоверным критерием наличия ассоциации между этими явлениями и, как следствие, повышения риска их наступления.
При этом при исследовании генных полиморфизмов в контрольной группе не было выявлено существенных популяционных отличий от среднестатистической их распространенности среди белых европейцев.
Резюмируя вышеизложенное, можно говорить о наличии ассоциации первичной (идиопатической) ПОН с рядом весьма распространенных генных полиморфизмов, которые в свою очередь ассоциированы с патологией внутренних органов. Исходя из этого, мы можем уверенно говорить о значительно более высоком риске развития хронических неинфекционных заболеваний (в первую очередь сердечно-сосудистых) у пациенток с первичной ПОН как по сравнению со здоровыми женщинами, так и по сравнению с больными со вторичной формой ПОН. А учитывая тот факт, что более поздними проявлениями патогенеза ПОН и так является патология внутренних органов с преимущественным поражением сердечно-сосудистой системы, мы можем столкнуться с очень высоким риском развития как заболеваний внутренних органов, так и неблагоприятных исходов у женщин с первичной ПОН.
Обсуждение
Итак, согласно полученным нами данным мы можем уверенно говорить о более высоком риске развития патологии внутренних органов (в первую очередь сердечно-сосудистых заболеваний) именно у женщин с ПОН первичного генеза, что, в свою очередь, соответствует результатам большинства проводимых по этой теме исследований и согласуется с другими исследованиями, ранее уже обнаружившими полиморфизм-зависимый риск повреждения сосудов у больных ПОН [25].
Однако в исследованиях очень часто наблюдается один весьма спорный и противоречивый факт, а именно существенное колебание риска развития патологии внутренних органов в рамках одной исследуемой группы. Мы предположили, что данное колебание связано с разнородностью исследуемой группы, поэтому мы разделили ее на две независимые группы — с ПОН первичного (идиопатического) и с ПОН вторичного (ятрогенного) генеза. В результате такого разделения мы смогли получить более однородные данные, что подтверждает нашу гипотезу о существенно разном риске в этих исследуемых группах. Это, в свою очередь, может объяснить, почему в одних исследованиях у таких больных определялся высокий, а у других — средний или даже низкий риск развития заболеваний.
Что же касается пациенток со вторичной (ятрогенной) ПОН, то тут, хотя и получено превышение референсного значения в 1, но оно варьировало в пределах от <0,1 до 0,8 для обоих исследуемых статистических параметров, что в силу ограниченности выборки не может служить достоверным критерием наличия ассоциации между этими явлениями, и, как следствие, повышения риска их наступления. При этом при исследовании генных полиморфизмов в контрольной группе не было выявлено существенных популяционных отличий от среднестатистической их распространенности среди белых европейцев.
Наше исследование также затрагивает существенный вопрос изучения групп генных полиморфизмов, ассоциированных с ПОН. В исследовании [26] уже была выдвинута гипотеза о том, что частой причиной ПОН идиопатического генеза являются мутации в генах, сцепленных с X-хромосомой, которые часто сопровождаются множественными полиморфизмами и в других генах. Это также согласуется с нашими данными о множественном характере сопутствующих генных полиморфизмов именно у больных первичной ПОН.
Заключение
Пациентки с первичной (идиопатической) ПОН характеризовались достоверно (p<0,05) более высокой частотой встречаемости исследуемых генных полиморфизмов, ассоциированных с риском развития неинфекционных заболеваний, прежде всего сердечно-сосудистой системы. Также благодаря расчету отношения шансов и относительного риска было выявлено повышение относительного риска наличия генных полиморфизмов, а также степени их ассоциации. Исследование групп генных полиморфизмов способно в дальнейшем существенно помочь науке в вопросе оказания качественной медицинской помощи пациенткам с идиопатической ПОН.
Информация с rmj.ru






