Содержание статьи
Введение
Новые знания об особенностях функции и сложной рецепторной базе нижних мочевыводящих путей изменили подходы к вопросам наблюдения и лечения пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ) [1]. Симптомы нижних мочевых путей (СНМП) разнообразны и характерны не только для ДГПЖ. Основу клинических проявлений ДГПЖ составляет сочетание ирритативной, обструктивной и постмикционной симптоматики, выраженность которой зависит от ряда патогенетических факторов [2].
Патогенетически СНМП, ассоциированные с ДГПЖ, могут быть связаны с процессами физиологического старения, гипертрофией детрузора и воспалением, изменениями непосредственно самого уротелия нижних мочевых отделов [3–5]. У большинства пожилых мужчин одновременно с формированием ДГПЖ наблюдаются нарушение кровообращения и гипоксия детрузора в условиях повышенного уретрального сопротивления (энергетическая гипоксия) [6–12].
Современные подходы к лечению ДГПЖ
Лечение СНМП, ассоциированных с ДГПЖ, зависит от тяжести заболевания. Пациенту с легкой и умеренной степенью тяжести течения заболевания рекомендуется, как правило, консервативное лечение, при выраженной клинике и преобладании обструктивной симптоматики может быть показано оперативное лечение. При этом медикаментозная терапия имеет самое широкое применение: если около 30 лет назад по статистике оперировали до 50% пациентов с диагнозом ДГПЖ, то в настоящее время количество оперированных пациентов не превышает 25–30% [13].
Учитывая сложные патогенетические механизмы возникновения и развития ДГПЖ, медикаментозная терапия должна обладать антипролиферативным, противовоспалительным, антиандрогенным действием, а также способностью улучшать микроциркуляцию тканей предстательной железы.
Основные современные группы препаратов для лечения СНМП: ингибиторы 5α-редуктазы, α-адреноблокаторы, М-холиноблокаторы, агонисты β3-адренорецепторов, ингибиторы фосфодиэстеразы 5-го типа, препараты из растительного сырья и аналоги вазопрессина [14]. Зачастую α-адреноблокаторы являются 1-й линией лекарственной терапии у мужчин из-за быстрого начала действия, направленного непосредственно как на симптомы фазы опорожнения (динамический компонент), так и на симптомы фазы накопления, а также благодаря высокой эффективности, в том числе при больших объемах простаты. Современные α-адреноблокаторы имеют большую доказательную базу эффективности и благоприятный профиль безопасности. Однако следует помнить, что лечение носит симптоматический характер, при этом возможно развитие побочных эффектов. У пациентов может наступить эякуляторная дисфункция за счет ретроградного заброса спермы. Прием α-адреноблокаторов может потребовать титрования дозы у пациентов с сердечно-сосудистой патологией [15].
Ингибиторы 5α-редуктазы часто применяются в лечении ДГПЖ у мужчин с объемом предстательной железы более 40 cм3. За счет выраженного антипролиферативного действия эти препараты способствуют уменьшению размеров предстательной железы на 18–20% и более, длительно сохраняют эффективность (исследования длительностью до 6 лет), хорошо комбинируются с другими препаратами, в большинстве случаев отсутствуют лекарственные взаимодействия. Обладают влиянием на прогрессирование заболевания: снижают частоту развития острой задержки мочи и оперативных вмешательств при длительном приеме. Однако для ингибиторов 5α-редуктазы характерно медленное начало действия (3–6 мес.), влияние только на симптомы обструкции и отсутствие такого влияния непосредственно на детрузор. При приеме данных препаратов следует помнить о возможном снижении уровня простатического специ-фического антигена (ПСА) примерно на 50%. Кроме того, побочные эффекты ингибиторов 5α-редуктазы связаны с сексуальной функцией (расстройство эякуляции, эректильная дисфункция, гинекомастия) [16].
При выраженных СНМП у мужчин на фоне ДГПЖ возможно применение М-холинолитиков. Однако основным условием применения данной группы препаратов у пациентов с ДГПЖ является отсутствие инфравезикальной обструкции из-за возрастающего риска развития острой задержки мочи [17, 18].
Согласно Российским клиническим рекомендациям 2020 г. в России широко применяются препараты из растительного сырья, в том числе на основе плодов пальмы ползучей (Serenoa repens), активными составляющими которого служат жирные кислоты [1, 14, 19, 20]. Множество исследований in vitro показали, что данные фитопрепараты обладают противовоспалительным, антиандрогенным и антипролиферативным свойствами. Согласно Российским клиническим рекомендациям назначать препараты из растительного сырья следует пациентам с СНМП преимущественно легкой степени и при условии обязательного контроля эффективности лечения через 6 мес. [14]. В последнее время получила широкое распространение комбинированная терапия, совмещающая, например, α-адреноблокаторы и ингибиторы 5α-редуктазы, М-холиноблокаторы и α-адреноблокаторы. Могут использоваться и другие комбинации [21–24].
Все более широкое распространение получает применение комбинаций «традиционных» (конвенциональных) лекарственных средств с фитопрепаратами. Вероятно, это обусловлено небольшим количеством или отсутствием побочных эффектов фитопрепаратов в отличие от других лекарственных средств [25–27].
В исследовании PERSAT [28] была продемонстрирована значительная эффективность препаратов из растительного сырья (в основном за счет препарата на основе экстракта плодов пальмы ползучей), рекомендованных Французским национальным советом по здравоохранению, а также Французской ассоциацией урологов, в отношении СНМП, ассоциированных с ДГПЖ, в условиях реальной клинической практики. Одновременно с уменьшением частоты симптомов со стороны мочевыделительной системы пациенты, принявшие участие в данном исследовании, сообщают об улучшении субъективного восприятия своих симптомов. Эти благоприятные клинические эффекты сравнимы с результатами использования α-адреноблокаторов.
В 2021 г. Европейской ассоциацией урологов гексановый экстракт Serenoa repens включен в клинические рекомендации как средство, повышающее скорость потока мочи, рекомендованное пациентам, желающим сохранить половую функцию, что улучшает качество жизни пациентов с СНМП [1]. Эти же позиции сохранились в обновленных рекомендациях Европейского общества урологов 2022 г. Единственным гексановым экстрактом плодов Serenoa repens является Пермиксон (Permixon; Pierre Fabre Medicament, France). Множество исследований показали, что экстракт Serenoa repens ингибирует активность 5α-редуктазы, тормозя трансформацию тестостерона в его активный метаболит — дигидротестостерон. Кроме того, отмечается снижение пролиферации простатического эпителия, индуцированного факторами роста. Подавление синтеза простагландинов обусловливает противовоспалительное действие экстрактов; способность влиять на микроциркуляторное русло объясняет механизм положительного воздействия на сосудистую фазу воспаления, проницаемость капилляров, сосудистый стаз. Таким образом, данный препарат может быть использован на старте терапии, наряду с α-адреноблокаторами, при умеренной степени выраженности СНМП, ассоциированных с ДГПЖ [29–34].
В связи с включением в российские и европейские рекомендации растительного экстракта Serenoa repens на базе урологической клиники ГБУЗ НО НОКБ им. Н.А. Семашко было проведено наблюдение клинической эффективности и переносимости препарата Пермиксон в комбинации с α-адреноблокатором у пациентов с СНМП умеренной степени выраженности, ассоциированными с ДГПЖ.
Собственный опыт применения препарата Пермиксон
В наблюдательной программе приняли участие 58 мужчин в возрасте от 48 до 70 лет (средний возраст 60,1±3,4 года) с СНМП на фоне ДГПЖ. Все пациенты предъявляли жалобы на дизурические явления, в том числе ноктурию (2–6 мочеиспусканий за ночь).
Критерии включения: возраст ≥40 лет, наличие жалоб на расстройства мочеиспускания, более 8 баллов по шкале IPSS (The International Prostate Symptom Score), уровень ПСА в сыворотке не более 3,0–3,5 нг/мл, объем простаты при трансректальном ультразвуковом исследовании (ТрУЗИ) более 40 см3, максимальная объемная скорость мочеиспускания (Qmax) 7–15 мл/с при объеме мочеиспускания не менее 150 мл, объем остаточной мочи не более 100 мл, наличие подписанного информированного согласия на участие в исследовании.
Критерии исключения: обострение инфекций мочевыводящих путей, нарушение функции почек, нейрогенный характер нарушений мочеиспускания, злокачественные новообразования мочевыводящих путей и предстательной железы, наличие показаний к оперативному лечению ДГПЖ.
Все пациенты были распределены в 2 группы. Первую группу составили 30 пациентов в возрасте от 49 до 70 лет (средний возраст 61,1±2,3 года), 12 пациентов из 1-й группы имели сопутствующую патологию в стадии компенсации (гипертоническая болезнь, ишемическая болезнь сердца, сахарный диабет 2 типа), в связи с чем пациенты принимали ранее рекомендованные соответствующими специалистами препараты. В 1-й группе больным была назначена комбинированная терапия с применением α-адреноблокатора тамсулозина (0,4 мг однократно в сутки) и фитопрепарата Пермиксон (по 1 капсуле, содержащей 160 мг активного вещества, 2 р/сут), оба препарата курсом 6 мес.
Вторую группу составили 28 пациентов в возрасте от 48 до 68 лет (средний возраст 59,9±2,7 года), из них 10 пациентов имели сопутствующую патологию в стадии компенсации (гипертоническая болезнь, ишемическая болезнь сердца), получали соответствующее постоянное лечение. Все пациенты данной группы получали монотерапию препаратом тамсулозин (0,4 мг однократно в сутки) также в течение 6 мес. Всем пациентам проводили: комплексное урологическое обследование, включавшее оценку симптомов в баллах по шкале IPSS; лабораторные исследования (биохимический анализ крови, анализ крови на ПСА, общий анализ мочи); инструментальные исследования (урофлоуметрию, ТрУЗИ предстательной железы и УЗИ мочевого пузыря с определением объема остаточной мочи, УЗИ почек).
Ультразвуковое исследование проводили с использованием современной ультразвуковой системы премиум-класса Philips EPIQ 5. Аппарат УЗИ Philips EPIQ 5 работает с 19 датчиками различного назначения: конвексными, линейными, секторными, чреспищеводными, объемными — все они поддерживают дуплексные и триплексные режимы.
Эндоскопическое исследование проводилось прежде всего с целью исключения органического поражения уретры или мочевого пузыря.
Для исследования системы микроциркуляции предстательной железы у мужчин с ДГПЖ был применен метод лазерной допплеровской флоуметрии (ЛДФ), который позволяет выделить преобладание того или иного активного фактора контроля системы микроциркуляции. С этой целью был использован лазерный анализатор микроциркуляции крови ЛАКК-02 (НПП «ЛАЗМА», Россия), состоящий из двух излучателей для зондирования ткани в видимой красной области спектра излучения и в инфракрасной области, фотоприемного устройства и световодных зондов-датчиков, сконструированных для работы в жидкой среде. В качестве излучателя используется гелий-неоновый лазер типа ЛГН-207Б или ЛГН-208Б с длиной волны 0,63 мкм. Мощность лазерного излучения на входе светового кабеля составляет не менее 0,5 мВт.
Обследование пациентов проводили до лечения и через 3 и 6 мес. после начала лечения. Переносимость терапии оценивали по частоте и выраженности локальных и/или системных нежелательных явлений.
Обработка полученных данных проводилась методом статистического анализа на основе проверки нормальности распределения количественных признаков с помощью оценки коэффициентов асимметрии и эксцесса выборки и критерия Пирсона χ2; проверка равенства дисперсий с помощью критериев Фишера и Кохрена. Величина р определялась с точностью до 3-го знака после запятой, для обработки полученных данных использовалась компьютерная программа Statistica 6.0. Критическое значение уровня значимости принималось равным 5% (р≤0,05).
Всем пациентам проводилось лечение с использованием тамсулозина, что сопровождалось улучшением основных клинических показателей течения заболевания. Исходно обе группы пациентов по основным показателям были однородны. Максимальная скорость мочеиспускания, объем остаточной мочи, оценка по шкале IPSS и объем предстательной железы у пациентов из обеих групп статистически значимо не различались. При межгрупповом сравнении более выраженная положительная динамика уже через 3 мес. от начала лечения отмечена у пациентов 1-й группы (табл. 1).
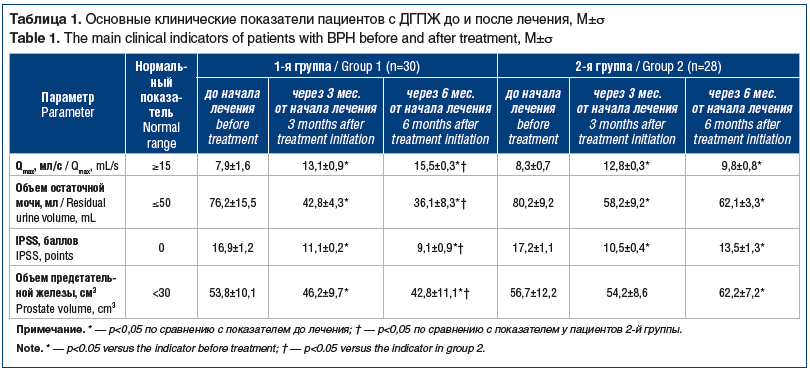
При межгрупповом сравнении через 6 мес. лечения средние показатели скорости потока мочи по сравнению с исходными у пациентов 1-й группы увеличились почти в 2 раза, а во 2-й группе — только на 18% (p<0,05). Отмечено снижение объема остаточной мочи у пациентов 1-й и 2-й групп соответственно на 52,6% и 22,6% (p<0,05), суммы баллов по шкале IPSS уменьшились соответственно на 46,1% и 21,5% (p<0,05). При этом не выявлено значимой динамики в объеме предстательной железы во 2-й группе в первые 3 мес. терапии, а спустя 6 мес., наоборот, отмечен рост среднего объема предстательной железы на 8,8%. В 1-й группе с комбинированной терапией, напротив, отмечена положительная динамика в объеме предстательной железы за 6 мес. терапии объем уменьшился примерно на 20%.
Ведущей причиной ДГПЖ является усиление метаболизма тестостерона в его активный метаболит дигидротестостерон, что влечет за собой пролиферацию клеток соединительной ткани предстательной железы. Ряд гормональных процессов — ароматизация тестостерона и андростендиола — способствуют увеличению синтеза эстрогенов в мужском организме, последние и приводят к усилению пролиферации фибробластов и нарушению метаболических процессов в предстательной железе [35]. Наличие воспалительного процесса регистрируется фактически в 80–100% случаев гистологического анализа тканей простаты [36]. Таким образом, антиандрогенные, противовоспалительные, антипролиферативные свойства препарата Пермиксон обусловливают применение его у пациентов с СНМП на фоне ДГПЖ [37].
В ходе исследования мы проводили оценку микроциркуляции предстательной железы методом ЛДФ. При этом микроциркуляцию исследовали в слизистой оболочке шейки мочевого пузыря и простатического отдела уретры у 33 из 58 пациентов, принявших участие в исследовании (15 пациентов из 1-й группы и 18 пациентов из 2-й группы). При ЛДФ шейки мочевого пузыря и простатического отдела уретры у пациентов обеих групп получены данные, указывающие на достоверное снижение капиллярного кровотока в тканях на фоне ДГПЖ до лечения, отмечено падение перфузии тканей в простатическом отделе, а также сатурации кислорода. Анализ ЛДФ-грамм показал преобладание влияния симпатической нервной системы, чем объясняется спазм сосудов микроциркуляторного русла в предстательной железе и снижение амплитуд осцилляций кровотока в нейрогенном диапазоне (0,02–0,052 Гц). Миогенный компонент сосудистого тонуса микроциркуляторного русла шейки мочевого пузыря, обусловленный состоянием гладкомышечных структур сосудов, остается неизменным (диапазон 0,07–0,15 Гц). Преобладание действия симпатической нервной системы, которое обусловливает сосудистую вазоконстрикцию, влечет за собой резкое снижение насыщенности кислородом тканей предстательной железы. Таким образом, выявленные расстройства гемодинамики на уровне микроциркуляторного русла, а также венозный застой создают условия для дальнейшей патологической пролиферации тканей предстательной железы [38].
Межгрупповая сравнительная характеристика нарушений микроциркуляции в шейке мочевого пузыря и простатическом отделе уретры при ДГПЖ указывает на статистически значимое сохранение микроциркуляторных нарушений у пациентов 2-й группы на фоне монотерапии α-адреноблокатором как после 3 мес., так и после 6 мес. терапии, по сравнению с показателями у пациентов 1-й группы, где в комплексной терапии использовался фитопрепарат Пермиксон, обладающий положительным влиянием на микроциркуляцию (табл. 2). В то же время и у больных 2-й группы отмечена положительная динамика в характере кровоснабжения шейки мочевого пузыря и простатического отдела уретры по сравнению с исходными данными — видимо, за счет того, что блокада α1-адренорецепторов приводит к расслаблению детрузора в фазу наполнения и способствует частичному устранению ишемии ткани предстательной железы.
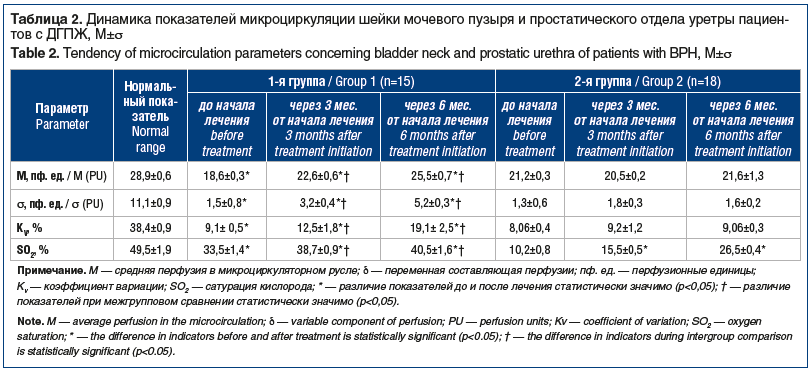
Таким образом, статистически значимая динамика показателей ЛДФ у пациентов 1-й группы по сравнению с исходными данными и результатами у пациентов 2-й группы свидетельствует о противовоспалительном механизме действия фитопрепарата Пермиксон, его положительном воздействии на микроциркуляцию тканей предстательной железы и шейки мочевого пузыря.
В целом результаты проведенного исследования свидетельствуют о клинической эффективности как монотерапии тамсулозином, так и комбинации тамсулозина и Пермиксона. При этом комбинированная терапия привела к более выраженной положительной динамике клинических проявлений ДГПЖ. У одного пациента 2-й группы отмечено небольшое снижение артериального давления на фоне монотерапии тамсулозином, что потребовало коррекции сопутствующей гипотензивной терапии, α-адреноблокатор пациент продолжил принимать. У двух пациентов 2-й группы отмечена ретроградная эякуляция, что также не потребовало отмены препарата. Переносимость исследуемого препарата была удовлетворительной, ни у одного пациента 1-й группы нежелательных явлений не отмечено.
Исследуемый препарат в сочетании с α-адреноблокатором оказывал положительный эффект за счет комплексного воздействия не только на клинические проявления СНМП при ДГПЖ, но и на параметры микроциркуляции в тканях простаты [39–42]. Приведем собственное клиническое наблюдение.
Клиническое наблюдение
На прием к урологу обратился мужчина, 51 год, с жалобами на учащенное мочеиспускание, незначительное ослабление струи мочи, ночные мочеиспускания до 3–4 раз. Считает себя больным в течение 3 лет, когда появились первые симптомы заболевания. На Визите 1 при пальцевом ректальном исследовании: железа значительно увеличена в размерах, однородная, безболезненная, эластической консистенции, междолевая борозда сглажена. По результатам имеющихся у пациента на момент визита в клинику лабораторных исследований: общий анализ мочи без воспалительных изменений, плотность мочи 1025 г/л, рН 6,5. Для оценки выраженности СНМП проведено анкетирование пациента: показатель по шкале IPSS равен 19 баллам. Пациенту были рекомендованы дополнительные исследования:
ПСА крови по фракциям с определением показателя свободного ПСА через 7 дней после первичного осмотра.
Биохимический анализ крови для оценки функции почек.
УЗИ предстательной железы и мочевого пузыря, а также УЗИ почек для исключения гидронефроза.
Ведение дневника мочеиспускания для определения суточного и ночного диуреза.
Визит 2 проведен через 9 дней. Данные лабораторных исследований: ПСА 1,9 нг/мл, соотношение свободного ПСА к общему 24%.
Биохимический анализ крови: креатинин 84 мкмоль/л, мочевая кислота 315 мкмоль/л, мочевина 4,9 ммоль/л.
Инструментальная диагностика: ТрУЗИ предстательной железы и мочевого пузыря: объем железы 64 см3, стенки мочевого пузыря ровные, без патологических изменений; объем остаточной мочи 30 мл; гидронефроз по результатам УЗИ почек не выявлен, камни в чашечно-лоханочной системе не определяются.
Урофлоуметрия: максимальная скорость мочеиспускания 13,8 мл/с. Данные дневника мочеиспускания: 9–10 мочеиспусканий, выпитое соответствует выделенному.
На основании анамнеза, осмотра пациента, данных инструментальной и лабораторной диагностики был установлен диагноз «N40 Гиперплазия предстательной железы». Учитывая отсутствие показаний к оперативному лечению, увеличенный объем предстательной железы по результатам ТрУЗИ, отсутствие выраженной обструктивной симптоматики, принято решение проводить консервативное лечение. Так как пациент сексуально активен, для исключения побочных эффектов, в том числе ретроградной эякуляции, назначен препарат на растительной основе Пермиксон по схеме: по 1 капсуле, содержащей 160 мг активного вещества, 2 р/сут, курсом 6 мес. [43]. Учитывая выраженность СНМП на фоне гиперплазированной предстательной железы, также рекомендован α-адреноблокатор алфузозин (10 мг однократно в сутки) курсом 3 мес. Выбор в пользу алфузозина сделан в связи с желанием пациента сохранить эякуляторную функцию, а для данной группы α-адреноблокаторов ретроградная эякуляция не характерна. Повторный визит к урологу для сбора анамнеза, выявления нежелательных явлений был рекомендован через 3 мес.
Визит 3. Неблагоприятного действия препаратов не зарегистрировано. Пациент отметил уменьшение ирритативной симптоматики, показатель по шкале IPSS по результатам заполнения анкеты уменьшился до 12 баллов. Принято решение о прекращении приема алфузозина, прием фитопрепарата Пермиксон пациент продолжил в прежней дозе. Следующий визит назначен через 6 мес. от начала лечения для комплексного обследования.
Визит 4. По шкале IPSS наблюдается снижение показателя до 7 баллов. УЗИ: объем предстательной железы 42 см3, остаточная моча 0 мл. Максимальная скорость потока мочи увеличилась до 17,1 мл/с. Пациент удовлетворен проводимой терапией, отмечает улучшение сексуальной функции. Назначен следующий визит к урологу через 6 мес.
Заключение
В связи со сложностью патогенеза ДГПЖ в арсенале уролога имеется множество препаратов, направленных на купирование СНМП, ассоциированных с гиперплазией предстательной железы. Наступила эра успешного комбинирования в терапии ДГПЖ α-адреноблокаторов, ингибиторов 5α-редуктазы, М-холинолитиков и ряда других препаратов, в том числе растительных экстрактов. Расстройство микроциркуляции и тканевая энергетическая гипоксия органов малого таза являются важными факторами патогенеза ДГПЖ, а улучшение кровотока в тканях предстательной железы в ходе терапии можно считать патогенетически обоснованным у данной категории пациентов. Поэтому препараты, используемые для консервативной терапии ДГПЖ, должны обладать не только антипролиферативным и антиандрогенным, но и противовоспалительным действием, способностью улучшать состояние микроциркуляции в тканях предстательной железы. Согласно данным проведенного исследования, а также множества ранее проведенных исследований Пермиксон является эффективным препаратом с высоким профилем безопасности в рамках патогенетической терапии ДГПЖ, воздействующим на ряд факторов развития и прогрессирования этого заболевания. Он обладает антиандрогенным, противовоспалительным и антипролиферативным действием. Важно отметить, что за 40 лет применения препарата Пермиксон не было зарегистрировано серьезных побочных эффектов, требующих его отмены. Основываясь на данных об эффективности и безопасности препарата Пермиксон, его широко применяют у пациентов с СНМП умеренной степени выраженности на фоне ДГПЖ.
Сведения об авторе:
Нашивочникова Наталья Алексеевна — к.м.н., доцент кафедры урологии им. Е.В. Шахова ФГБОУ ВО «ПИМУ» Минздрава России; 603950, Россия, г. Нижний Новгород, пл. Минина и Пожарского, д. 10/1; ORCID iD 0000-0002-1138-1174.
Контактная информация: Нашивочникова Наталья Алексеевна, e-mail: dom17.doctor@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.02.2022.
Поступила после рецензирования 25.03.2022.
Принята в печать 19.04.2022.
About the author:
Natalia A. Nashivochnikova — C. Sc. (Med.), Associate Professor of the Department of Urology named after E.V. Shakhova, Privolzhski Research Medical University of the Ministry of Health of Russia; 10/1 Minin and Pozharsky square, Nizhny Novgorod, 603950, Russian Federation; ORCID ID 0000-0002-1138-1174.
Contact information: Natalia A. Nashivochnikova, e-mail: dom17.doctor@mail.ru.
Financial Disclosure: author has no financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 28.02.2022.
Revised 25.03.2022.
Accepted 19.04.2022.
.
Информация с rmj.ru






