Комплексный подход к диагностике и реабилитации больных с гастроинтестинальной формой диабетической автономной нейропатии
И.А. Курникова, Г.И. Климентьева, Т.Е. Чернышова
Ижевская государственная медицинская академия, ректор – д.м.н., проф., Н.С. Стрелков,
кафедра факультетской терапии с курсами гематологии и эндокринологии, зав. – д.м.н., проф., А.М. Корепанов,
кафедра врача общей практики с курсами иммунологии ФПК и ПП, зав. – д.м.н., проф. Л.Т. Пименов
Резюме. С целью оценки динамики секреторной и моторно-эвакуаторной функции верхнего отдела желудочно-кишечного тракта у 32 больных сахарным диабетом (СД) 1 типа с гастроинтестинальной формой диабетической автономной нейропатии и связи функционального состояния органов пищеварения с показателями вегетативного равновесия и возможности физической реабилитации было проведено комплексное обследование желудочно-кишечного тракта с оценкой состояния вегетативного равновесия по вариабельности сердечного ритма с вычислением индекса Кердо. Определение реабилитационных возможностей осуществлялось на базе морфо-физиологического индекса (патент № 2344751).
Комплексный подход к диагностике гастроинтестинальной формы диабетической нейропатии обеспечил раннее выявление данного осложнения СД, проведение дифференциальной диагностики с органическими заболеваниями органов пищеварения. Установлено, что преобладание парасимпатической активности сопровождалось гиперацидностью и ускоренной эвакуацией на уровне желудка и 12-перстной кишки и наблюдалось у больных с низким реабилитационным потенциалом. Эффективность реабилитации, включающей в себя традиционные схемы лечения заболеваний органов пищеварения, больных СД 1 типа с гастроинтестинальной формой диабетической нейропатии была значительно хуже, чем у больных с сохраненной вегетативной функцией желудочно-кишечного тракта.
Ключевые слова: сахарный диабет, диабетическая автономная нейропатия, гастросцинтиграфия, α-липоевая кислота.
Диабетическая нейропатия является частым осложнением сахарного диабета, при котором в патологический процесс вовлекаются различные отделы нервной системы, приводя к развитию соответствующих клинических проявлений [3,4]. В основе гастроинтестинальных нарушений при сахарном диабете лежит вегетативная дисфункция, связанная с прогрессированием автономной диабетической нейропатии [1,5]. Известно, что наибольшую опасность для жизни больного диабетом представляет кардиальная автономная нейропатия [7,8,11], однако, и другие проявления вегетативных нарушений при сахарном диабете (СД), оказывают значительное влияние на течение болезни. Развитие у больного гастроинтестинальной формы диабетической нейропатии меняет процессы переваривания и всасывания в желудочно-кишечном тракте, приводит к формированию патологических рефлюксов, дисфагии и диареи, что создает сложности в подборе инсулинотерапии и таблетированых лекарственных препаратов, снижает эффективность лечения и реабилитации этих больных [5,9,10].
Клинические проявления гастроинтестинальной формы диабетической нейропатии разнообразны, не всегда явно выражены, часто недооцениваются как самим больным, так и лечащим врачом, поэтому достаточно поздно диагностируются и редко подвергаются целенаправленной терапии. Клинические симптомы зависят от уровня поражения желудочно-кишечного тракта и проявляются дисфагией, гастропарезом, гипо- или гиперкинезией кишечника и желчного пузыря. Как правило, диагноз устанавливается, когда больных, на фоне потери массы тела, беспокоит тошнота и рвота [4,5,8], не обусловленная органическими нарушениями со стороны желудка и кишечника. Отдельной проблемой является диагностика вегетативной недостаточности желудочно-кишечного тракта у больных сахарным диабетом [5]. Как правило, это – «диагноз исключения», как и «синдром раздраженного кишечника» у больных без диабета. Методы, используемые для исследования вегетативных функций в желудочно-кишечной системе, основаны на изучении моторики желудочно-кишечного тракта, находящегося под контролем парасимпатического и симпатического отделов вегетативной нервной системы [2]. К методам определения состояния парасимпатического эфферентного пути относятся: исследование моторно-эвакуаторной функции и определение кислотности желудочного сока.
Цель: оценить динамику секреторной и моторно-эвакуаторной функции желудка у больных СД 1 типа с гастроинтестинальной формой диабетической автономной нейропатии и связь функционального состояния желудочно-кишечного тракта с показателями вегетативного равновесия и возможности физической реабилитации.
Материалы и методы
Было обследовано 32 больных СД 1 типа обоего пола в возрасте от 18 до 49 лет. У 18 больных давность диабета колебалась от 2 до 10 лет – 1-я группа, у 15 человек более 10 лет – 2-я группа. Основным критерием отбора больных для исследования было отсутствие жалоб и заболеваний со стороны желудочно-кишечного тракта, которые исключались путем проведения фиброгастроскопии (ФГС), ультразвукового исследования органов брюшной полости, проведением общеклинических и биохимических исследований крови, мочи и кала.
Методы исследования вегетативных функций в желудочно-кишечной системе. Моторно-эвакуаторная функция изучалась с помощью сцинтилляционной гаммы-камеры МВ-9200, оснащенной ЭВМ «Микросегамс» (Венгрия). Пробный завтрак включал 200 г сметаны + 150 г белого хлеба + радионуклидная метка (коллоидный раствор In113 с общей активностью 4-7 МВк.). Величина дозы облучения желудка – 0,7 mGy. Исследование проводилось в течение часа в положении лежа. Секреторная функция желудка изучалась с помощью интрагастральной рН-метрии (аппарат «АГМИ-01», «Исток-система», Фрязино, Московская область). Оценивали рН антрального отдела, тела желудка и нижней трети пищевода.
Методы оценки вегетативного равновесия и реабилитационных возможностей организма. Вычисление вегетативного индекса (ВИ) Кердо; определение базовой составляющей реабилитационного потенциала – морфо-физиологического индекса – МФИ (патент № 2344751 от 27.01.2009 г.).
Обработка данных производилась с помощью пакета программ STATISTICA 6,0 (Matematica®, Matlab®, Harvard Graphics®) американской фирмы StatSof (1995 г.). Базовыми методами статистического исследования были: линейная описательная статистика (Discriptive Statistics) с исчислением корреляции средних, стандартных отклонений (corrs/means/SD), t-критерия Стьюдента (t-test for independent samples), нелинейный метод множественной регрессии (Multiple Regression) и кластерный анализ (Claster Analisis). Количественные переменные в 2-х независимых группах сравнивались при нормальном типе распределения методом дисперсионного анализа ANOVA, при других формах распределения, применялся непараметрический метод с использованием U-критерия Манна-Уитни для двух групп сравнения или непараметрический метод Краскела-Уоллиса для трёх независимых групп. За уровень статистической значимости принимали р<0,05. Анализ корреляции переменных производился по методу Пирсона при нормальных распределениях и по методу Спирмена (ранговая корреляция) при других типах распределения.
Результаты и обсуждение.
У 50% больных 1 группы наблюдалась гиперсимпатикотония (табл. 1). Полученные результаты идеально совпадают с показателями скорости эвакуации пищи из желудка – замедленный тип эвакуации также наблюдался у 50% больных 1 группы (Т½=51,1±5,7 мин). Распределение больных по типу эвакуации (по данным гастросцинтиграфии) представлено в таблице 2.
Таблица 1. Распределение больных СД 1 по данным оценки вегетативного равновесия
| Группы наблюдения |
Вегетативный индекс Кердо |
||
|
ВИ=0 |
ВИ<0 |
ВИ>0 |
|
| 1 группа (n=18)
2 группа (n=15) |
6 (33,3%)
2 (13,3%) |
3 (16,7%)
8 (53,3%) |
9 (50%)
5 (33,4%) |
Графическое изображение, полученное при проведении динамической гастросцинтиграфии, представлено на рисунках 1-3 с отражением наиболее распространенных вариантов нарушений.
Таблица 2. Распределение больных СД 1 по данным оценки гастросцинтиграфии
|
Группы наблюдения |
Тип эвакуации пищи из желудка |
||
|
Ускоренный |
Замедленный |
Нормальный |
|
| 1 группа (n=18)
2 группа (n=15) |
7 (38,9%)
4 (26,7%) |
9 (50%)
11 (73,3%) |
2 (11,1%)
0 |
В первой группе у 38,9% больных наблюдался ускоренный тип эвакуации (Т½=31,8±4,5 мин), у 11,1% — нормальный (Т½=43,3±2,1мин). У больных 2 группы моторно-эвакуаторная функция желудка не соответствовала вегетативному тонусу сердечно-сосудистой системы, что свидетельствовало о грубом нарушении регуляторных процессов у больных с длительным течением сахарного диабета.
Во второй группе ускоренный тип эвакуации пищи из желудка (Т½=24,1±3,9 мин) с наличием желудочно-пищеводного рефлекса встречался у 26,7% и замедленный (Т½=73,4±6,3 мин) – у 73,3% больных. При эйтонии: у 2 (25%) – отмечена ускоренная эвакуация радиоактивной метки из желудка; у 6 (75%) больных – замедленная эвакуация радиоактивной метки из желудка.
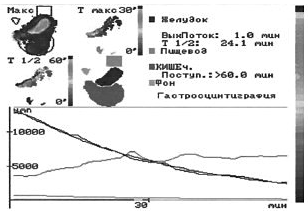
Рис. 1. Удовлетворительный тип опорожнения желудка, моторно-эвакуаторная функция близка к норме – Т½ 43,3 мин (норма 45 мин)
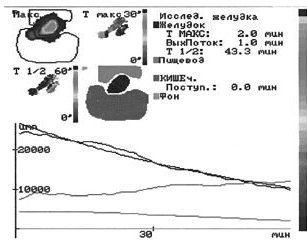
Рис. 2. Форма желудка «гипертоническая». Ускоренная эвакуация пробного завтрака из желудка, быстрое поступление пищи в 12-перстную кишку и быстрое продвижение меченого завтрака по тонкой кишке. Демпинг-синдром 2 ст

Рис. 3. Ортотоническая форма желудка, замедленная эвакуация пробного завтрака из желудка в кишечник (Т ½ 73,4 мин)
На втором этапе исследования все больные были распределены на две группы в зависимости от уровня компенсации сахарного диабета: 1-я группа (10 больных) – хорошая компенсация СД (Нв А1с ср. = 6,14±1,1%), 2-я группа (22 больных) – неудовлетворительная компенсация СД (НвА1с = 11,8±1,2%). При сравнении данных динамической гастросцинтиграфии в зависимости от уровня компенсации сахарного диабета не было получено достоверных различий (рис. 4): 1-я группа – Т½= 46,6±8,0 мин, 2-я группа – Т½= 44,1±6,4 мин. С увеличением продолжительности заболевания сахарным диабетом наблюдается тенденция к преобладанию гипертонической формы тонуса желудка. В то же время нами не было выявлено связи между выраженностью клинических проявлений гастроинтестинальной автономной нейропатии и уровнем компенсации углеводного обмена.
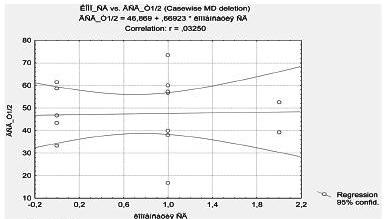
Рис. 4. Моторно-эвакуаторной функции желудка и компенсация сахарного диабета
При оценке желудочной секреции у больных с неудовлетворительной компенсацией СД чаще наблюдалось снижение секреторной функции желудка: рН тела желудка — 2,28±0,46, антрального отдела – 2,57±0,54. Желудочная секреция изменялась дифференцированно в зависимости от длительности сахарного диабета. В 1-й группе наблюдения рН тела желудка составила 1,2±0,32, во 2-й группе – 2,5±0,81.
Понижение секреторной функции желудка у больных сахарным диабетом связано, с одной стороны, с уменьшением содержания или отсутствием собственной продукции одного из физиологических стимуляторов желудочной секреции – инсулина, с другой – с развитием поздних осложнений сахарного диабета. Как показали, ранее опубликованные нами данные, при гистологических исследованиях биоптатов слизистой желудка у больных сахарным диабетом с явлениями гастроинтестинальной формы автономной нейропатии нарушается регуляции желудочной секреции со стороны n.vagus и выявляются характерные для «вагусных» нарушений изменения: исчезновение миелиновых и снижение количества немиелиновых волокон [11]. Несомненно, что в этом случае имеет место и микроангиопатия слизистой оболочки желудка, что приводит к уменьшению ее кровоснабжения, развитию дистрофически-атрофических изменений. Снижение секреторной функции сопровождалось ускоренной эвакуацией у 48% больных 1 группы, и у 80% – 2 группы. Наличие автономной нейропатии проявлялось дистрофически-атрофическим процессом в слизистой оболочке желудка и лабильным течением СД, что коррелировало с явлениями диабетической гастропатии (r=0,54, р<0,05) и нарушением метаболизма лекарственных препаратов.
По данным динамической рН-метрии выявлено прогрессирующее снижение кислотообразующей функции желудка, а по данным гастросцинтиграфии – снижение его эвакуаторной функции. Наиболее значимое снижение пропульсивной функции (выделение зон интереса при гастросцинтиграфии) отмечено в пилорическом отделе желудка. Эндоскопическая картина характеризовалась тенденцией к формированию атрофических изменений слизистой оболочки желудка. Частота регистрации эрозивно-язвенных дефектов слизистой оболочки желудка составила за первые 5 лет мониторинга 22,7%, за последующие 5 лет – 63,6%. По данным фиброгастроскопии, проведенной в 2003-2006 г., только в 7 случаях не было зарегистрировано эрозивно-язвенных дефектов слизистой оболочки. Функциональное состояние желудочно-кишечного тракта не зависело от компенсации СД, но выявило достаточный уровень корреляции со стажем диабета (табл. 3).
Таблица 3. Корреляционная матрица между функциональными нарушениями желудочно-кишечного тракта и давностью СД (r)
| Критерии |
Стаж СД |
ГСГ T 1/2 |
pH |
| Стаж СД | 1,0 | — 0,39 | — 0,44 |
| ГСГ Т1/2 | — 0,39 | 1,0 | 0,52 |
| pH | — 0,44 | 0,52 | 1,0 |
Также отмечено значительное взаимное влияние гастроинтестинальной формы диабетической нейропатии и биологической составляющей реабилитационного потенциала – МФИ (табл. 4).
Таблица 4. Корреляционная матрица основных показателей, характеризующих вегетативную функцию желудочно-кишечного тракта (r)
|
Критерии |
МФИ |
ГСГ Т 1/2 |
ВИ |
| МФИ | 1,0 | — 0,52 | — 0,29 |
| ГСГ Т 1/2 | — 0,52 | 1,0 | 0,08 |
| ВИ | — 0,29 | 0,08 | 1,0 |
Эффективность реабилитации больных СД 1 типа с гастроинтестинальной формой диабетической нейропатии была значительно хуже, чем у больных с сохраненной вегетативной функцией желудочно-кишечного тракта. Полученные данные подтверждены результатами кластерного анализа (рис. 5).
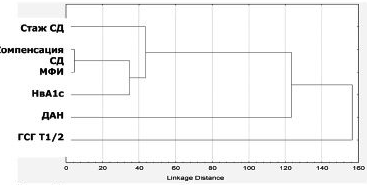
Рис. 5. Иерархическая диаграмма распределения статистически значимой взаимосвязи между МФИ и ГСГ Т 1/2 (кластерный анализ)
Таким образом, для диагностики гастроинтестинальной формы автономной диабетической нейропатии необходимо использовать комплексный подход, что позволяет провести дифференциальную диагностику с органическими заболеваниями органов желудочно-кишечного тракта и выявить данное осложнение СД на ранней стадии. Функциональные изменения желудочно-кишечного тракта у больных сахарным диабетом 1 типа не зависели от компенсации, но имели отрицательную корреляцию (r=-0,39, р<0,05) с давностью диабета. Отмечена прямая корреляция между стажем, лабильным течением СД и снижением секреторной функции желудка, вследствие диабетической автономной нейропатии. Установлено, что преобладание парасимпатической активности сопровождалось гиперацидностью и ускоренной эвакуацией на уровне желудка и двенадцатиперстной кишки и наблюдалось у больных с низким реабилитационным потенциалом. Морфофункциональное состояние желудочно-кишечного тракта необходимо учитывать при оценке возможности физической реабилитации больных СД 1 типа.
Литература
- Балаболкин М.И., Чернышова Т.Е., Трусов В.В., Гурьева И.В. Диабетическая нейропатия: патогенез, диагностика, классификация, прогностическое значение, лечение (учебно-методическое пособие). – М.: Экспертиза, 2003. – С. 3-105.
- Вегетативные расстройства: Клиника, диагностика, лечение / Под ред. А.М. Вейна. – М.: Медицинское информационное агентство, 2003. – 752 с.
- Кеттайл В.М., Арки Р.А. Патофизиология эндокринной системы. – М., 2001. – 536 с.
- Клинические рекомендации. Эндокринология / Под ред. И.И. Дедова, Г.А. Мельниченко. – М.: ГЭОТАР-Медиа, 2008. – 304 с.
- Строков И.А., Аметов С.А., Козлова Н.А., Галеев И.В. Клиника диабетической невропатии // Русский медицинский журнал. – 1998. – Т. 6. №12. – С.787-801.
- Чернышова Т.Е. и др. Этапы формирования диабетической гастропатии [Электронный ресурс] – Режим доступа: gastro.h12/nogr4.htm.
- DCCT Research Group. Te efect of intensive diabetes therapy on the development and progression of neuropathy // Ann Jntern Med. – 1995. – Vol. 122. – P.561-568.
- Kempler P. Neuropathies. Pathomechanism, clinical presentation, diagnosis, therapy / Ed. by P. Kemple — Springer. 2002. – 208 p.
- Packer L. Antioxidants in Diabetes Management / Eds. L. Packer, et al. – New York, 2000. – P.1-15.
- Sima A.A.F., Zhang W. , Sugimoto K., et al. C-peptide prevents and improves chronic Te I diabetic polyneuropathy in the BB/Wor rat // Diabetologia. – 2001. – Vol. 44. – P.45-67.
- Watkins P.J., Tomas P.K. Diabetes mellitus and the nervous system // J. Neurol. Neurosurg. Psychiatr. – 1998. – Vol. 65. – P.620-633.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru





