Введение
Синдром раздраженного кишечника (СРК) считается одним из самых часто встречаемых функциональных гастроинтестинальных расстройств в популяции, распространенность которого в отдельных регионах достигает 15% [1, 2]. На долю пациентов с СРК приходится около 20% всех обращений к специалистам за медицинской помощью [3]. Помимо негативного влияния на повседневную активность и качество жизни пациентов, заболевание является существенным экономическим бременем, ассоциированным с большими затратами на консультации, диагностические тесты, лекарственную терапию, а также со снижением производительности труда среди лиц молодого трудоспособного возраста.
Несмотря на высокую актуальность проблемы и растущее число исследований в этой области, для врачей первичного звена ведение пациентов с СРК по-прежнему представляет собой сложную клиническую задачу по нескольким причинам. Прежде всего, это связано с отсутствием «золотого стандарта» диагностики и строго регламентированных подходов к терапии заболевания. Специфичные клинические признаки и биомаркеры СРК до сих пор не определены, а диагностика полностью основана на оценке соответствия жалоб, предъявляемых пациентом, Римским критериям. При этом в Римских критериях IV пересмотра подчеркивается, что ряд органических заболеваний пищеварительного тракта могут протекать «под маской СРК», что требует тщательного сбора анамнеза, осмотра больного и проведения ограниченного круга лабораторных исследований, а также дополнительных лабораторно-инструментальных исследований, в том числе колоноскопии, при наличии симптомов тревоги («красных флажков»), таких как начало в пожилом возрасте, необъяснимое снижение массы тела, сохранение симптомов в ночные часы, лихорадка, гепатомегалия, спленомегалия, асцит, пальпируемые образования в брюшной полости, анемия, лейкоцитоз, увеличение скорости оседания эритроцитов, наличие крови в кале, отягощенный наследственный анамнез по колоректальному раку (КРР), воспалительным заболеваниям кишечника (ВЗК), целиакии и т. д. [4]. Российские эксперты настаивают на том, что целесообразно рассматривать диагноз СРК как диагноз исключения, поскольку на практике нередко ВЗК, микроскопические колиты и даже КРР протекают с СРК-подобными симптомами при отсутствии симптомов тревоги [5, 6].
Еще одной проблемой, связанной с СРК, является подбор рациональной терапии. В настоящее время в лечении пациентов применяется исключительно симптоматический подход, эффективность которого не превышает 30% [7, 8]. Особые трудности вызывают случаи среднетяжелого и тяжелого течения заболевания, требующие психотерапевтической коррекции, в том числе назначения антидепрессантов и нейролептиков.
Безусловно, в основе симптоматического подхода к ведению пациентов с СРК лежит недостаточное понимание патогенеза заболевания. Общепризнана «биопсихосоциальная модель», согласно которой на развитие СРК оказывают влияние генетика, факторы окружающей среды (инфекции, диета, социальное положение, культура, родительские убеждения), психоневрологические расстройства и изменения физиологии пищеварительного тракта (висцеральная гиперчувствительность, нарушение моторики, повышенная кишечная проницаемость, дисбиоз, воспаление низкой степени активности) [1, 2, 4, 5]. С клиническими проявлениями СРК также тесно связаны стресс и дисфункция вегетативной нервной системы [2, 9]. Показано, что активация гипоталамо-гипофизарно-надпочечниковой системы в ответ на воздействие различных физических или психологических раздражителей приводит к повышению уровня гормона кортизола, регулирующего реакцию на стресс, в том числе ноцицепцию и моторику на уровне толстой кишки [10, 11].
Огромное количество исследований последних лет сосредоточено на выявлении универсальных механизмов развития СРК и поиске таргетных молекул, воздействие на которые позволило бы повлиять на определенные патогенетические звенья. Одним из препаратов, относящихся к патогенетической терапии функциональных расстройств пищеварительного тракта, в том числе СРК, является отечественный препарат Колофорт® компании «МАТЕРИА МЕДИКА ХОЛДИНГ». Действующее вещество препарата представлено технологически обработанными (высокие разведения) аффинно очищенными антителами к человеческому фактору некроза опухоли-α (ФНО-α), к мозгоспецифическому белку S-100 и гистамину. В качестве вспомогательных веществ используются лактозы моногидрат, целлюлоза микрокристаллическая, магния стеарат. Препарат относится к фармакотерапевтической группе «спазмолитики в комбинации с психотропными препаратами» (код АТХ: А03С) [12]. В экспериментах in vitro и in vivo установлено, что активные компоненты препарата модифицируют взаимодействие ФНО-α, гистамина и белка S-100 с рецепторами путем влияния на экспрессию лиганда и/или активность рецептора. Как следствие, антитела к ФНО-α оказывают противовоспалительное действие [13], тогда как антитела к гистамину, помимо противовоспалительного, обладают спазмолитическим и противоотечным эффектами. Антитела к белку S-100 обеспечивают широкий спектр психотропной активности, в том числе анксиолитическую, антидепрессивную, антиастеническую и ноотропную [12]. Сочетанное действие активных компонентов в составе препарата обеспечивает нормализацию моторной функции, а также снижение висцеральной гиперчувствительности толстой кишки, что клинически проявляется уменьшением выраженности абдоминальной боли и восстановлением скорости транзита кишечного содержимого. Кроме того, прием препарата Колофорт® способствует купированию таких сопутствующих симптомов, как вздутие, тенезмы, императивные позывы на дефекацию, чувство неполного опорожнения кишечника, необходимость применения дополнительных усилий при акте дефекации и др.
Эффективность препарата была показана в ряде клинических исследований [14–16]. В июне 2021 г. Колофорт® вошел в клинические рекомендации по СРК, одобренные на заседании научно-практического совета Министерства здравоохранения Российской Федерации, как препарат для уменьшения абдоминальной боли, нормализации частоты стула и консистенции кала с уровнем убедительности рекомендаций С (уровень достоверности доказательств 3) [5]. Согласно указанным рекомендациям препарат может применяться как в виде монотерапии, так и в комбинации со спазмолитиками и другими лекарственными средствами. Курс лечения в среднем составляет 1–3 мес., при необходимости может быть пролонгирован до 6 мес. Повторный курс приема препарата возможен через 1–2 мес.
Цель исследования — оценить эффективность и безопасность применения препарата Колофорт® в терапии больных с СРК со среднетяжелым и легким течением заболевания.
Материал и методы
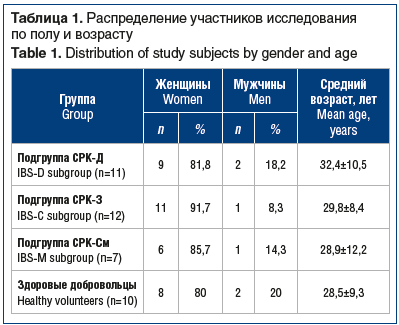
Проведено открытое когортное проспективное плацебо-контролируемое исследование с включением 30 пациентов в возрасте от 20 лет до 41 года (средний возраст 30,7±7,8 года) — 25 женщин (83,3%) и 5 мужчин (16,7%) с установленным диагнозом СРК, в соответствии с Римскими критериями IV пересмотра, а также клиническими рекомендациями Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России.
Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России. В зависимости от подтипа заболевания все пациенты основной группы были разделены на 3 подгруппы: СРК с преобладанием диареи (СРК-Д) — 11 (36,7%) человек, СРК с преобладанием запора (СРК-З) — 12 (40%), СРК со смешанным вариантом нарушения моторики (СРК-См) — 7 (23,3%). Контрольную группу составили 10 практически здоровых лиц, сопоставимых по полу и возрасту с пациентами с СРК. Легкое течение заболевания отмечалось у 14 (46,7%) пациентов, среднетяжелое — у 16 (53,3%).
Препарат Колофорт® назначался курсом на 12 нед. по 2 таблетки 2 р/сут. Всем пациентам до и после курса терапии проводилась оценка основных клинических симптомов СРК (абдоминальная боль, запор, диарея) с учетом их интенсивности по балльной системе, где 0 баллов — симптом отсутствует, 1 балл — слабо выражен, 2 балла — умеренно выражен, 3 балла — выражен в значительной степени. Для оценки выраженности тревоги и депрессии использовалась госпитальная шкала тревоги и депрессии HADS (The hospital Anxiety and Depression Scale), разработанная A.S. Zigmond, R.P. Snaith для первичного выявления депрессии и тревоги в условиях общемедицинской практики. Шкала состоит из 2 частей (тревога — HADS-A и депрессия — HADS-В) по 7 утверждений, каждому из которых соответствуют 4 варианта ответов. При общей сумме баллов по какой-либо из частей шкалы от 0 до 7 делался вывод об отсутствии достоверно выраженных симптомов тревоги или депрессии, от 8 до 10 — о субклинически выраженных признаках тревоги или депрессии, 11 баллов и более — о наличии клинически выраженной тревоги или депрессии.
Уровень специфической тревоги в отношении гастроинтестинальных симптомов при СРК определялся с помощью индекса висцеральной чувствительности VSI (Visceral Sensitivity Index), предложенного J. Labus et al. [17, 18]. Опросник VSI содержит 15 утверждений, к которым предлагается несколько ответов в диапазоне от 1 («совершенно согласен») до 6 («совершенно не согласен»). Все ответы пересчитываются в баллы от 0 до 5. Итоговая сумма баллов по опроснику варьирует от 0 до 75, где 0 баллов — отсутствие специфической тревоги, 75 — высокая степень тревоги по поводу гастроинтестинальных симптомов.
Качество жизни пациентов оценивалось по данным опросника IBS-QoL (Irritable Bowel Syndrome Quality of Life), состоящего из 34 утверждений, касающихся проявлений заболевания и степени их влияния на жизнь пациента за прошедший месяц [19]. Каждому утверждению соответствуют 5 вариантов ответов, оцениваемых от 1 до 5 баллов. Общая сумма баллов по опроснику трансформируется в шкалу от 0% до 100% по формуле:
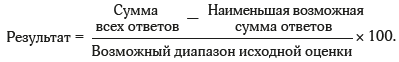
При этом чем выше показатель, тем лучше качество жизни.
Кроме того, всем пациентам дважды (до начала терапии и после ее завершения) проводилось исследование уровня кортизола в слюне методом иммуноферментного анализа с помощью тест-системы Cortisol Saliva ELISA (Diagnostics Biochem Canada Inc, Канада). Среднее значение показателя, по данным обследования 10 практически здоровых лиц, составило 18,86 [18,39; 22,58] нг/мл в утренние часы и 8,03 [6,38; 10,34] нг/мл — в вечерние.
Статистический анализ полученных данных проведен с использованием пакетов прикладных программ Microsoft Excel и Statistica v.6.1 (русифицированная версия). Для всех количественных признаков в сравниваемых группах проводилась оценка средних арифметических и стандартных ошибок среднего, а также медианы (Ме), 25-го и 75-го процентилей (Р25 и Р75 соответственно). Для сравнения двух независимых групп по количественным признакам использовали критерий Манна — Уитни (U), для сравнения двух зависимых групп — критерий Уилкоксона (H). Степень взаимосвязи между двумя переменными устанавливали методом корреляционного анализа Спирмена с определением коэффициента ранговой корреляции (rs). Результаты считались статистически значимыми при p<0,05.
Результаты и обсуждение
Распределение участников исследования по полу и возрасту приведено в таблице 1. При анализе полученных данных выявлен высокий уровень тревоги и депрессии среди пациентов с СРК. Так, признаки тревоги отмечались у 20 (66,7%) лиц, при этом у 7 (35%) из них суммарное количество баллов по HADS-A превышало 11, что свидетельствует о наличии клинически выраженной тревоги. Субклинические признаки депрессии определялись у 8 (26,7%) пациентов, еще у 3 (10%) отмечена клинически выраженная депрессия. Средняя сумма баллов по шкале HADS-A составила 8 [6,25; 10,25], по шкале HADS-D — 7 [6; 8,25]. Повышенная частота выявления тревожно-депрессивных расстройств среди пациентов с СРК показана в большом количестве исследований [20, 21]. Однако, учитывая двунаправленный характер связи «кишечник — мозг», до сих пор дискутабельным остается вопрос о том, что первично в дебюте заболевания — возникновение гастроинтестинальных симптомов или психоневрологических нарушений. Кроме того, признаки тревоги достоверно чаще выявлялись в подгруппе СРК-Д, тогда как депрессия была более характерна для пациентов с СРК-З. Выявленный факт также согласуется с имеющимися в современной литературе данными [20, 22]. При этом сумма баллов как по шкале HADS-A, так и по шкале HADS-D коррелировала со степенью тяжести СРК (rs=0,439, p<0,05 и rs=0,506, p<0,05 соответственно).
Известно, что для пациентов с СРК характерен феномен висцеральной гиперчувствительности. Такие больные имеют более низкий болевой порог (висцеральная гипералгезия) или повышенную чувствительность кишечника к непатологическим стимулам (аллодиния), что подтверждено исследованиями с применением баллонного теста [4]. Индекс висцеральной чувствительности VSI среди включенных в наше исследование пациентов с СРК составил 40 [34; 43,5] баллов. Висцеральная гиперчувствительность признана одним из ключевых патогенетических механизмов формирования абдоминальной боли при СРК [2, 23].
Вместе с тем при СРК наблюдается значительное снижение качества жизни. В проведенном нами исследовании суммарный показатель IBS-QoL в основной группе составил 64 балла.
Среднее значение уровня кортизола слюны по данным обследования 10 практически здоровых лиц составило 18,86 [18,39; 22,58] нг/мл в утренние часы и 8,03 [6,38; 10,34] нг/мл — в вечерние. При исследовании уровня кортизола в слюне больных СРК выявлено статистически значимое его повышение как в утренней порции, так и в вечерней по сравнению с показателями в контрольной группе (U=75,3, p<0,05 и U=40,6, p<0,05 соответственно). Аналогичные данные были получены и в других работах [9–11]. Секретируемый корой надпочечников гормон кортизол считается косвенным показателем активности симпатоадреналовой системы, в том числе в ответ на психологический стресс, являющийся важным патогенетическим фактором СРК [9]. Установлено, что кортизол стимулирует иммунный ответ по Th2-пути в слизистой оболочке толстой кишки, в результате чего в ней увеличивается количество тучных клеток [24, 25]. В свою очередь, высвобождающиеся в процессе дегрануляции тучных клеток гистамин, серотонин и протеазы вызывают возбуждение афферентных нейронов энтеральной нервной системы и развитие гастроинтестинальных симптомов при СРК [26–28]. При сравнении пациентов по группам оказалось, что наиболее высокий уровень утреннего и вечернего кортизола характерен для пациентов с СРК-Д.
Однако статистически значимые различия при попарном сравнении всех групп были получены только по показателю утреннего (базального) кортизола. При этом высокий уровень кортизола в утренней порции слюны в группе СРК-Д коррелировал с тяжелым течением заболевания (rs=0,674, p<0,05) и более низким качеством жизни по опроснику IBS-QoL (rs=0,501, p<0,05). Ранее было показано, что именно высокий уровень кортизола после пробуждения способствует развитию гастроинтестинальных симптомов при СРК, и эта связь реализуется только в условиях хронического психологического стресса [11]. Кроме того, среди пациентов с СРК-Д наблюдался и самый высокий показатель индекса VSI, который также был ассоциирован с уровнем кортизола в слюне, собранной в ранние утренние часы (rs=-0,583, p<0,05).
После 12 нед. терапии препаратом Колофорт® отмечено значительное уменьшение клинических проявлений заболевания — снижение выраженности абдоминальной боли (Н=38,54, p<0,05), запора (Н=62,17, p<0,05) и диареи (Н=74,86, p<0,05) среди всех включенных пациентов с СРК. К окончанию срока терапии нормализация стула была достигнута у 25 (83,3%) пациентов. Средняя сумма баллов по шкале HADS-A снизилась до 6 [5; 8], по шкале HADS-D — также до 6 [5; 7]. Число лиц с признаками тревоги сократилось до 10 (33,3%), с проявлениями депрессии — до 5 (16,7%). Кроме того, на фоне терапии отмечалось снижение висцеральной гиперчувствительности (Н=49,36, p<0,05) и повышение качества жизни (Н=49,36, p<0,05). Среднее значение индекса VSI через 12 нед. от начала терапии уменьшилось до 19 [18, 23, 26], оценка по опроснику IBS-QoL достигла 80 [77,25; 85,25]. Показано, что улучшение показателя по шкале IBS-QoL на 14% и более является клинически значимым эффектом терапии [29]. Аналогичная закономерность в виде повышения порога висцеральных болевых ощущений и качества жизни на фоне терапии сохранялась и при анализе данных показателей по группам в зависимости от подтипа заболевания (табл. 2).
![Таблица 2. Динамика суммарных показателей индексов висцеральной чувствительности VSI и качества жизни IBS-QoL до и после терапии препаратом Колофорт® среди участников исследования по группам, Ме [Р25; Р75] % Table 2. Dynamics of total indicators of the vi Таблица 2. Динамика суммарных показателей индексов висцеральной чувствительности VSI и качества жизни IBS-QoL до и после терапии препаратом Колофорт® среди участников исследования по группам, Ме [Р25; Р75] % Table 2. Dynamics of total indicators of the vi](https://medblog.su/wp-content/uploads/2021/10/1633126092_667_novye-podhody-k-vedeniyu-patsientov-s-sindromom-razdrazhennogo-kishechnika-livzan-m-a-gaus-o-v.png)
Подобные результаты были получены и в ряде других клинических исследований препарата [14–16]. Предполагается, что его анксиолитический и антидепрессивный эффекты опосредованы действием технологически обработанных антител к белку S-100, обладающим широким спектром психотропной активности.
Интересно, что терапия препаратом Колофорт® сопровождалась снижением уровня кортизола в слюне как в утренней порции, так и в вечерней. Безусловно, нормализация содержания кортизола отражает улучшение психоэмоционального фона и повышение стрессоустойчивости среди участников исследования, что является обязательным компонентом стратегии ведения пациентов с СРК. Предположительно данный эффект также может быть реализован за счет наличия технологически обработанных антител к белку S-100 в составе препарата. Динамика концентрации кортизола в слюне до и после терапии у пациентов с СРК по группам представлена в таблице 3.
Колофорт® продемонстрировал хорошую переносимость, что крайне важно для обеспечения высокой приверженности пациентов лечению [30]. На фоне терапии зарегистрировано 3 нежелательных явления: головная боль (n=2), тошнота (n=1), которые не потребовали отмены препарата.
Заключение
В проведенном нами открытом когортном проспективном контролируемом исследовании препарат Колофорт® продемонстрировал высокую клиническую эффективность в лечении пациентов с СРК со среднетяжелым и легким течением заболевания как в отношении основных гастроинтестинальных симптомов (уменьшение выраженности абдоминальной боли, нормализация стула), так и в отношении сопутствующих психоэмоциональных нарушений (снижение суммарного балла по шкалам HADS-A и HADS-D). Кроме того, прием препарата Колофорт® приводил к снижению уровня кортизола в слюне, что ассоциировалось с улучшением психоэмоционального фона, в первую очередь с устранением признаков тревоги, и снижением висцеральной гиперчувствительности. По завершении курса терапии отмечено статистически значимое повышение качества жизни. В целом хорошая эффективность и переносимость препарата обеспечили высокую приверженность пациентов лечению.
Благодарность
Редакция благодарит компанию ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ» за оказанную помощь в технической редактуре настоящей публикации.
Aknowledgement
The technical edition is supported by to NPF MATERIA MEDICA HOLDING LLC.
Сведения об авторах:
Ливзан Мария Анатольевна — д.м.н., профессор, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор; ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Гаус Ольга Владимировна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии, начальник управления по развитию регионального здравоохранения и медицинской деятельности; ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9370-4768.
Контактная информация: Гаус Ольга Владимировна, e-mail: gaus_olga@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.07.2021.
Поступила после рецензирования 04.08.2021.
Принята в печать 27.08.2021.
About the authors:
Maria A. Livzan — Dr. Sc. (Med.), Professor, Head of the Department of Faculty Therapy and Gastroenterology, Rector, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Olga V. Gaus — C. Sc. (Med.), Associate Professor of the Department of Faculty Therapy and Gastroenterology, Head of the Department for the Development of Regional Healthcare and Medical Activities, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768.
Contact information: Olga V. Gaus, e-mail: gaus_olga@bk.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 12.07.2021.
Revised 04.08.2021.
Accepted 27.08.2021.
.
Информация с rmj.ru





