Содержание статьи
Введение
Мозговой инсульт на сегодняшний день является одной из наиболее частых причин стойкой утраты трудоспособности и летальности. В соответствии с опубликованными в 2020 г. данными о наиболее распространенных причинах ограничения трудоспособноcти по показателю DALY (англ.: disability-adjusted life year — годы жизни, скорректированные по нетрудоспособности, т. е. бремя болезни) в перечне из 369 заболеваний на 5-м месте находится инсульт [1]. Несмотря на усилия, предпринимаемые обществом для сокращения бремени, связанного с инсультом, реализацию мер первичной и вторичной профилактики нарушений мозгового кровообращения и совершенствование методов восстановительного лечения, число пациентов и уровень материальных потерь во многих регионах не только не уменьшаются, а наоборот, увеличиваются. Так, согласно результатам исследования [1] за период с 1990 по 2009 г. по показателю DALY инсульт переместился с 5-го на 3-е место, притом что максимальный прирост наблюдался среди лиц трудоспособного возраста. В первую очередь указанная динамика касается государств с низким и умеренным уровнем дохода на душу населения и недостаточной эффективностью региональных систем оказания медицинской помощи [2]. Одной из наиболее частых форм острых нарушений мозгового кровообращения является ишемический инсульт (ИИ), который в европейских и североамериканских популяциях, а также в Российской Федерации встречается в 4–5 раз чаще геморрагического [3, 4].
Среди наиболее важных причин наступления летального исхода при ИИ следует отметить нарастающий отек и дислокацию головного мозга при обширном очаге поражения, тромбоэмболию легочной артерии, источником которой являются вены нижних конечностей и малого таза, острый коронарный синдром, а также воспалительные заболевания [5]. Среди широкого спектра воспалительных заболеваний, развивающихся в остром периоде ИИ, бронхолегочные инфекции являются наиболее частыми, особенно у пациентов, госпитализированных в изначально более тяжелом состоянии, с ранним угнетением сознания, нарушениями дыхания и глотания [6, 7]. Серьезную проблему представляют собой нарушения правил ведения пациента с ограниченными возможностями передвижения и самообслуживания, в особенности в домашних условиях, когда неправильное кормление (в частности, прием пищи в лежачем положении) и длительное пребывание в положении лежа с опущенным головным концом создают предпосылки для заброса содержимого ротовой полости в бронхиальное дерево и возникновения аспирационной пневмонии [8]. Ряд указанных причин бронхолегочных осложнений потенциально предупредимы, так как гигиенические мероприятия, в частности туалет ротовой полости, установка назогастрального зонда или гастростомы значительно снижают риск аспирации, а систематическое проведение лечебной (дыхательной) гимнастики снижает вероятность гипостатических явлений в легких [9]. Важными причинами пневмонии являются внутрибольничная инфекция, пребывание, особенно длительное, в условиях искусственной вентиляции легких.
Вместе с тем причины бронхолегочных осложнений у пациентов с ИИ не могут быть объяснены исключительно аспирацией или нарушением легочной вентиляции. На сегодняшний день важная роль в развитии пневмонии отводится нарушениям иммунитета (непосредственно связанным с поражением вещества головного мозга), системной и локальной воспалительной реакции организма на возникновение очага некроза (в т. ч. реакции нейровоспаления) [10–12]. Существенную роль в модуляции клеточного ответа на ишемическое повреждение играет реакция окислительного стресса [13]. В настоящее время такого рода пневмонию, возникшую у пациента с острым инсультом на протяжении первых 7 сут от момента развития заболевания, предложено рассматривать как инсульт-ассоциированную пневмонию (ИАП) [14]. Авторами предложено выделять подтвержденную ИАП — при подтверждении клинических критериев характерной рентгенологической картиной и вероятную ИАП, при которой клиническая картина не подтверждается результатами даже повторных рентгенологических исследований. Также авторы отмечают относительно невысокую ценность исследования количества в периферической крови лейкоцитов, концентрации С-реактивного белка (СРБ) и прокальцитонина.
Установлено, что развитие воспалительных осложнений у больного с ИИ ассоциировано с более высоким уровнем летальности, необходимостью более длительного пребывания на больничной койке, в т. ч. в отделении интенсивной терапии, повышением риска тромбозов различной локализации и повторного ИИ [9]. Развитие воспалительных осложнений также связано с высокими материальными затратами, включая стоимость лекарственных препаратов, лабораторно-инструментального обследования, более длительного пребывания в стационаре [15, 16]. Вместе с тем требует изучения влияние ИАП не только на течение острого периода ИИ, но и на ранние и отдаленные исходы заболевания.
Цель исследования: изучить влияние ИАП на исход ИИ в системе внутренней сонной артерии.
Материал и методы
Проведено проспективно-ретроспективное исследование. Протокол исследования одобрен локальным этическим комитетом.
Под наблюдением находились 87 человек, госпитализированных в отделение для лечения больных с острыми нарушениями мозгового кровообращения с подтвержденным диагнозом острого ИИ.
Критерии включения в исследование: острый нелакунарный ИИ; госпитализация в 1-е сут от момента развития ИИ; наличие очага ИИ, подтвержденного результатами рентгеновской компьютерной томографии (КТ) головного мозга. Критерии невключения в исследование: геморрагический инсульт; лакунарный ИИ; ИИ в вертебрально-базилярной системе; острое воспалительное/инфекционное заболевание, имевшее место до развития настоящего ИИ; системные заболевания с воспалительной реакцией; органические заболевания головного мозга (травматические, воспалительные, опухолевые).
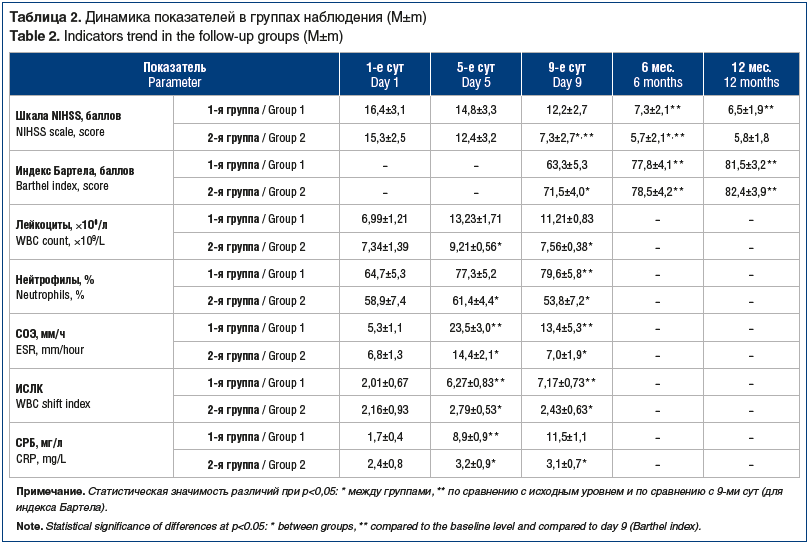
Оценивали тяжесть неврологического дефицита (Шкала инсульта Национального института здоровья США, NIHSS), уровень бодрствования (Шкала комы Глазго) при госпитализации, выраженность инвалидизации при выписке из стационара (индекс Бартела). Диагноз «ИИ» устанавливали на основании клинической картины, КТ головного мозга, ультразвуковой допплерографии вне- и внутричерепных артерий. Клинический диагноз «пневмония» подтверждали лабораторно-инструментальным обследованием (формула крови, СОЭ, концентрация СРБ в крови, рентгенография легких). Также рассчитывали индекс сдвига лейкоцитов крови (ИСЛК) по формуле: эозинофилы + нейтрофилы + базофилы / лимфоциты + моноциты. Ранее было показано, что повышение ИСЛК является надежным маркером воспаления (норма 1,96±0,56) [17]. Обследование проводилось в 1, 5 и 9-е сут после ИИ, а также через 6 мес. и 12 мес. после выписки из стационара.
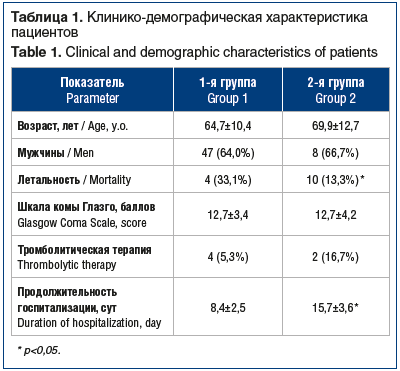
В 1-ю группу вошли 12 пациентов с ИАП (у 8 пациентов имела место подтвержденная ИАП и у 4 — вероятная ИАП), во 2-ю группу — 75 пациентов без воспалительных заболеваний бронхолегочной системы. Клинико-демографическая характеристика больных обеих групп представлена в таблице 1.
Статистическая обработка результатов выполнена с использованием параметрических критериев (нормальность распределения определялась при помощи критерия Колмогорова — Смирнова) с помощью программы SPSS 20.0; для изучения связи между независимыми переменными (связь случаев развития ИАП с потенциальными факторами риска) использовали коэффициент корреляции Пирсона (r). Статистически значимыми считали различия при p<0,05.
Результаты исследования
Исходно группы оказались сопоставимыми по основным демографическим показателям, выраженности неврологического дефицита и тяжести угнетения сознания по Шкале комы Глазго (табл. 2). Также не выявлено достоверных межгрупповых различий изучаемых лабораторных показателей. В 1-й группе 8 (66,7%) пациентов перенесли атеротромботический ИИ, 4 (33,3%) — кардиоэмболический, тогда как во 2-й группе 39 (52%) пациентов перенесли атеротромботический ИИ, 27 (36%) — кардиоэмболический и 9 (12%) — ИИ неуточненного патогенетического подтипа, т. е. в 1-й группе оказалось незначительно больше случаев атеротромботического ИИ (p>0,05).
За время пребывания в стационаре умерли 4 (33,1%) пациента в 1-й группе и 10 (13,3%) — в 2-й группе (p<0,05). Непосредственными причинами наступления летального исхода в обеих группах оказались нарастающий отек головного мозга, тромбоз вен таза и глубоких вен
голеней с тромбоэмболией легочной артерии, острый инфаркт миокарда, в 1-й группе, наряду с отмеченным выше, — системная воспалительная реакция и полиорганная недостаточность. Внутривенная тромболитическая терапия чаще проводилась в 1-й группе (2 и 4 пациента соответственно), различия не носили достоверного характера.
На фоне проведенного лечения у выживших пациентов обеих групп наблюдалась положительная динамика: восстановление уровня бодрствования, уменьшение выраженности неврологического дефицита (по шкале NIHSS). При этом выраженность и темпы регресса неврологического дефицита в обеих группах носили различный характер (табл. 2). У пациентов 2-й группы начиная с 5-х сут наблюдалось уменьшений показателей по шкале NIHSS, которое достигало достоверных различий к окончанию стационарного периода лечения, при этом у пациентов 1-й группы динамика носила менее выраженный характер, в связи с чем регистрировались различия при обследовании на 9-е сут.
Соответственно, значения индекса Бартела на 9-е сут у пациентов 1-й группы оказались ниже, чем во 2-й группе (p<0,05). В последующем, при обследовании через 6 мес. и 12 мес. между 1-й и 2-й группами отсутствовали различия в выраженности неврологического дефицита и способности к самообслуживанию.
Установлена связь между вероятностью развития ИАП и наличием нарушений глотания (r=0,672; p<0,05), возрастом больных (r=0,572; p<0,05) и наличием сахарного диабета (r=0,522; p<0,05).
Показатели клеточного состава периферической крови, значения СОЭ и СРБ были незначительно повышены на 5-е сут (различия не носили достоверного характера по сравнению с исходным уровнем) и нормализовались в последующем. При этом в 1-е сут различия показателей между группами отсутствовали. У пациентов 2-й группы при исследовании на 5-е сут имели место признаки воспалительной реакции, причем значения ИСЛК, СОЭ и СРБ достоверно отличались от исходных. На 9-е сут на фоне проводимой антибактериальной и противовоспалительной терапии указанные показатели демонстрировали тенденцию к снижению, однако превышали исходный уровень и были выше, чем у пациентов 1-й группы.
Обсуждение
На сегодняшний день связь воспалительных осложнений острого ИИ, с одной стороны, и увеличение сроков пребывания в стационаре и внутрибольничной летальности — с другой, убедительно доказана [7, 14]. В особенности велико влияние воспалительных осложнений на летальность и смертность и функциональное состояние больного в первые 3–6 мес. после ИИ [18, 19]. Более сложной представляется связь между осложнениями острого ИИ, в т. ч. ИАП, и отдаленными исходами заболевания. В частности, ряд исследователей отмечают, что сама по себе ИАП ассоциирована с худшим функциональным исходом ИИ, более высокой ранней летальностью, но не оказывает влияния на отдаленные исходы заболевания [16]. Вероятно, помимо более тяжелого и длительного течения острого периода ИИ, на выраженность последующей инвалидизации оказывает влияние отсроченное начало реабилитационных мероприятий, проведение которых невозможно у пациента с острым воспалительным заболеванием. Вместе с тем влияние осложнений острого периода ИИ, в т. ч. ИАП, на течение цереброваскулярной патологии по мере регресса воспалительного заболевания уменьшается. Соответственно, степень восстановления нарушенных функций, контроль риска повторных ИИ и иных сосудистых событий определяются другими факторами (локализация и объем первичного очага поражения, выраженность пареза, депрессивного расстройства, характер причины, которая привела к ИИ, и пр.).
Однако имеются свидетельства возможности отсроченного поражения мозгового вещества у пациентов, перенесших ИИ, осложненный воспалительными заболеваниями. Показано, что нарушение гематоэнцефалического барьера при остром ИИ обеспечивает возможность контакта нейроспецифических антигенов (белки нейронов и глии) с иммунокомпетентными клетками [20, 21]. Следствием этого является аутоиммунный процесс отсроченного поражения мозгового вещества, клинически способный проявляться нарастающими когнитивными расстройствами [22]. В частности, такой механизм рассматривается в качестве одной из возможных причин формирования постинсультной деменции [23]. В этой связи представляет интерес не только раннее выявление воспалительного заболевания, но и определение характера возбудителя, наличие которого связано с повышенным риском отсроченного поражения мозгового вещества.
Диагностика ИАП, учитывая не всегда четкую клиническую картину и отсутствие надежных клинико-лабораторных маркеров ранней диагностики, представляет собой серьезную проблему. Как вариант ее решения обсуждается возможность раннего превентивного назначения антибактериальной терапии пациентам с острым ИИ с высоким риском воспалительных осложнений [24, 25]. Учитывая многочисленные нежелательные побочные эффекты чрезмерно широкого применения антибиотиков, считаем более перспективным поиск ранних маркеров воспалительного процесса. В этой связи интерес вызывает оценка состава клеток белой крови в периферической крови в качестве надежного и недорогого диагностического теста [17]. Имеются данные об эффективности этого показателя как прогностического маркера исхода и ишемического, и геморрагического инсульта, что в определенной степени может отражать степень церебрального и внемозгового поражения [26].
Заключение
Полученные данные свидетельствуют о том, что развитие ИАП значительно осложняет течение острого периода ИИ, ассоциировано с более высокой летальностью и более выраженным неврологическим дефицитом на момент окончания стационарного периода лечения. Риск развития ИАП повышен у пациентов старшего возраста с нарушением глотания, страдающих сахарным диабетом. Вместе с тем в более позднем постинсультном периоде возможно достаточно полное восстановление нарушенных вследствие инсульта неврологических функций у пациентов, перенесших ИАП, при этом выраженность неврологического дефицита существенным образом не отличается от таковой у больных, не перенесших ИАП. Своевременная комплексная клиническая и лабораторно-инструментальная диагностика бронхолегочных осложнений способна обеспечить раннее выявление поражения нижних дыхательных путей, их своевременную профилактику, снижение риска развития пневмонии, проведение реабилитационных мероприятий в более полном объеме и тем самым улучшить ранние исходы ИИ.
Сведения об авторах:
Чипова Динара Туземовна — заведующая отделением общей неврологии ГБУЗ «ГКБ № 1»; 360000, Россия, г. Нальчик, ул. Головко, д. 7; ORCID iD 0000-0002-1641-3681.
Сантикова Лиана Владимировна — аспирант кафедры неврологии, психиатрии и наркологии Кабардино-Балкарского государственного университета им. Х.М. Бербекова; 360004, Россия, г. Нальчик, ул. Чернышевского, д. 173; ORCID iD 0000-0002-3361-6819.
Жемухов Аслан Черимович — аспирант кафедры неврологии, психиатрии и наркологии Кабардино-Балкарского государственного университета им. Х.М. Бербекова; 360004, Россия, г. Нальчик, ул. Чернышевского, д. 173; ORCID iD 0000-0002-8877-9965.
Контактная информация: Чипова Динара Туземовна, e-mail: dinara.chipova@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 03.09.2020, поступила после рецензирования 17.09.2020, принята в печать 01.10.2020.
About the authors:
Dinara T. Chipova — Head of the Department of General Neurology of City Clinical Hospital No. 1: 7, Golovko str., Nalchik, 360000, Russian Federation; ORCID iD 0000-0002-1641-3681.
Liana V. Santikova — post-graduate student of the Department of Neurology, Psychiatry and Narcology, Kabardino-Balkarian State University named after H.M. Berbekov; 173, Chernyshevskogo str., Nalchik, 360004, Russian Federation; ORCID iD 0000-0002-3361-6819.
Aslan Ch. Zhemukhov — post-graduate student of the Department of Neurology, Psychiatry and Narcology, Kabardino-Balkarian State University named after H.M. Berbekov; 173, Chernyshevskogo str., Nalchik, 360004, Russian Federation; ORCID iD 0000-0002-8877-9965.
Contact information: Dinara T. Chipova, e-mail: dinara.chipova@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 03.09.2020, revised 17.09.2020, accepted 01.10.2020.
.
Информация с rmj.ru


