Сахарный диабет, по данным Всемирной организации здравоохранения, является одним из четырех приоритетных неинфекционных заболеваний с высоким риском развития осложнений [1]. Сахарный диабет — один из основных факторов, обусловливающих раннее развитие и быстрое прогрессирование ангиопатии. Поражение артериального русла при сахарном диабете морфологически представляет собой атеросклероз, который, однако, имеет целый ряд отличительных особенностей: поражение носит более дистальный характер, наблюдается двусторонняя и множественная локализация стенозов, патологический процесс развивается в молодом возрасте, частота заболевания у мужчин и женщин сопоставима. В процесс также вовлекаются и сосуды, расположенные рядом с окклюзией. Это препятствует надежной компенсации ишемии тканей за счет нарушения функционирования коллатеральной сосудистой сети [2]. Кроме этого, сахарный диабет приводит к более раннему развитию, увеличению тяжести течения и видоизменению клинической картины таких заболеваний, как ишемическая болезнь сердца и цереброваскулярные заболевания.
Ишемический компонент в области нижних конечностей при сахарном диабете прогрессирует гораздо быстрее, вместе с тем боль при ходьбе возникает не всегда. Боли локализуются не в области голеней, а в области стоп. Эквивалентами болей при синдроме диабетической стопы (СДС) являются чувство слабости и утомление мышц голеней [2]. Кроме того, у ряда пациентов с СДС, подвергнутых артериальной реконструкции нижних конечностей, развивается реперфузионный синдром. Это совокупность осложнений, следующих за восстановлением кровотока в ранее ишемизированных органах и тканях [3]. Местная составляющая данного синдрома проявляется в виде постоперационного отека реваскуляризированной конечности, болевого синдрома, усугубления раневого процесса (расширения зоны трофических нарушений), недостаточности функций
конечности.
В настоящее время в диагностике и лечении пациентов с СДС выделяют целый ряд векторных проблем:
выбор оптимальных методов медицинской визуализации с определением дальнейшей тактики ведения;
формирование «дорожной карты» (технология получения информации о больном и решения вопроса о лечебной тактике);
способы общего и местного лечения, влияющего на все звенья патогенеза данной патологии, его этапность и своевременность.
К слабым сторонам комплексного медикаментозного лечения СДС относятся: недостаточная доказательность в отношении большинства препаратов; отсутствие общепринятых схем; низкая эффективность, особенно при критической ишемии нижних конечностей, и, как следствие, полипрагмазия.
С 01.01.2019 все медицинские учреждения Российской Федерации организуют свою работу согласно национальным клиническим рекомендациям [4]. Как только документ приобретает «рекомендательный характер», он сразу переходит под юрисдикцию правоохранительных органов. Проверкой и контролем выполнения рекомендаций и стандартов оказания медицинской помощи с 2019 г. занимается Следственный комитет РФ (из доклада д.м.н., академика РАН, директора ФГБУ «НМИЦ хирургии им. А.В. Вишневского» Минздрава России А.Ш. Ремишвили на Общероссийском хирургическом форуме, Москва, 2019). Таким образом, основаниями для привлечения к уголовной ответственности медицинских работников является ненадлежащее исполнение лицом своих профессиональных обязанностей, повлекшее причинение вреда здоровью или жизни. Под этим подразумевается нарушение установленных порядков, стандартов оказания медицинской помощи и действующих клинических рекомендаций.
Как показывают результаты судебно-медицинских экспертиз, при соблюдении стандартов и клинических рекомендаций эксперты зачастую прогнозируют вероятность благоприятных исходов. Вместе с тем врачебные ошибки, не связанные с нарушением порядков, стандартов и клинических рекомендаций, не являются основанием для уголовного преследования (из доклада заместителя руководителя Главного управления криминалистики Следственного комитета РФ, руководителя методико-криминалистического управления Следственного комитета РФ полковника юстиции А.И. Сазонова, 2019).
Таким образом, в разработке и практическом применении схем медикаментозной терапии основополагающим принципом является применение тех препаратов, которые включены в национальные клинические рекомендации и стандарты лечения.
В своей работе мы используем предложенную нами схему [5] диагностического и лечебного алгоритма для пациентов с СДС, при создании алгоритма руководствовались действующими клиническими рекомендациями. Разработанный нами единый лечебно-диагностический комплекс позволяет оперативно назначить своевременное лечение и избежать тяжелых необратимых последствий заболевания.
Неврологический дефицит определяем по тяжести диабетической периферической нейропатии в соответствии с общепринятой шкалой нейропатического дисфункционального счета (НДС). Рентгенографию стоп и нижних конечностей используем для верификации диабетической нейроостеоартропатии и склероза Менкеберга.
Для определения выраженности диабетической ангиопатии (оценка состояния кровотока и кислородотранспортной функции крови) исследуем пульсацию магистральных артерий путем пальпации, определяем уровень гликолизированного гемоглобина (HbA1c; гемоглобина, не обладающего кислородотранспортной функцией) и выполняем транскутанную пульсоксиметрию. Результаты транскутанной пульсоксиметрии сопоставляем с данными цветового дуплексного сканирования (ЦДС) артерий нижних конечностей.
При СДС сатурацию кислорода (SpО2) 90–92% и выше считаем нормальной. Эти данные получены нами эмпирическим путем. Одной из важнейших характеристик состояния сосудистого русла стоп при СДС является показатель насыщения кислородом артериальной крови, определяемый с помощью пульсоксиметра. Пульсоксиметрия основана на определении способности гемоглобина, связанного (НbО2) и не связанного с кислородом (Нb), абсорбировать свет различной длины волны. В норме показатель SpО2 равен или превышает 95% [6]. Данные пульсоксиметрии позволяют косвенно определить показатели парциального давления О2 крови (PaO2), которое в норме составляет 80–100 мм рт. ст. Уменьшение PaO2 сопровождается снижением SpO2: PaO2 80–100 мм рт. ст. соответствует 95–100% SpO2; PaO2 60 мм рт. ст. соответствует 90% SpO2; PaO2 40 мм рт. ст. соответствует 75% SpO2 [6].
После описанного выше диагностического этапа с учетом данных транскутанной пульоксиметрии мы разделяем всех больных на 4 когорты по следующим критериям:
Показатели мониторинга равны или ниже 90–92%, пальпаторно не определяется пульсация на магистральных артериях стоп (голеней). Такого больного направляем на консультацию ангиохирурга без дополнительного обследования для выбора дальнейшей тактики диагностики и лечения.
Показатели мониторинга равны или ниже 90–92%, но пульсация на магистральных артериях стоп (голеней) пальпаторно определяется. Такого пациента направляем на ЦДС артерий нижний конечностей. После этого при необходимости направляем на консультацию ангиохирурга. Подобная картина может соответствовать склерозу Менкеберга, этиологическим фактором развития которого является диабетическая нейропатия.
Показатели мониторинга равны или выше 90–92%, пульсация на магистральных артериях стоп (голеней) пальпаторно определяется. Это свидетельствует о нейротрофической форме СДС. Такого больного направляем на рентгенографию стоп при наличии дефектов кожи и мягких тканей и/или деформации стоп.
Показатели мониторинга равны или выше 90–92%, пульсация на магистральных артериях стоп (голеней) пальпаторно не определяется. Данная диагностическая картина характерна для атеросклеротического поражения артерий. Такого больного направляем на консультацию сосудистого хирурга с параллельным проведением ЦДС артерий нижних конечностей.
Основываясь на результатах исследований, проводим рентгенохирургические эндоваскулярные вмешательства и/или открытые реконструкции артерий нижних конечностей. Выбор методов коррекции поражений осуществляется индивидуально. Основной принцип проводимого лечения — использование органо- и тканесохраняющих методик.
С 2018 г. в схемы медикаментозной поддержки пациентов с СДС нами введен цилостазол. Этот дезагрегант согласно Кокрейновской базе данных систематических обзоров, включающей не менее 15 двойных слепых рандомизированных клинических исследований препарата, рекомендован к применению на практике, что связано с уменьшением выраженности симптомов перемежающейся хромоты. Прямое сравнение пентоксифиллина с цилостазолом показало, что последний в большей степени увеличивает дистанцию безболевой ходьбы (от 30% до 54%). Цилостазол является эффективным препаратом для уменьшения выраженности симптомов и увеличения дистанции ходьбы у пациентов с перемежающейся хромотой при отсутствии сердечной недостаточности (класс рекомендаций IIа, уровень доказательности А) [7]. В Международных рекомендациях по лечению хронической ишемии, угрожающей потерей конечности [8], указано, что цилостазол, ингибитор фосфодиэстеразы, обладает антитромбоцитарным и антипролиферативным действием. Результаты ряда исследований позволяют предположить, что цилостазол снижает риск рестеноза после катетерных вмешательств. Так, O. Iida et al. [9] провели открытое рандомизированное исследование, в которое вошло 200 пациентов, у 90% из которых имелась перемежающаяся хромота. Частота ангиографически подтвержденного рестеноза через 12 мес. после вмешательства на бедренно-подколенных артериях (ангиопластика с временным стентированием) в группе получавших цилостазол составила 20%, тогда как среди пациентов, не получавших цилостазол, — 49% (p=0,0001). Метаанализ исследований с включением 75% пациентов с хромотой также показал, что существует связь между применением цилостазола и сниженным риском развития рестеноза в стенте после стентирования бедренно-подколенных артерий у пациентов высокого
риска [10].
Кроме этого, цилостазол ингибирует экспрессию матриксной металлопротеиназы-9, являющейся одной из протеаз, связанных со снижением упругости стенки мелких сосудов, и одним из биохимических маркеров развития хронического раневого процесса при СДС [11, 12], и замедляет дегенерацию мелких проникающих артерий мозга у гипертензивных крыс [13]. Ретроспективный анализ, проведенный в 2013 г. в Калифорнии, обнаружил улучшение (на 20%) заживления ишемических некрозов при длительном приеме цилостазола [14].
Учитывая патогенез патологических изменений при СДС, ориентируясь на рекомендации экспертных групп по изучению сахарного диабета и национальные стандарты и клинические рекомендации оказания медицинской помощи пациентам с СДС, нами предложены и применяются две основные схемы поддерживающей медикаментозной терапии у данной группы больных на фоне гипогликемической терапии [15] и одна схема медикаментозной поддержки на амбулаторном этапе.
Содержание статьи
Схема № 1
Показания:
хроническая ишемия нижних конечностей стадии I, IIА, IIВ (по классификации Фонтейна — Лериша — Покровского) и клинические проявления диабетической полинейропатии при отсутствии показаний к реконструктивным операциям на артериях нижних конечностей.
Состав: 1) дезагреганты (цилостазол); 2) нейропротективные средства / препараты янтарной кислоты; 3) габапентины 300 мг + нестероидные противовоспалительные средства (НПВС); 4) антиагреганты (ацетилсалициловая кислота 100 мг/сут); 5) антикоагулянты (низкомолекулярные гепарины); 6) антибактериальные препараты с учетом чувствительности микрофлоры.
Схема № 2
Показания:
хроническая ишемия нижних конечностей стадии II–IV;
в периоперационном периоде у больных, подвергнутых реконструктивным сосудистым операциям на нижних конечностях (более выраженный клинический эффект получен при применении данной схемы в дооперационном периоде);
критическая ишемия в случае невозможности проведения хирургической сосудистой коррекции на артериях нижних конечностей.
Состав: 1) простагландины Е1; 2) нейропротективные средства; 3) тромболитики; 4) дезагреганты; 4) габапентины + НПВС; 5) трициклические антидепрессанты; 6) антикоагулянты (низкомолекулярные гепарины); 7) антибактериальные препараты с учетом чувствительности микрофлоры.
Схема медикаментозной поддержки на амбулаторном этапе (дневной стационар).
Состав: 1) дезагреганты при хронической ишемии нижних конечностей стадии IIА, IIБ без признаков хронической сердечной недостаточности, в периоперационном периоде при артериальной реконструкции в составе комплексной терапии; 2) нейропротективные препараты / препараты янтарной кислоты; 3) антикоагулянты; 4) НПВС; 5) миорелаксанты центрального действия; 6) статины всем пациентам с хроническими заболеваниями периферических артерий, диабетической нейро-остеоартропатией.
Нами проведено клиническое исследование влияния цилостазола на значимость клинических результатов у пациентов с хронической ишемией нижних конечностей стадии IIА, IIБ, дистальной сенсомоторной нейропатией, умеренно выраженной или выраженной согласно шкале НДС, и поражением тканей W1–W3.
В исследование были включены 155 пациентов с СДС, получавших лечение по технологии Центра диабетической стопы (г. Казань) с включением в схемы терапии цилостазола (основная группа, n=49) и без применения цилостазола (группа сравнения, n=106) за период 2018–2019 гг. Цилостазол (Плетакс®) применяли на этапе дневного стационара и/или амбулаторного ведения пациентов. Больные были распределены в две группы, репрезентативные по исходным параметрам (табл. 1).

В лечении пациентов обеих групп использовалась внедренная методика «step-by-step medical-surgical approach» [5], предусматривающая постоянное наблюдение пациента сотрудниками центра.
Клиническая значимость результатов исследования — основополагающий принцип оценки результатов лечения. Она определяется эффективностью и исходом лечения. Истинный клинический исход — это клиническое проявление, которое имеет существенное значение для пациента [16]. Косвенный критерий оценки — лабораторные показатели и/или симптомы, которые заменяют клинически значимый исход [17].
Для оценки результатов лечения использовали клинически значимую для пациента величину — благоприятный или неблагоприятный исход [16]. К благоприятным исходам относили: эпителизацию дефекта, купирование клинических симптомов. К неблагоприятным исходам: незаживление дефекта, осложнения, ампутацию на уровне стопы и выше, смерть пациента. Полученные данные исходов заносили в таблицу сопряженности (табл. 2).
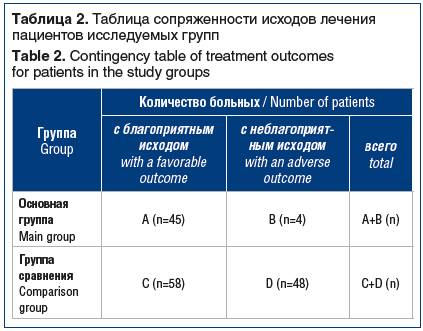
В основу интерпретации полученных клинических данных по исходам лечения заложена математическая модель [16, 17], в которой учитываются (по расчетным формулам) следующие показатели:
Относительная частота благоприятных исходов в основной группе: ЧБИОГ = А / (А+В) × 100%.
Относительная частота благоприятных исходов в группе сравнения: ЧБИГС = C / (C+D) ×100%.
Частота неблагоприятных исходов в основной группе: ЧНИОГ = В / (А+В).
Частота неблагоприятных исходов в группе сравнения: ЧНИГС = D / (C+D).
Снижение относительного риска исследуемых групп: СОРИГ = (ЧНИГС — ЧНИОГ) ×100%.
Повышение относительной пользы (ПОП) — этот показатель определялся как относительное увеличение частоты благоприятных исходов в основной группе по отношению к группе сравнения по формуле: ПОП = (ЧБИОГ — ЧБИГС) / ЧБИГС × 100%.
Число больных группы сравнения, которых необходимо лечить за определенное время, чтобы предотвратить один неблагоприятный исход: ЧБНЛ =
1 / САРИГ, где САРИГ — снижение абсолютного риска исследуемых групп.
При сравнении результатов лечения пациентов основной группы и группы сравнения по представленной модели с учетом значимых для самих пациентов исходов мы получили следующие данные.
Относительная частота благоприятных исходов в основной группе — 91%.
Относительная частота благоприятных исходов в группе сравнения — 56%.
Частота неблагоприятных исходов в основной группе — 0,09.
Частота неблагоприятных исходов в группе сравнения — 0,44.
Снижение относительного риска исследуемых групп — 35%, т. е. риск развития неблагоприятных исходов в основной группе на 35% ниже, чем в группе сравнения.
Повышение относительной пользы данной методики — 62,5%.
Число больных группы сравнения, которых необходимо лечить за определенное время, чтобы предотвратить один неблагоприятный исход, — 2,85.
Таким образом, полученные цифры и результаты сравнения наглядно доказывают преимущества применения цилостазола в составе комбинированных схем медикаментозной поддержки пациентов с СДС.
Благодарность
Редакция благодарит компанию ESKO PHARMA за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgment
Editorial Board is grateful to ESKO PHARMA for the assistance in technical edition of this publication.
Сведения об авторе:
Корейба Константин Александрович — к.м.н., доцент кафедры хирургическиx болезней, заведующий центром «Диабетическая стопа», ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, Республика Татарстан, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0002-0821-2249.
Контактная информация: Корейба Константин Александрович, e-mail: korejba_k@mail.ru. Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.09.2020, поступила после рецензирования 24.09.2020, принята в печать 08.10.2020.
About the author:
Konstantin A. Koreyba — Cand. of Sci. (Med.), Associate Professor of the Department of Surgical Diseases, Head of the «Diabetic Foot» Center, Kazan State Medical University: 49, Butlerova str., Republic of Tatarstan, Kazan, 420012, Russian Federation; ORCID iD 0000-0002-0821-2249.
Contact information: Konstantin A. Koreyba, e-mail: korejba_k@mail.ru. Financial Disclosure: the author has no financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.09.2020, revised 24.09.2020, accepted 08.10.2020.
.
Информация с rmj.ru





