Введение
Развитие острого инфаркта миокарда (ИМ) ежегодно регистрируется более чем у 7 млн человек на нашей планете [1, 2]. При этом согласно данным Всемирной организации здравоохранения уровень летальности в остром периоде заболевания несколько уменьшается с течением времени, преимущественно за счет снижения госпитального компонента [3]. По данным популяционного Регистра острого инфаркта миокарда, функционирующего в г. Томске с 1984 г., госпитальная летальность больных, находящихся в профильном стационаре с возможностью круглосуточного проведения инвазивной диагностики и интервенционных вмешательств, за последние 30 лет уменьшилась приблизительно на 6% (с 15% в 1984 г. до 8,9% в 2016 г.) [4]. Вместе с тем снижение смертности в остром периоде ИМ закономерно приводит к существенному увеличению числа людей, выживших после перенесенной коронарной катастрофы, которые составляют особую социально-медицинскую группу. В постинфарктном периоде сохраняется высокая летальность от ишемической болезни сердца (ИБС), достигая, по данным литературы, 15% в первый год и 35% в течение последующих 5 лет [5–8]. Важно отметить, что, помимо высокой вероятности летального исхода, в когорте постинфарктных больных не менее значимым оказывается и развитие тяжелых, зачастую жизнеугрожающих сердечно-сосудистых событий (ССС), таких как повторный ИМ, прогрессирование коронарной или сердечной недостаточности, возникновение нарушений ритма сердечной деятельности. Указанные события приводят к значительному снижению качества жизни пациентов, а также к повторным госпитализациям и дорогостоящему лечению [9, 10].
Оптимизация лечебно-профилактических мероприятий для пациентов, перенесших ИМ, важна в целях предотвращения неблагоприятных ССС, особенно у пациентов групп риска, нуждающихся в интенсивной медицинской помощи. При этом важно также обеспечить необходимую приверженность пациентов лечению. Согласно данным литературы наиболее доступными предикторами неблагоприятного течения постинфарктного периода являются следующие факторы: сохраняющаяся коронарная недостаточность в виде стенокардии напряжения высокого функционального класса или ишемических изменений сегмента ST при проведении нагрузочных проб; формирование гипертрофии левого желудочка; нарушение систолической и диастолической функции сердца; отсутствие контроля артериального давления и частоты сердечных сокращений; недостижение целевых показателей липидограммы. Существенное влияние оказывают также особенности применяемой медикаментозной терапии, ее соответствие современным рекомендациям [7, 11].
В настоящее время проблема приверженности лечению остается одной из самых актуальных в кардиологии. В ходе многочисленных исследований среди пациентов, перенесших ИМ, выявлена низкая приверженность лечению препаратами с доказанным влиянием на прогноз заболевания [12–15]. Низкая приверженность лекарственной терапии, согласно данным рандомизированных клинических исследований, ассоциирована с повышенным уровнем смертности больных высокого сердечно-сосудистого риска [16, 17].
Таким образом, поиск предикторов неблагоприятного течения постинфарктного периода является актуальной научной задачей. Высокая изменчивость большинства прогностических факторов дает возможность их коррекции с последующим улучшением течения и прогноза заболевания. Для обеспечения трансляции результатов научных исследований в рутинную клиническую практику предлагается разработка графических шкал-рискометров, позволяющих визуализировать потенциальный риск неблагоприятных событий и возможности его модификации.
Цель исследования: разработать графическую шкалу-рискометр неблагоприятных ССС в течение 5 лет
постинфарктного периода с учетом приверженности пациентов лечению.
Материал и методы
В работе представлены результаты анализа данных проспективного пятилетнего наблюдения за пациентами, выжившими после перенесенного ИМ (n=115, медиана времени наблюдения — 4 года и 9 мес.) и зарегистрированными в базе данных Регистра острого инфаркта миокарда (г. Томск). Анализировались следующие конечные точки: повторный ИМ, госпитализации по поводу обострения ИБС, прогрессирования хронической сердечной недостаточности (ХСН) и нарушения ритма сердца. В случае регистрации конечных точек в течение 5 лет после перенесенного ИМ клиническое течение постинфарктного периода считалось неблагоприятным (n=71). Группу сравнения составили пациенты без развития указанных ССС в постинфарктном периоде (n=44).
Используемый в качестве одного из предикторов неблагоприятного течения постинфарктного периода индекс V (индекс жизненной необходимости) является результатом фармакоэпидемиологического анализа жизненной необходимости назначаемых лекарственных препаратов [18, 19]. В настоящей работе использовался формализованный подход к делению медикаментозных средств на 2 группы по принципу доказанности их влияния на прогноз заболевания у пациентов, перенесших ИМ. Таким образом, индекс V присваивался лекарственным средствам четырех групп: антиагрегантам, β-адреноблокаторам, ингибиторам ангиотензинпревращающего фермента (или блокаторам рецепторов ангиотензина II в случае непереносимости последних), статинам. К группе N были отнесены остальные препараты, применяемые в лечении кардиологических больных: нитраты, диуретики, блокаторы кальциевых каналов, антикоагулянты, антиаритмические препараты, миокардиальные цитопротекторы.
Для изучения приверженности лечению больных, переживших пятилетний рубеж наблюдения после перенесенного ИМ, использовали тест Мориски — Грина, представляющий собой клинико-психологическую методику, предназначенную для скринингового выявления недостаточно комплаентных пациентов в клинической практике [20]. Тест состоит из четырех вопросов, оценивающих регулярность соблюдения режима приема препаратов, при этом каждый отрицательный ответ пациента оценивается в 1 балл, положительный — в 0 баллов. Приверженными лечению в настоящем исследовании считались больные, набравшие по результатам теста 3–4 балла. Пациенты, набравшие от 0 до 2 баллов, определялись как не приверженные лечению.
Статистическую обработку результатов проводили с использованием демоверсии программы SPSS Statistics Desktop, V.22.0 (компания IBM). Критический уровень значимости p при проверке статистических гипотез принят равным 0,05. Для построения математической модели прогнозирования и неблагоприятных ССС применяли многофакторный логистический регрессионный анализ (с использованием метода пошагового исключения переменных из модели). В качестве критерия согласия использовали процент правильной классификации, а также оценивали чувствительность и специфичность модели. Общую оценку согласия модели и реальных данных проводили с использованием теста согласия Хосмера — Лемешева. Качество модели оценивали также с помощью ROC-анализа с определением значения площади под ROC-кривой.
Результаты
Исследуемая когорта была представлена преимущественно мужчинами (60%). Средний возраст пациентов составил 62±10 лет. Женщины были старше мужчин приблизительно на 10 лет (р=0,001). Перенесенный в прошлом ИМ имелся у 16,5% пациентов, стенокардия напряжения до индексного коронарного события диагностирована у 56% пациентов, гипертоническая болезнь — у 80%. ХСН до индексного коронарного события встречалась у 34% пациентов, сахарный диабет 2 типа — у 22,6%, 46% пациентов курили.
В результате пятилетнего проспективного наблю-дения было установлено, что у 20% пациентов развился повторный ИМ, у 41% возникли нарушения ритма или проводимости сердца, 44% пациентов минимум 1 раз были госпитализированы в связи с прогрессированием ИБС, а 31% — в связи с прогрессированием сердечной недостаточности. Интервенционная и/или хирургическая реваскуляризация выполнена у 22%
постинфарктных больных.
Для поиска комплекса значимых предикторов развития неблагоприятных ССС в постинфарктном периоде в логистический регрессионный анализ включали все признаки, которые теоретически могли повлиять на клиническое течение постинфарктного периода: демографические показатели, анамнестические данные, коморбидный фон, клиническое течение острого ИМ и тактику ведения в остром периоде, объем поражения коронарного русла, характеристику медикаментозной терапии в острую фазу заболевания и в отдаленном постинфарктном периоде, данные фармакоэпидемиологического анализа, а также степень приверженности пациентов назначенному лечению.
В результате многомерной статистической обработки были определены предикторы неблагоприятного течения постинфарктного периода, которые в совокупности позволяют с точностью до 77% предсказывать высокую вероятность развития неблагоприятных ССС в течение 5 лет после перенесенного ИМ (чувствительность — 84%, специфичность — 66%) [21]. В число таких предикторов вошли: произведение удельного веса жизненно важных препаратов в общей структуре назначений (индекс V) на степень приверженности лечению, определяемую по результатам теста Мориски — Грина (р=0,04), наличие ХСН до развития острой коронарной катастрофы (р=0,001), отсутствие достижения целевых уровней систолического артериального давления через 1 год после ИМ (р=0,003), а также возраст 75 лет и старше на момент индексного ИМ (р=0,001) (табл. 1).

Таким образом, наличие ХСН, диагностированной до развития индексного ИМ, увеличивало шансы неблагоприятного течения постинфарктного периода в 9,5 раза. Отсутствие достижения целевых значений систолического артериального давления также неблагоприятно влияло на клиническое течение заболевания, увеличивая риск сердечно-сосудистых осложнений в 5 раз. Возраст пациента 75 лет и старше увеличивал вероятность неблагоприятного течения в 8,5 раза. Из всех вошедших в модель переменных единственным предиктором, благоприятно влияющим на течение постинфарктного периода, явился интегральный показатель, равный произведению удельного веса жизненно важных препаратов в общей структуре назначений на степень приверженности лечению. Этот показатель изменяется в диапазоне от 0 до 4 и, согласно полученным данным, уменьшает риск ССС на 61% на каждую единицу значения, т. е. при максимально высокой приверженности лечению и терапии, соответствующей рекомендациям, риск неблагоприятного течения снижается в 2,5 раза.
Качество математической модели было проверено с использованием ROC-анализа (рис. 1). Полученное значение площади под кривой составило 0,764 (95% доверительный интервал 0,67–0,86, p<0,001), что характеризует качество разработанной модели как хорошее. Условная граница, разделяющая больных на 2 группы (с благоприятным и неблагоприятным прогнозируемым течением постинфарктного периода), по результатам анализа ROC-кривой составила 0,6.
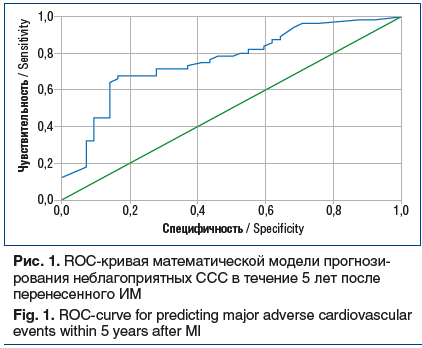
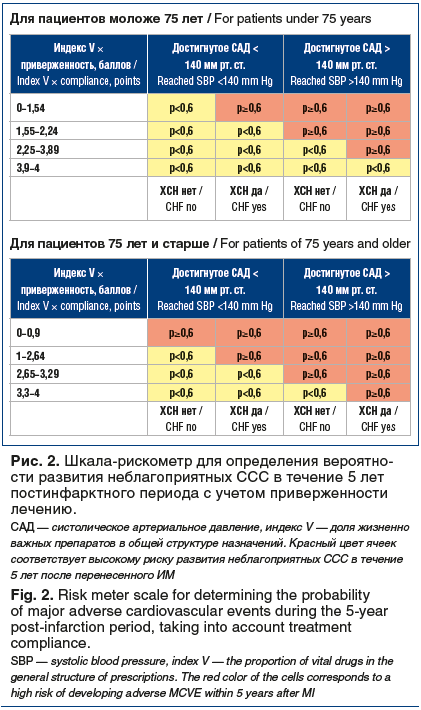
Посредством математических расчетов на заключительном этапе разработана графическая шкала-рискометр на основании математической модели (рис. 2). Представленная шкала позволяет вычислять риск развития неблагоприятных ССС в постинфарктном периоде при минимальных временных затратах и без использования специальных устройств (калькуляторов, компьютерных программ).
Обсуждение
В результате проведенного исследования на основании популяционного Регистра острого инфаркта миокарда установлен комплекс факторов, оказывающих значимое влияние на клиническое течение постинфарктного периода, включающий известные факторы риска сердечно-сосудистых осложнений, такие как сердечная недостаточность, старческий возраст, отсутствие достижения целевого артериального давления, особенности назначаемой медикаментозной терапии. Вместе с тем в шкалу-рискометр вошел такой показатель, как приверженность лечению, уровень которой определялся по опроснику Мориски — Грина. Таким образом, полученные результаты еще раз подчеркивают важность соблюдения врачебных рекомендаций пациентами, перенесшими ИМ. Согласно данным литературы приверженность лечению пациентов, страдающих хроническими неинфекционными заболеваниями, низкая, зачастую не достигающая 50% [12, 13]. В крупном метаанализе (более 350 тыс. пациентов, страдающих ИБС) приверженность лечению составила только 57% в течение 2 лет наблюдения, при этом приверженность пациентов, перенесших ИМ, была несколько выше и составила 66%, тогда как приверженность пациентов без перенесенной коронарной катастрофы составила 50% [14]. Необходимо отметить, что даже в крупных рандомизированных исследованиях фиксируется недостаточная приверженность пациентов лечению. Так, например, в исследовании CURE 46,2% пациентов прерывали прием клопидогрела в составе двойной антиагрегантной терапии более чем на 5 дней, а каждый пятый участник исследования прекратил прием препарата раньше времени [15].
Вместе с тем взаимосвязь приверженности лечению с клиническим течением ИБС находит свое подтверждение в работах отечественных и зарубежных ученых. В исследовании швейцарских ученых, включающем 4349 больных с ИМ, высокая степень приверженности назначенному лечению была ассоциирована со значимым снижением вероятности смертельного исхода в постинфарктном периоде [22]. Согласно собственным ранее опубликованным данным низкая приверженность лечению пациентов, перенесших ИМ, повышает риск развития повторного ИМ в 3 раза по сравнению с пациентами, приверженными лечению. Кроме этого, у пациентов, не приверженных лечению, в 2 раза чаще регистрируются различные виды нарушений сердечного ритма [23]. Вместе с тем повлиять на приверженность лечению крайне сложно, так как значительная часть постинфарктных больных ни при каких обстоятельствах не готовы принимать рекомендованные медикаментозные препараты. Для улучшения мотивации больных следует уделять время санитарно-просветительной работе, с предоставлением им информации о заболевании, о методах его лечения, о прогнозе и вероятности развития тяжелых сердечно-сосудистых осложнений [24–25]. В этом контексте раскрываются все преимущества предлагаемого способа прогнозирования неблагоприятных ССС с учетом приверженности лечению, так как даже во время амбулаторного приема пациенту может быть наглядно продемонстрировано прогнозируемое улучшение клинического течения ИБС в постинфарктном периоде при повышении приверженности лечению.
Заключение
Совокупность факторов, включающих: произведение удельного веса жизненно важных препаратов в общей структуре назначений (индекс V) на степень приверженности лечению, определяемой по результатам теста Мориски — Грина; хроническую сердечную недостаточность, диагностированную до развития острой коронарной катастрофы; отсутствие достижения целевых уровней систолического артериального давления через 1 год после ИМ; возраст
75 лет и более на момент индексного ИМ, — позволяет предсказывать развитие неблагоприятных ССС в течение 5 лет постинфарктного периода. При этом для обеспечения максимального удобства и наглядной визуализации прогнозируемого риска может быть использована представленная графическая шкала-рискометр.
Сведения об авторах:
Кужелева Елена Андреевна — к.м.н., научный сотрудник отделения патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск, ул. Киевская, д. 111а; ORCID iD 0000-0002-8070-2234.
Федюнина Вера Александровна — младший научный сотрудник отделения патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск, ул. Киевская, д. 111а.
Александренко Виктория Анатольевна — младший научный сотрудник отделения патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск,
ул. Киевская, д. 111а.
Кондратьев Михаил Юрьевич — врач-кардиолог отделения патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск, ул. Киевская, д. 111а.
Аптекарь Владимир Дмитриевич — д.м.н., заведующий отделением патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск, ул. Киевская, д. 111а.
Гарганеева Алла Анатольевна — д.м.н., профессор, руководитель отделения патологии миокарда НИИ кардиологии, Томский НИМЦ; 634012, Россия, г. Томск, ул. Киевская, д. 111а; ORCID iD 0000-0002-9488-6900.
Контактная информация: Кужелева Елена Андреевна, e-mail: snigireva1209@rambler.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 14.09.2020, поступила после рецензирования 28.09.2020, принята в печать 12.10.2020.
About the authors:
Elena A. Kuzheleva — Cand. of Sci. (Med.), Researcher of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation; ORCID iD 0000-0003-4019-3735.
Vera A. Fedyunina — Junior Researcher of the Department
of Myocardial Pathology, Research Institute of Cardiology
at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Victoria A. Alexandrenko — Junior Researcher of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Mikhail A. Kondratiev — cardiologist of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Vladimir A. Aptekar — Dr. of Sci. (Med.), Head of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Alla A. Garganeeva — Dr. of Sci. (Med.), Professor, Head of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation; ORCID iD 0000-0002-9488-6900.
Contact information: Elena A. Kuzheleva, e-mail: snigireva1209@rambler.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.09.2020, revised 28.09.2020, accepted 12.10.2020.
.
Информация с rmj.ru

