Содержание статьи
Опыт использования этанерцепта в лечении активного ювенильного идиопатического артрита
О. Ю. Конопелько
Е. С. Жолобова, доктор медицинских наук, профессор
О. С. Розвадовская
В. Я. Ельяшевич
М. Н. Николаева
УДКБ ГБОУ ВПО Первого МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Ювенильный идиопатический артрит (ЮИА) — это хроническое, тяжелое прогрессирующее заболевание детей и подростков с преимущественным поражением суставов неясной этиологии и сложным, аутоиммунным патогенезом, которое приводит к постепенной деструкции суставов, нередко сопровождается внесуставными проявлениями, нарушает рост и развитие ребенка, негативно влияет на качество всей жизни [1, 2]. До конца ХХ века прогноз ЮИА оставался мало предсказуемым, до 40% детей становились инвалидами, а системные, тяжелые формы заболевания иногда заканчивались летальным исходом. Лечение ЮИА зависит от формы и характера течения заболевания. Однако в любом случае сохраняется основной принцип: использование быстродействующих нестероидных противовоспалительных препаратов (НПВП) и базисных препаратов длительного действия. Особое место в лечении ЮИА занимают глюкокортикоиды (ГК), применяемые в настоящее время при системных формах заболевания преимущественно в виде парентерального введения. Согласно классификации, принятой Международной лигой по борьбе с ревматизмом ВОЗ в 1993 г., все противоревматические препараты подразделяются на симптом-модифицирующие, болезнь-модифицирующие и болезнь-контролирующие. К симптом-модифицирующим средствам относятся НПВП и глюкокортикоиды. К болезнь-модифицирующим средствам относятся базисные препараты: цитотоксические — метотрексат, циклофосфамид, хлорамбуцил; нецитотоксические — антималярийные препараты (Делагил, Плаквенил), сульфасалазин, Д-пеницилламин, соли золота [2, 3].
Полностью контролирующих болезнь препаратов до настоящего времени нет. Однако с 1994 года успешно используются биологические агенты, направленные на ключевые механизмы прогрессирования ревматоидного артрита (РА) — провоспалительные цитокины, в частности, на фактор некроза опухоли (ФНО-альфа). Преимуществом биологической терапии является максимальная избирательность воздействия, позволяющая нейтрализовать необходимое звено в патогенетической цепи, не затрагивая клетки других органов и систем. Появление генно-инженерных биологических препаратов существенно изменило прогноз и перспективы жизни больных с ревматическими заболеваниями [4]. Первым препаратом, зарегистрированным для лечения детей с ювенильным идиопатическим артритом, является этанерцепт (Энбрел). Препарат с 1998 года используется в США и в странах Европы для лечения РА, а с 1999 года — для лечения ЮИА. В нашей стране препарат зарегистрирован для лечения ювенильного идиопатического (ревматоидного) артрита у детей с 4-летнего возраста в 2009 году [1, 4]. Этанерцепт (Энбрел) — представляет собой синтезированный генно-инженерным методом растворимый рецептор к ФНО-альфа (содержит человеческий белок) и является конкурентным ингибитором ФНО-альфа и ФНО-бета. При проведении клинических испытаний препарат показал высокую эффективность и редкость возникновения побочных эффектов [5–10]. Этанерцепт отличается удобством введения — подкожно 1–2 раза в неделю, возможностью точного дозирования, редким развитием нежелательных явлений. Этанерцепт, в отличие от других ингибиторов ФНО-альфа, характеризуется отсутствием вторичной резистентности, что позволяет возобновлять терапию после прерывания, без увеличения риска побочных эффектов. Отмечен низкий риск активации туберкулеза на фоне длительного использования препарата этанерцепт. Высокая эффективность препарата у детей и практически отсутствие серьезных нежелательных явлений доказана в ходе рандомизационных клинических исследований и длительной реальной практики [5–10].
Целью настоящего исследования является оценка эффективности и безопасности лечения этанерцептом активного ЮИА.
Дизайн исследования: открытое нерандомизированное проспективное исследование.
Характеристика группы пациентов
К настоящему времени в детском ревматологическом отделении УДКБ Первого МГМУ им И. М. Сеченова (Москва) этанерцепт был назначен 57 пациентам, в том числе 18 пациентам с системной формой заболевания и 36 больным с преимущественно суставной формой, а также 3 больным с ювенильным спондилоартритом (ЮСА). Все дети до назначения этанерцепта получали иммуносупрессивные препараты. Метотрексат в дозе 10–15 мг/м2 в неделю получали все 100% детей, Сандиммун Неорал в качестве монотерапии или в сочетании с метотрексатом получали 20% пациентов, лефлуномид — 30%. Два и более препарата иммуносупрессивного действия последовательно получали в анамнезе 86%. У 34% использовались пероральные ГК. 100% детей в анамнезе получали пульс-терапию метилпреднизолоном и внутрисуставные введения ГК.
Назначение препарата этанерцепт проводилось после констатации неэффективности предшествующей стандартной противоревматической терапии по критериям Американской коллегии ревматологов (American College of Rheumatology, ACR) для педиатрических пациентов — ACR pedi и/или при сохранении высокой клинико-лабораторной активности. Подготовка к началу биологической терапии включала выявление и лечение хронических очагов инфекции, проведение реакции Манту и/или Диаскинтеста, компьютерной томографии грудной клетки, консультации фтизиатра о возможности использования ингибиторов ФНО-альфа. Первые 2–4 введения проводились в условиях отделения, в дальнейшем рекомендовалось продолжить лечение по месту жительства.
На момент настоящего анализа 30 детей получают терапию этанерцептом меньше 6 месяцев. В связи с этим оценку эффективности и безопасности лечения этанерцептом удалось провести у 27 больных.
Материал и методы. Исследование проводилось на базе второго ревматологического отделения УДКБ Первого МГМУ им. И. М. Сеченова.
Изучению была подвергнута информация о формах и вариантах течения ЮИА, возрасте, половой принадлежности больных, фармакологическом анамнезе.
Для оценки эффективности проводимой терапии использовались «педиатрические» критерии ACR 30%, 50%, 70% и 80% ответа на терапию — ACR pedi-30, 50, 70, 80. Критерии включают 6 показателей:
1) число «активных» суставов (из 75 суставов);
2) число суставов с ограничением функции (из 75 суставов);
3) значение СОЭ и/или С-реактивного белка (СРБ);
4) общая оценка активности болезни, по мнению врача (Визуально-аналоговая шкала — ВАШ);
5) оценка общего самочувствия (активности болезни), по мнению пациента или его родителей (Визуально-аналоговая шкала — ВАШ);
6) оценка функциональной способности с помощью Опросника по оценке общего состояния здоровья для педиатрических пациентов (Childhood Health Assesment Quesionnare — CHAQ).
При достижении ACR pedi-30 правомерно говорить об умеренно положительном результате проводимой терапии, ACR pedi-50 — о хорошем результате; ACR pedi-70 и 80 — об очень хорошем результате.
Критерии ACR pedi-30, 50, 70, 80 оценивались спустя 6 и 12 месяцев от начала терапии этанерцептом.
Препарат использовался в стандартной дозировке — 0,4 мг/кг массы тела дважды в неделю (доза вводилась дважды в неделю с интервалом 72–96 часов; максимальная доза на введение составляла 25 мг).
Оценка безопасности этанерцепта проводилась по клиническим признакам непереносимости (тошнота, головная боль, рвота, боли в животе, увеличение размеров печени); по лабораторным данным (изменения в клиническом анализе крови, клиническом анализе мочи, биохимическом анализе крови). Для исключения тубинфицирования проводилась рентгенография и/или компьютерная томография органов грудной клетки, реакция Манту и/или Диаскинтест.
Оценка эффективности и безопасности этанерцепта проводилась у 27 детей с ювенильным идиопатическим артритом. Из них 11 детей (40,7%) с системной формой ЮИА и 16 (59,3%) — с суставной.
Эффективность терапии в группе пациентов с системной формой ЮИА
В группе детей с системной формой ЮИА из 11 детей было 8 девочек, 3 мальчика, средний возраст составил 11,1 ± 3,3 года, дебют заболевания приходился на 3,2 ± 2,0 года, средняя продолжительность заболевания до назначения этанерцепта — 8,0 ± 3,1 года. В дебюте или в разгаре заболевания системные проявления, такие как лихорадка, лимфаденопатия, гепатоспленомегалия, сыпь, наблюдались у всех пациентов, реже — у 5 больных (45%) — выявлялся миоперикардит. К моменту назначения терапии гепатоспленомегалия, лимфаденопатия, субфебрильная лихорадка наблюдались только у 2 (18%) пациентов. У остальных 9 пациентов (82%) внесуставные проявления отмечены не были. До назначения этанерцепта все дети были с высокой (III) степенью активности заболевания. СОЭ в среднем составляла 34 ± 14 мм/ч, СРБ — 6,0 ± 4,8 мг/дл (при норме до 0,8 мг/дл).
Количество активных суставов до терапии в среднем составляло 24,2 ± 15,6 сустава с ограничением подвижности — 32,5 ± 14.
Все дети до назначения этанерцепта получали массивную базисную иммуносупрессивную терапию двумя и более препаратами. Из них 9 детей (82%) в анамнезе получали ГК перорально, 11 (100%) — повторные курсы пульс-терапии метилпреднизолоном, внутрисуставные пункции с введением ГК. Все дети (100%) получали метотрексат в дозе 10–15 мг/м2 в неделю, 3 ребенка (27%) комбинацию метотрексата с лефлуномидом (Арава), 2 (18%) — комбинацию метотрексата с циклоспорином А (Сандиммун Неорал). У 6 детей (54,5%) с тяжелым течением системной формы ЮИА, по разрешению этического комитета, ранее был опыт использования инфликлимаба в течение 1–1,5 лет. У 2 детей препарат оказался неэффективным, у 4 развилась вторичная резистентность к проводимой терапии.
Учитывая неэффективность стандартной противоревматической терапии, а также отсутствие выраженных системных проявлений, наличие активного артрита и высокой лабораторной активности, было решено назначить терапию этанерцептом.
Спустя 6 месяцев от начала терапии этанерцептом в группе отмечалось значительное снижение количества активных суставов с 24,0 ± 15,6 до 13,5 ± 15,7 и суставов с ограничением функции с 32,5 ± 12 до 28,9 ± 19 (табл. 1).
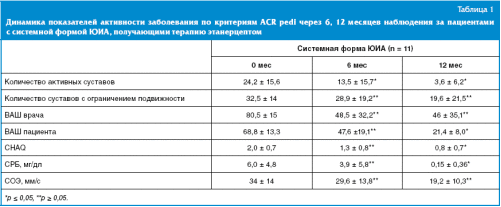
Также отмечалось снижение гуморальной активности у 4 пациентов, у остальных активность заболевания оставалась довольно высокой. Средние показатели СОЭ в динамике — 29,6 ± 13,8 (до терапии 34,4 ± 14) мм/ч, СРБ 4,0 ± 5,8 мг/дл (до терапии 6,0 ± 4,8).
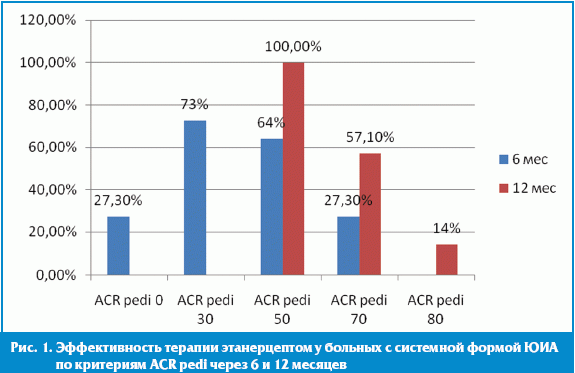
При комплексной оценке эффективности этанерцепта у детей с системной формой ЮИА, рефрактерной к стандартной противоревматической терапии, ACR pedi-30 был достигнут у 8 детей (73%), ACR pedi-50 — у 7 (64%), ACR pedi-70 — у 3 (27,3%).
Терапия этанерцептом оказалась неэффективной у 3 пациентов (36,5%). Эти пациенты с классической системной формой ЮИА ранее оказались «неответчиками» на терапию инфликсимабом (Ремикейд). В дальнейшем дети были переведены на терапию тоцилизумабом (Актемра).
Спустя 12 месяцев от начала терапии оценить эффективность проводимого лечения представляется возможным у 7 больных. Снижение гуморальной активности было выявлено у 5 детей. Средние показатели СОЭ снизились с 34 ± 14 до 19,2 ± 10,3 мм/ч (0 и 12 мес), СРБ — с 6,0 ± 4,8 до 0,15 ± 0,36 мг/дл (0 и 12 мес). Также отмечается снижение числа активных суставов с 24,0 ± 15,6 до 3,6 ± 6,2 (0 и 12 мес) и суставов с ограничением подвижности с 32,5 ± 14 до 19,6 ± 21,5 (0 и 12 мес).
У всех детей отмечено отсутствие прогрессирования эрозивных изменений в суставах по данным рентгенологического обследования, у одного ребенка отмечено исчезновение ранее выявленных эрозий.
При комплексной оценке спустя 12 месяцев в группе больных с системной формой ЮИА ACR pedi-50 достигнут у всех детей (100%), ACR pedi-70 — у 5 (57,1%), у одного ребенка — ACR pedi-80 (14%) (рис. 1).
У двоих детей прерывание терапии этанерцептом по месту жительства спровоцировало обострение заболевания, сопровождающееся внесуставными проявлениями. Возобновление терапии привело к стабилизации и улучшению состояния больных.
Эффективность терапии в группе с суставной формой ЮИА
В группе пациентов с суставной формой ЮИА из 16 детей 15 были девочки, 1 — мальчик, средний возраст составил 10,5 ± 4,1 года, дебют заболевания приходился на 4,3 ± 2,7 года, средняя продолжительность заболевания до назначения этанерцепта — 6,3 ± 3,8 года. Все дети были с высокой (III) степенью активности заболевания. Средняя величина СОЭ составила 28,3 ± 17,8 мм/ч, СРБ — 1,6 ± 2,5 мг/дл. Количество активных суставов до терапии в среднем составляло 10,5 ± 5,8 сустава с ограничением подвижности — 12,9 ± 14,6. Также как и в группе детей с системной формой ЮИА, все дети до назначения этанерцепта, в анамнезе получали 2 и более иммуносупрессивных препарата: 2 ребенка (15%) получали ГК перорально, все 16 детей (100%) — повторные курсы пульс-терапии метилпреднизолоном и/или внутрисуставные пункции с введением ГК, 100% получали метотрексат в дозе 10–15 мг/м2 в нед, 4 ребенка (31%) комбинацию метотрексата с лефлуномидом (Арава), 2 (15%) комбинацию с циклоспорином А (Сандиммун Неорал).
В связи с неэффективностью стандартной противоревматической терапии, наличием активного артрита и высокой лабораторной активности был назначен этанерцепт.
В группе с суставной формой ЮИА спустя 6 месяцев от начала проводимой терапии количество активных суставов уменьшилось с 10,5 ± 5,8 до 4,5 ± 4,7, а суставов с ограничением подвижности с 12,9 ± 14,6 до 7,3 ± 9,3. Снижение гуморальной активности зарегистрировано у 13 пациентов. Средний показатель уровня СОЭ и СРБ достоверно снизился: СОЭ с 28,3 ± 17,8 мм/ч до 12,6 ± 5,9 мм/ч, СРБ — с 1,6 ± 2,5 мг/дл до 0,06 ± 0,23 мг/дл (p ≤ 0,05) (табл. 2).

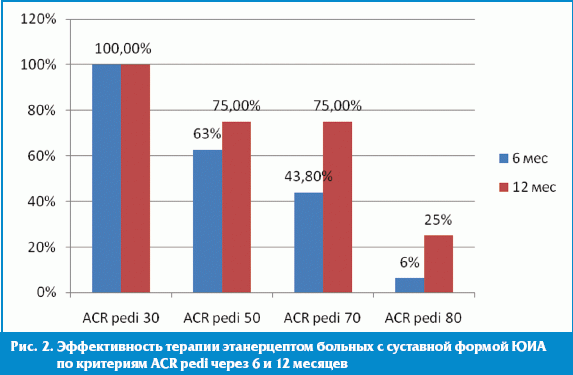
При комплексной оценке ACR pedi-30 был достигнут у 100% больных, ACR pedi-50 — у 10 (62,5%), ACR pedi-70 — у 7 (43,8%).
Спустя 12 месяцев от начала терапии оценить эффективность проводимого лечения представляется возможным только у 4 детей (завершили 12 месяцев лечения на данный момент). Число активных суставов снизилось с 10,5 ± 5,8 до 5,8 ± 7,2 (0 и 12 мес) и суставов с ограничением подвижности с 12,9 ± 14,6 до 10,3 ± 10,2 (0 и 12 мес). Средние показатели СОЭ снизились с 28,3 ± 17,8 до 12,6 ± 8,4 мм/ч (0 и 12 мес), СРБ — с 1,6 ± 2,5 до 0 мг/дл (0 и 12 мес).
В трех случаях, на фоне терапии этанерцептом, был достигнут очень хороший результат — активность заболевания снизилась до I–0 степени, у этих больных достигнуто 70% улучшение (ACR pedi-70) (рис. 2).
Введение препарата не вызывало побочных эффектов в виде серьезных бактериальных или вирусных инфекционных заболеваний. У двух отмечалась активация хронической герпетической инфекции. У трех детей введение этанерцепта сопровождались кратковременной местной реакцией в виде гиперемии и небольшой отечности в месте введения.
Заключение
Таким образом, лечение препаратом этанерцепт (Энбрел) оказалось эффективным у большинства больных с длительным стажем заболевания, высокой клинико-лабораторной активностью и торпидностью к стандартной противоревматической терапии. Наиболее эффективна терапия была у больных с суставной формой заболевания, где к 6?му месяцу лечения у всех 100% пациентов достигнуто улучшение как минимум по ACR pedi-30.
Эффективность терапии этанерцептом у больных с системными формами заболевания была менее выраженной. У 3 пациентов с системной формой ЮИА, ранее получавших терапию всеми возможными противоревматическими препаратами и их комбинациями, в том числе инфликсимабом (Ремикейд) без существенного эффекта, терапия этанерцептом также оказалась безуспешной. У больных с длительным течением системного ЮИА, преобладанием суставного синдрома к моменту назначения этанерцепта, был достигнут хороший эффект.
Прерывание терапии этанерцептом у больных с системной формой ЮИА угрожает развитием обострения, в том числе и с внесуставными проявлениями. При этом не увеличивается риск развития побочных эффектов при возобновлении терапии.
Лечение этанерцептом (Энбрел) не вызывает развития выраженных побочных эффектов, что позволяет подтвердить рекомендации по использованию этого препарата в случае ювенильного идиопатического артрита, торпидного к стандартной противоревматической терапии.
Литература
- Бзарова Т. М., Алексеева Е. И., Васильева С. И. и др. Безопасность применения ингибиторов факторов некроза опухоли альфа во взрослой и детской ревматологической практике // Вопросы современной педиатрии. 2010; 9 (1): 2–15.
- Жолобова Е. С., Чебышева С. Н., Геппе Н. А., Ельяшевич В. Я. и др. Клинико-рентгенологическая динамика у пациента с системной формой ювенильного ревматоидного артрита на терапии этанерцептом // Лечащий Врач. 2011; 4: 83–85.
- Никишина И. П. Растворимые рецепторы к фактору некроза опухоли (этанерцепт) в терапии ювенильного артрита // Русский медицинский журнал. 2009; 17 (3): 2–7.
- Beutler B. A. The role of tumor necrosis factor in health and disease // J Rheumatol Suppl. 1999; 57: 16–21.
- Lovell D. J., Giannini E. H., Reiff A. et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis // N. Engl. J. Med. 2000; 16, 342 (11): 763–769.
- Kietz D. A., Pepmueller P. H., Moore T. L. Clinical response to etanercept in polyarticular course juvenile rheumatoid arthritis // J. Rheumatol. 2001; 28: 360–362.
- Otten M., Prince F., Twilt M. et al. Delaed clinical response in patients with juvenile idiopathic arthritis treated with etanercept // J. Rheumatol. 2010; 37: 665–667.
- Lovell D. J., Giannini E. H., Reiff A., Jones O. Y., Schneider R., Olson J. C. et al. Long-term efficacy and safety of etanercept in children with polyarticular-ourse juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open-label, extended-treatment trial // Arthritis Rheum. 2003; 48: 218–226.
- Lovell D. J., Reiff A., Jones O. Y., Schneider R. et al. Long-term safety and efficacy of etanercept in children with polyarticular-course juvenile rheumatoid arthritis // Arthritis Rheum. 2006; 54: 1987–1994.
- Lovell D. J., Reiff A., Ilowite N. T., Wallace C. A. et al. Safety and efficacy of up to eight years of continuous Etanercept therapy in patients with Juvenile rheumatoid arthritis // Arthritis Rheum. 2008; 58; 5: 1496–1504.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







