В статье рассмотрено влияние микронутриента мио-инозитола на женскую репродуктивную функцию.
При гормональных формах бесплодия у пациенток отмечаются нарушения менструального цикла, ановуляция, синдром поликистоза яичников (СПКЯ), хроническое воспаление, избыточная масса тела и атерогенный профиль крови. Попытки преодоления бесплодия только на основе использования технологий гормональной стимуляции, без устранения вышеперечисленных фоновых патологий зачастую малорезультативны, а в случае зачатия могут приводить к формированию пороков развития плода. Одной из основополагающих причин коморбидности бесплодия и фоновых патологий является недостаточная обеспеченность микронутриентами (фолаты, мио-инозитол и др.) [1]. Поэтому индивидуально подобранная микронутриентная поддержка является основным инструментом для «тонкой настройки» репродуктивной функции, в т. ч. с целью формирования овуляторных циклов, зрелых ооцитов и профилактики пороков развития плода.
Мио-инозитол — эндогенный метаболит, необходимый для синтеза более 50 инозитолфосфатных производных, участвующих в передаче внутриклеточного сигнала от рецепторов гонадотропин-рилизинг гормона (ГНРГ), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), инсулина и др. [2]. Принципиальным условием синтеза достаточного количества мио-инозитола (2–3 г/сут) является совершенное здоровье почек. Их заболевания (пиелонефрит, гломерулонефрит, диабетическая нефропатия, почечная форма гипертензии и др.) и лекарственная нагрузка на этот орган резко снижают синтез мио-инозитола в почках. Соответственно, при любой патологии почек у пациентки возникает недостаточность мио-инозитола, для коррекции которой необходим прием данного микронутриента, в т. ч. с целью поддержки функционирования репродуктивной системы.
Для принятия врачом осознанного решения о необходимости назначения пациентке мио-инозитола необходимо понимание всего спектра его молекулярно-
физиологических воздействий на репродуктивную сферу. В настоящей работе представлен анализ результатов исследований, в которых изучались эффекты мио-инозитола, проведенный посредством компьютерного анализа массива из 44 тыс. статей в рецензируемых научных журналах, опубликованных к 2018 г., на основе современных методов интеллектуального анализа данных [3].
Анализ показал, что десятки разновидностей рецепторов (например, рецепторы ГНРГ, ФСГ, ЛГ, гистаминовые, ГАМК и т. д.), будучи активированными, задействуют специальные сигнальные белки фосфоинозитолкиназы (в т. ч. PI3K), приводящие к секреции кальция из эндоплазматического ретикулума клетки в цитозоль [2]. Кальций, диацилглицерол, циклический аденозинмонофосфат (цАМФ) и различные фосфат-производные мио-инозитола (фосфатидилинозитол и пр.) являются эссенциальными «вторичными сигналами» (англ. «secondary messenger»), участвующими в регуляции каскадных механизмов, выполняющих биологические роли соответствующих рецепторов.
В нашей предыдущей статье показано, что нарушения обмена мио-инозитола приводят к инсулинорезистентности, ГНРГ/ФСГ/ЛГ-резистентности клеток, нарушениям овуляции, торможению вызревания ооцитов (рис. 1) и ускоряют формирование поликистозных яичников [4]. В настоящей статье мы рассмотрим влияние мио-инозитола на репродукцию, иммунитет, лечение бесплодия, синергизм с фолатами и другими витаминами/минералами и профилактику врожденных пороков развития (ВПР).
Мио-инозитол и его производные необходимы для реализации эффектов гонадотропина, ЛГ и ФСГ — тем самым осуществляется значительное влияние на функционирование репродуктивной системы и фертильность (инвазия трофобласта при закреплении бластоцисты, функции яичников, ооцитов, плаценты). Следует также отметить, что мио-инозитол, воздействуя на соединительную ткань, не только влияет на состояние костей, кожи и ранозаживление, но и имеет принципиальное значение для физиологического развития эмбриона [5].
Как известно, СПКЯ является основной причиной бесплодия вследствие метаболических, гормональных дисфункций яичников. Поликистоз яичников сочетается с инсулинорезистентностью и компенсаторной гиперинсулинемией. Комбинированная терапия СПКЯ с включением мио-инозитола снижает риск нарушений обмена углеводов и жиров у пациенток с избыточной массой тела; положительно влияет на состояние гормональной регуляции и функции яичников [6].
Проспективное РКИ показало, что мио-инозитол улучшает функциональное состояние ооцитов у пациенток с СПКЯ, которым проводились циклы интрацитоплазматических инъекций сперматозоидов (ИКСИ). В группе, состоявшей из 70 женщин 18–35 лет, 35 пациенток с ановуляторным циклом получали 200 мкг/сут ФК и 2 г/сут мио-инозитола в течение 24 нед., а другие 35 пациенток — плацебо. После 24 нед. только 5 из 35 получавших мио-инозитол пациенток имели ановуляторный цикл, в то время как в контрольной группе такой цикл отмечался у 14 из 35 пациенток, что соответствовало 4-кратному снижению риска возникновения ановуляторного цикла: отношение шансов (ОШ) 0,25; 95% доверительный интервал (ДИ) 0,08–0,80, р=0,016) [9].
Содержание статьи
Иммунитет и мио-инозитол
Мио-инозитол необходим для функционирования Т-клеток и В-клеток, NK-лейкоцитов, макрофагов, нейтрофилов, тучных клеток, гранулоцитов, системы комплемента, интерферонов. Например, секреция провоспалительных факторов простагландина Е2 (PGE2) и лейкотриена B4 (LTB4) мононуклеарными клетками периферической крови снижается при добавлении 600 мкмоль/л мио-инозитола в культуру [10]. Мио-инозитол ингибирует киназы Akt и ERK, вовлеченные в онкопролиферативные процессы, приводит к регрессии поражений бронхов при курении. Исследовались 206 биоптатов бронхов от курильщиков с большим стажем курения (n=21, возраст — 40–74 года, индекс курильщика >30 пачка/лет). В результате лечения мио-инозитолом отмечено снижение фосфорилирования Akt (р
Мио-инозитол и функционирование печени и почек
Состояние репродуктивной системы женщины напрямую зависит от эффективности функционирования печени и почек. Мио-инозитол оказывает значительное воздействие на функционирование печени, способствуя реализации биологических эффектов фактора роста гепатоцитов, стимулирует секрецию желчи, профилактирует развитие стеатогепатита и цирроза печени. Мио-инозитол поддерживает функции почечных канальцев, осуществляющих реабсорбцию необходимых организму макро- и микронутриентов из первичной мочи. При диабете отмечается ускоренная элиминация мио-инозитола: его средний уровень в моче у здоровых лиц составляет 5,6 мкг/мл, а у больных с почечной недостаточностью — 29 мкг/мл. Клиренс мио-инозитола у здоровых лиц составляет 2,8 мл/мин (при уровне реабсорбции 97%), а у пациентов с почечной недостаточностью может достигать 17 мл/мин, что свидетельствует о повышении его выведения с мочой [12]. Поэтому женщины с патологией печени и почек, в т. ч. в анамнезе, должны быть информированы о значении мио-инозитола для поддержки соматического и репродуктивного здоровья.
Мио-инозитол и профилактика пороков развития
В настоящее время отмечается рост числа случаев беременности в позднем возрасте, на фоне хронической патологии печени и почек, беременности в результате применения технологий ЭКО/ИКСИ; возрастает нагрузка токсикантами, антибиотиками, эстрогеновыми и другими «антивитаминными» препаратами. Как следствие, создается почва для формирования патологий беременности, ВПР и отклонений развития плода. Профилактика ВПР фолатами не всегда эффективна, т. к. фолаты — не единственный микронутриент, необходимый для физиологического развития плода. Например, нарушения нейруляции связаны с недостатком не только фолатов, но и витаминов А, В6, В12, цинка и мио-инозитола, причем только 70% дефектов нервной трубки (ДНТ) являются фолат-зависимыми [13]. В то же время повторные случаи формирования плодов с ДНТ, несмотря на дотации ФК беременным, указывают на существование фолат-резистентных ДНТ.
Важность применения мио-инозитола для профилактики ДНТ, в особенности фолат-резистентных, обусловлена тем, что производные мио-инозитола принимают комплексное участие в функционировании репродуктивной системы (формировании овуляторных циклов, зрелых ооцитов, эмбриогенезе и развитии плода [14]), применяются для профилактики экстрагенитальной патологии у беременной. Участие мио-инозитола и его производных в обеспечении функционирования рецепторов инсулина, гонадолиберина, ФСГ, ЛГ, факторов роста нервной ткани и др. обеспечивает не только нормальный ход эмбриогенеза и развития плода, но и функционирование сердечно-сосудистой, нервной систем, печени и почек [2]. Особым преимуществом профилактики ВПР мио-инозитолом является его высокий уровень безопасности — даже в дозе 12 г/сут он вызывает легкие побочные эффекты со стороны ЖКТ (тошнота, метеоризм, диарея) у отдельных пациенток [15]. В то же время в реальной клинической практике препараты мио-инозитола принимаются в дозах от 0,5 до 4,0 г/сут.
В экспериментальных и клинических работах показана эффективность приема мио-инозитола для профилактики пороков развития. Так, дотации мио-инозитола позволяют предупреждать ВПР, связанные с инсулинорезистентностью и гипергликемией, характерными для пациенток с избыточной массой тела и СПКЯ. Фосфат-производные мио-инозитола участвуют в процессах передачи сигнала от инсулинового рецептора [2], и поэтому его низкие концентрации в тканях эмбриона на этапе органогенеза могут индуцировать эмбриопатии, связанные с гипергликемией.
В эксперименте на моделях стрептозоцинового диабета у беременных крыс было показано, что содержание миоинозитола в эмбрионах было ниже на 36% по сравнению с таковым в контрольной группе без диабета (p=0,01), ассоциировалось с задержкой развития эмбриона (его длина в основной группе — 3,37±0,04 мм, в контрольной — 3,87±0,03 мм, р=0,01); пониженным числом сомитов (в основной группе — 27,5±0,2, в контрольной — 29,1±0,2, р=0,01) и повышенной частотой патологий нервной системы (в основной группе — 17,6%, в контрольной — 1,9%, р
Клинические наблюдения за группами пациенток с гестационным диабетом (ГД) подтверждают результаты экспериментальных исследований. Прием мио-инозитола снижает риск возникновения ГД даже у женщин с семейной историей диабета 2-го типа. Например, в проспективном рандомизированном плацебо-контролируемом исследовании группа пациенток получала 4 г/сут мио-инозитола и 400 мкг/сут ФК, разделенные на 2 приема в сутки (n=110), начиная с конца I триместра. Пациентки в группе плацебо (n=110) получали только 400 мкг/сут ФК. Заболеваемость ГД была значительно ниже при приеме мио-инозитола — 6%, в то время как в контрольной группе — 15,3% (ОШ=0,35, р=0,04). При приеме мио-инозитола также были отмечены статистически значимое снижение частоты макросомии (масса плода >4000 г) и уменьшение средней массы плода в сторону середины интервала нормы [19].
Кроме того, в экспериментальных исследованиях были определены гены, опосредующие взаимосвязь риска ДНТ, дефицитов мио-инозитола и других микронутриентов, а также существование фолат-чувствительных и фолат-резистентных моделей ДНТ [20]. В экспериментах по делеции генов было установлено более 60 генов, инактивация которых приводит к формированию линий мышей с ДНТ. Эти гены встречаются и у человека. Анализ экспериментального материала с использованием метода анализа функциональных взаимосвязей [21, 22] показал, что не менее 19 из 60 генов кодируют белки и ферменты, активность или уровни которых существенно зависят от наличия определенных микронутриентных кофакторов (табл. 1) [23].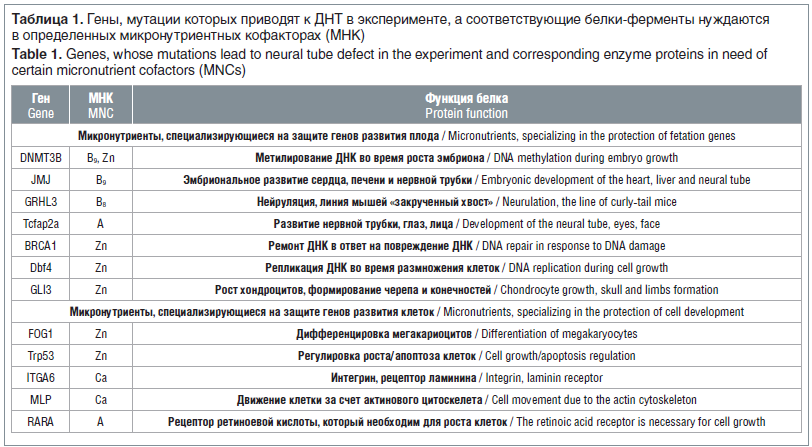
К микронутриентам, необходимым для профилактики ДНТ, относятся цинк, мио-инозитол, фолаты, магний, кальций и витамин А. Дефицит каждого из этих микронутриентов имитирует делецию соответствующего гена (т. к. активность соответствующего белка резко снизится при отсутствии кофактора). Первичная профилактика ДНТ ФК, мио-инозитолом, цинком и витамином А была продемонстрирована и в экспериментальных и в клинических исследованиях [24].
Нарушения нейруляции в линии мышей «закрученный хвост» (англ. curly tail, ген Ct/GRHL3) более, чем другие мутантные линии, напоминают ДНТ, наблюдаемые в акушерской практике. Данная линия (рис. 2) является фолат-резистентной, и эффективная профилактика ДНТ в этой линии может быть достигнута дотациями мио-инозитола [25]. Другими важными микронутриентами для профилактики ДНТ в линии «закрученный хвост» являются ретиноевая кислота, витамины В2, С и D. В то же время профилактика ДНТ посредством фолатов, пиридоксина, витамина В12 или цинка не имела эффекта [26].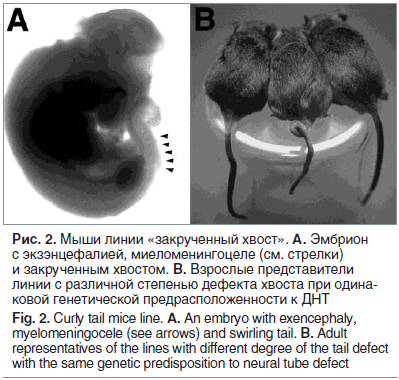
В эксперименте было показано, что ФК в сочетании с мио-инозитолом эффективно снижает риск врожденных дефектов через эпигенетические эффекты (метилирование ДНК) и сигнальный путь Wnt/катенин. В частности, сочетание ФК с мио-инозитолом предотвращает нарушение активности каскада Wnt алкоголем и способствует нормальной активации генов во время кардиогенеза. Например, впрыскивание 25% этанола в перепелиные яйца приводило к формированию аномалий сердечных клапанов у 68% эмбрионов, и только у 32% наблюдалось нормальное развитие. Совместное впрыскивание этанола и ФК (10 мкг/мл) приводило к нормальному кардиогенезу у 51% эмбрионов, а совместное применение ФК и миоинозитола — у 62% эмбрионов, что близко к значению в 67% в контрольной группе [27].
Мио-инозитол существенно уменьшает частоту встречаемости ДНТ, даже при отсутствии дотаций фолатов. Эмбриопротекторные эффекты мио-инозитола проявляются в увеличении метаболизма липидов, стимулировании основного сигнального белка протеинкиназы С и повышении экспрессии рецепторов ретиноевой кислоты, таким образом, закрытие задней части нервной трубки происходит без задержки [28].
Молекулярно-биологические исследования позволили очертить круг мио-инозитол-зависимых белков,посредством которых и осуществляется эмбриопротекция мио-инозитолом (протеинкиназа С, рецепторы инозитол-1,4,5-трифосфата, ферменты инозитол-1,3,4-трифосфат-5/6-киназа, инозитол полифосфат-5-фосфатаза,
фосфатидилинозитол-4-фосфат-5-киназа и рецептор тромбоцитарного фактора роста альфа) [23]. Например, рецепторы инозитол-1,4,5-трифосфата обеспечивают эффекты производных мио-инозитола и необходимы для развития пула стволовых клеток сердца в висцеральной мезодерме. Аномальное развитие данного ростка приводит к целому спектру дефектов выносящих сосудов сердца. Делеции генов инозитол-1,4,5-трифосфат рецепторов в эксперименте приводили к выраженной гипоплазии выносящего тракта сердца, правого желудочка и избыточному апоптозу клеток мезодермы [29]. Мутации гена IP3R1, найденные в человеческих популяциях, снижают активность фермента и приводят к врожденной спиноцеребральной атаксии 15-го и 29-го типов (номер по ОМИМ 147265) [30].
Систематический биоинформационный анализ миоинозитол-зависимых белков человека, участвующих в процессах эмбрионального развития (табл. 2), позволил получить результаты, сопоставимые с результатами систематизированных ранее экспериментальных и молекулярно-биологических исследований [2]. В частности, в результате анализа были установлены обсуждавшиеся ранее гены PIP5K1C (кодирующий фермент фосфатидилинозитол-4-фосфат-5-киназу, необходимый для синтеза внутриклеточной сигнальной молекулы фосфатидилинозитол дифосфата) и PDGFRA (рецептор тромбоцитарного фактора роста альфа, играющего важную роль в эмбриональном развитии, делении и миграции клеток сомита). Кроме того, в результате биоинформационного анализа были выявлены другие перспективные гены для дальнейших экспериментальных и клинических исследований пороков развития (см. табл. 2).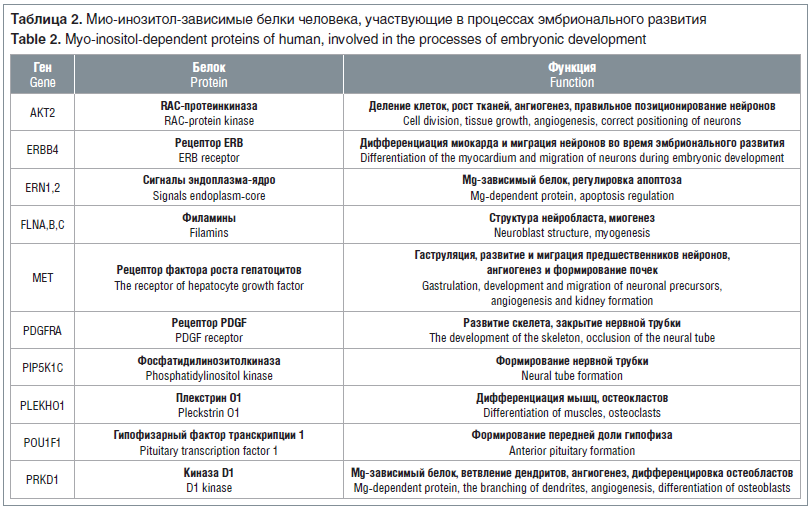
Оценка клинической эффективности мио-инозитола для поддержки репродуктивного здоровья
Наиболее ярко клиническая эффективность миоинозитола для решения проблем репродукции была продемонстрирована у пациенток с СПКЯ. Участие мио-
инозитола в передаче сигнала от рецептора инсулина и осуществлении эффектов основных репродуктивных гормонов обеспечивает более полное вызревание ооцитов [31]. Например, в РКИ при прохождении циклов ИКСИ пациентки со СПКЯ и хроническим ановуляторным бесплодием получали комплекс мио-инозитола 4 г/сут и ФК 400 мкг/сут либо только ФК 400 мкг/сут в течение 3 мес. По сравнению с приемом только ФК сочетанное применение мио-инозитола и ФК обеспечивало достоверное увеличение числа фолликулов диаметром более 15 мм, рост числа активных ооцитов на фоне существенного снижения среднего числа незрелых ооцитов и повышения среднего числа эмбрионов хорошего качества (по шкале S1) [32].
Важно отметить, что добавление мио-инозитола к ФК у пациенток без СПКЯ, проходящих циклы ИКСИ, позволяет уменьшить число используемых зрелых ооцитов и сократить дозировку рекомбинантного ФСГ (рФСГ) без уменьшения числа клинических беременностей. В группе женщин без СПКЯ и с базальным уровнем ФСГ
В сравнительном многоцентровом исследовании была оценена эффективность мио-инозитола и ФК для улучшения качества ооцитов/эмбрионов и результатов цикла ЭКО у пациенток без СПКЯ. Пациентки опытной группы (n=133) получали мио-инозитол 1000 мг/сут и ФК 0,1 мг/сут, а пациентки контрольной группы (n=137) — плацебо. Общее количество зрелых ооцитов было значительно выше в группе мио-инозитол + ФК (12; 95% ДИ: 1–37), чем в группе плацебо (всего 8; 95% ДИ: 0–24) (р
В другом проспективном РКИ с участием женщин с СПКЯ, проходящих ЭКО, было также показано, что дотации мио-инозитол + ФК приводят к улучшению показателей оплодотворения и улучшению качества эмбрионов. За 2 мес. до ЭКО группа участниц была рандомизирована на группу плацебо (n=15) и группу «мио-инозитол + ФК» (4000 мг/сут мио-инозитола, 400 мкг/сут ФК, n=14). Из 233 ооцитов, отобранных в группе «мио-инозитол + ФК», оплодотворялись 136 (58,4%), тогда как только 128 из 300 отобранных ооцитов (42,7%) оплодотворились в группе плацебо. Продолжительность стимуляции составила 9,7±3,3 дня в группе «мио-инозитол + ФК» и 11,2±1,8 дня — в группе плацебо (р
Метаанализ 6 РКИ (n=935) подтвердил, что прием комбинации «мио-инозитол + ФК» за 3 мес. до проведения ИКСИ способствовал повышению частоты клинической беременности у бесплодных женщин, проходящих индукцию овуляции для ИКСИ или трансплантацию эмбриона in vitro. Пациентки контрольной группы принимали только ФК. Дотации комбинации мио-инозитол + ФК были ассоциированы со значительно повышенной частотой клинической беременности (р=0,03), более низкой частотой невынашивания (95% ДИ: 0,08–0,50, p=0,0006). Шансы получения эмбриона 1-й степени были выше (ОШ 1,8; 95% ДИ: 1,10–2,74, p=0,02), а риск формирования вырожденных ооцитов — ниже (ОШ 0,5; 95% ДИ: 0,11–0,86, p=0,02) на фоне дотаций мио-инозитол + ФК. Прием комбинации мио-инозитол + ФК также способствовал снижению суммарной дозы гормона рФСГ, необходимого для стимуляции овуляции (-334 ед., 95% ДИ: -591…-210 ед., p=0,001) [36].
Заключение
Анализ исследований свидетельствует о наличии важных резервов нормализации менструального цикла, восстановления чувствительности яичников к гормонам, поддержки противоопухолевого иммунитета, повышения качества ооцитов, вероятности наступления беременности. Очевидно, что в условиях выраженного полигиповитаминоза [37], повсеместного использования «антивитаминных» препаратов [38] и гипергликемического питания поддержка мио-инозитолом приобретает исключительную важность. Мио-инозитол позволяет не только преодолевать резистентность клеток к инсулину и глюкозе, но и поддерживать ряд сигнальных каскадов (рецепторов ГНРГ, ЛГ, ФСГ и др.), важных для овуляции, вызревания ооцитов, а также обеспечивать профилактику пороков развития (в т. ч. фолат-резистентных). Повысить обеспеченность мио-инозитолом можно, например, посредством приема препарата Миоферт (произведен по технологии GMP, содержит 1000 мг инозита (в виде мио-инозитола) и 200 мкг ФК в 1 пакетике-стике) в виде водного раствора. Для приготовления раствора для питья следует использовать только чистую питьевую воду комнатной температуры, растворение в молоке, соках, киселе недопустимо (т. к. это снизит биодоступность мио-инозитола из препарата).
Работа выполнена при участии гранта РФФИ 15-07-04143 в рамках диссертационного исследования А.Г. Калачёвой.
This work was supported by the Russian Foundation for Basic Research grant 15-07-04143 under thesis research by Alla G. Kalacheva.
Сведения об авторах: 1Торшин Иван Юрьевич — к.х.н., старший научный сотрудник лаборатории фармакоинформатики; 1Громова Ольга Алексеевна — д.м.н., профессор, ведущий научный сотрудник, научный руководитель института фармакоинформатики; 2Калачёва Алла Геннадьевна — к.м.н., доцент кафедры фармакологии; 3Тетруашвили Нана Картлосовна — д.м.н., профессор, заведующая отделением патологии беременных; 2Демидов Вадим Игоревич — к.м.н., доцент кафедры патологической анатомии. 1ФИЦ ИУ РАН. 119333, Россия, г. Москва, ул. Вавилова, д. 44, корп. 2. 2ФГБОУ ВО ИвГМА Минздрава России. 153000, Россия, г. Иваново, Шереметевский пр., д. 8. 3ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. 117997, Россия, г. Москва, ул. Академика Опарина, д. 4. Контактная информация: Громова Ольга Алексеевна, e-mail: unesco.gromova@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 18.09.2018.
About the authors: 1Ivan Yu. Torshin — PhD in Chemistry, Senior Researcher of the Laboratory of Pharmacoinformatics; 1Olga A. Gromova — MD, PhD, Professor, Leading Researcher, Science Нead of the Institute of Pharmacoinformatics; 2Alla G. Kalacheva — MD, PhD, Associate Professor of the Department of Pharmacology; 3Nana K. Tetruashvili — MD, PhD, Professor, Head of the Department of Pathology of Pregnancy; 2Vadim I. Demidov — MD, PhD, Associate Professor of the Department of Pathological Anatomy. 1Federal Research Center “Computer Science and Control” of the Russian Academy of Sciences. 44, bld. 2, Vavilova str., Moscow, 119333, Russian Federation. 2Ivanovo State Medical Academy. 8, Sheremetevsky ave., Ivanovo, 153000, Russian Federation. 3V.I. Kulakov Research Center of Obstetrics, Gynecology and Perinatology. 4, Oparina str., Moscow, 117997, Russian Federation. Contact information: Olga A. Gromova, e-mail: unesco.gromova@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received: 18.09.2018.
Информация с rmj.ru