Статья посвящена актуальной междисциплинарной проблеме когнитивных нарушений. Показано, что своевременное выявление и назначение патогенетически обоснованной терапии принципиально важно, поскольку способствует функциональному восстановлению церебральных структур и предотвращает необратимые последствия.
Когнитивные расстройства, или когнитивные нарушения (КН), являются одной из наиболее актуальных проблем современной медицины, с которой сталкиваются врачи различных специальностей в клинической практике. Выраженные расстройства когнитивных функций нарушают бытовую, социальную и профессиональную деятельность, приводят к снижению качества жизни, а в ряде случаев к инвалидизации и развитию полной зависимости от окружающих, что наиболее часто наблюдается у людей пожилого и старческого возраста. Распространенность КН, не достигающих степени деменции, составляет 15–20% [1]. Показано, что по мере старения, частота встречаемости КН прогрессивно увеличивается: от 20% у людей 60–69 лет до более чем 40% — старше 85 лет [1].
На сегодняшний день в мире почти у 50 млн людей отмечается деменция, и каждый год регистрируется около 10 млн новых случаев этого заболевания [2]. По прогнозам специалистов, к 2030 г. количество людей, страдающих деменцией, удвоится, а к 2050 г. — утроится, и будет составлять более 130 млн человек [2, 3]. Пациенты с деменцией требуют существенных затрат, и наблюдается тенденция к их дальнейшему росту [2].
В большинстве случаев развитию деменции в течение длительного периода предшествуют малосимптомные расстройства когнитивных функций, поэтому основное внимание клиницистов должно быть направлено на своевременную диагностику, исключение потенциально курабельных состояний и заболеваний и максимально раннее начало терапии имеющихся недементных нарушений. На уровне первичного звена здравоохранения существуют значительные трудности в диагностике и последующей терапии КН. Возможными причинами этого являются отсутствие активных жалоб пациентов на когнитивный дефицит и явных клинических симптомов нарушений познавательной сферы, недостаточный навык врача при ее тестировании и сомнения клинициста в курабельности данной патологии. Так, при скрининговом обследовании пациентов старше 65 лет с целью выявления КН врачами общей практики деменция была обнаружена в 8,8% случаев, при том что 67% исследуемых не предъявляли каких-либо жалоб на нарушение когнитивных функций [4].
представляют собой наиболее сложно организованные функции головного мозга, с помощью которых происходит процесс рационального познания мира и обеспечивается целенаправленное взаимодействие с ним. Они развиваются сразу после рождения человека, их дальнейшее формирование происходит по мере взросления и обучения индивидуума, а также влияния социума. Важным фактором для развития КН является так называемый
— способность нейрональных структур головного мозга успешно функционировать в условиях повышенной нагрузки, при возрастных изменениях или при различных патологических процессах (инсульт, черепно-мозговая травма, нейродегенеративные заболевания и др.) [5]. Для этого требуется эффективная и динамичная интеграция как отдельных, так и взаимосвязанных корковых областей головного мозга.
Одним из факторов, определяющих степень когнитивного и нейропластического потенциала и обеспечивающих процессы обучения и памяти, является адекватное функционирование и пластичность синапсов в структурах центральной нервной системы (ЦНС) [6]. Поэтому неудивительно, что значительная потеря этих нейрональных образований при старении и различных по этиологии заболеваниях (первично-дегенеративных, включая болезнь Альцгеймера, сосудистых, вирусных, травматических и пр.) может клинически выражаться развитием нейропсихиатрических синдромов. В частности, при болезни Альцгеймера утрата синапсов тесно коррелирует с выраженностью когнитивного дефекта, причем синаптическая дисфункция за много лет предшествует гибели нейронов [6].
Помимо врожденных анатомо-функциональных особенностей церебральных структур, определяющее значение для формирования и поддержания когнитивного резерва имеют уровень интеллектуального развития и активное функционирование нейрональных структур головного мозга в течение всей жизни [7], в частности интеллектуальная деятельность, регулярная физическая нагрузка и активное социальное поведение, включая трудовую деятельность и досуг [8].
Факторы, поддерживающие когнитивный резерв и положительно влияющие на когнитивные функции:
увеличение когнитивного резерва: поддержание высокой умственной активности, эмоциональная насыщенность, широкие социальные контакты, нейропсихологический тренинг;
регулярные дозированные физические нагрузки;
средиземноморская диета, умеренное употребление алкоголя;
отказ от курения.
С помощью клинико-анатомических исследований продемонстрировано, что даже несколько лет образования могут увеличивать когнитивный резерв [5], а лица с высоким церебральным ресурсом имеют меньший шанс развития в дальнейшем умеренных КН и демен-
ции [5, 9]. Наличие когнитивного резерва в значительной степени нивелирует неблагоприятное влияние различных патологических факторов на когнитивную сферу, включая существующие лакунарные инсульты и изменения альцгеймеровского типа [10].
У здоровых людей с помощью нейровизуализационных методов исследования продемонстрированы индивидуальные структурные и функциональные особенности головного мозга [11, 12], причем в имеющихся различиях определенную роль играет фактор пола, в т. ч. в процессе нормального старения [13, 14]. В частности, головной мозг женщин отличается бóльшим количеством анатомических связей и более высоким уровнем энергопотребления в функционально значимых церебральных областях [15]. Это позволяет осуществлять интегрированные и высокоспециализированные процессы, требующие синхронизации межнейрональных связей и систем, а с другой стороны, приводит к бóльшей уязвимости церебральных структур в условиях патологии и развитию различных нейродегенеративных заболеваний, например болезни Альцгеймера [15].
Топологическая структура головного мозга человека меняется в течение всей жизни, с возрастом происходит в первую очередь уменьшение его объема и массы, что обусловливает сглаживание борозд и извилин, расширение субарахноидальных пространств и желудочков, определяемых при нейровизуализационных исследованиях головного мозга. В период от 60 до 90 лет отмечается редукция гиппокампа на 35%, коры — на 15%, белого вещества мозга — на 25%, и протяженность миелинизированных аксонов уменьшается почти наполовину [16]. Толщина кортикального и субкортикального слоев головного мозга может меняться в течение одного года на 0,5–1,05%, что сопровождается снижением числа синаптических соединений и модулей нейронов, в т. ч. ответственных за контроль когнитивной деятельности, и соответственно уменьшением межнейрональных контактов и связей [16]. Данные исследований демонстрируют снижение общего количества нейронов в определенных церебральных областях на 45% к 90-летнему возрасту [17, 18].
На возникновение первых симптомов КН и их дальнейшее прогрессирование существенное влияние оказывает ряд факторов, многие из которых являются модифицируемыми или корригируемыми [5].
Корригируемые факторы:
артериальная гипертензия;
гиперлипидемия;
сахарный диабет;
дефицит витамина В12 и фолиевой кислоты;
ожирение;
курение;
злоупотребление алкоголем;
гиподинамия;
низкий уровень образования.
Некорригируемые факторы:
пожилой возраст;
генетическая предрасположенность;
семейный анамнез;
женский пол;
черепно-мозговая травма в анамнезе;
депрессия в анамнезе.
Наличие и длительность артериальной гипертензии способствуют формированию субкортикального и перивентрикулярного лейкоареоза [19]. При этом даже эпизодическое повышение артериального давления (АД), в т. ч. во время сна, сопровождается не только развитием лейкоареоза, но и церебральной атрофии [5]. Показано, что более четверти случаев развития деменции у пожилых обусловлены неадекватной коррекцией у них артериальной гипертензии в среднем возрасте [19]. Имеющиеся данные свидетельствуют о важности выявления и последующего лечения сосудистых факторов риска КН, что позволяет уменьшить риск развития деменции в пожилом и старческом возрасте [20, 21], при этом особое внимание уделяется адекватной коррекции АД, что предотвращает в дальнейшем развитие лейкоареоза и церебральных инфарктов [22].
Важно заметить, что КН, в т. ч. деменция, не являются следствием возрастных изменений в процессе нормального старения; лишь снижение познавательных процессов у пожилых людей, сопровождающееся бытовой, профессиональной и социальной дезадаптацией, можно относить к патологическому состоянию, требующему пристального внимания, обязательного диагностического скрининга (с исключением потенциально курабельных заболеваний) и дальнейших терапевтических воздействий.
Содержание статьи
Недементные когнитивные нарушения
КН представляют собой снижение одной или нескольких познавательных функций по сравнению с ранее имеющимся уровнем [23]. КН могут иметь разную степень выраженности, они наблюдаются при большом количестве заболеваний, и в клинической практике такие пациенты оказываются на приеме у врачей разных специальностей.
Субклинические КН (СКН) возникают у людей в активном и трудоспособном возрасте, наблюдаясь в среднем у 12% населения [24]. Спектр жалоб при этом неспецифичен и включает повышенную забывчивость и утомляемость при умственной нагрузке, снижение концентрации внимания. Они беспокоят пациентов, заставляя повторно обращаться к врачу, но не подтверждаются данными нейропсихологического обследования и совершенно незаметны для окружающих людей [25].
Диагностические критерии СКН [25]:
жалобы на стойкое ухудшение умственной работоспособности по сравнению с ранее имеющейся, возникшее без видимой причины;
отсутствие отклонений от возрастной нормы при выполнении стандартных нейропсихологических тестов для диагностики КН;
исключены умеренные и выраженные (деменция) КН;
предъявляемые жалобы на нарушение когнитивных функций не связаны с текущими и/или установленными неврологическими (кроме нейродегенеративных заболеваний), психиатрическими, соматическими заболеваниями или использованием лекарственных препаратов.
Вместе с тем показано, что в 6,7% случаев у лиц, отмечающих СКН, в течение года развиваются легкие или умеренные КН [26]. Данные нейровизуализационных исследований демонстрируют у пациентов с СКН статистически значимое уменьшение объема энторинальной коры, ответственной за эпизодическую, семантическую и автобиографическую память [27], и наличие соответствующих биомаркеров в спинномозговой жидкости [25],
что позволяет многим исследователям рассматривать СКН как наиболее раннюю стадию нейродегенеративных заболеваний [25, 27]. Результаты двух метаанализов свидетельствуют об увеличенном в 2 раза риске возникновения умеренных КН и деменции при наличии у пациентов СКН [28, 29].
При легких КН (ЛКН) наблюдается снижение познавательных функций, и отклонения можно обнаружить только при выполнении сложных нейропсихологических тестов. Наличие ЛКН не вызывает у пациентов профессиональной, социальной или бытовой дезадаптации. Пациенты с СКН и ЛКН представляют достаточно гетерогенную группу, включающую больных с тревожными, депрессивными, ипохондрическими и астеническими расстройствами, адекватная коррекция которых приводит к значимому клиническому эффекту, а также лиц с изначально бóльшим когнитивным резервом и высоким интеллектуальным уровнем развития, снижение которого не всегда можно обнаружить при использовании тестов, ориентированных на среднестатистический уровень. В этом случае важно ориентироваться на стойкость предъявляемых жалоб и толерантность к умственным нагрузками в обычной жизни как на возможные симптомы развивающегося нейродегенеративного процесса на доклиническом уровне. Пациенты с СКН и ЛКН требуют динамического наблюдения, соблюдения поведенческих рекомендаций, оказывающих положительное влияние на когнитивные функции, и коррекции имеющихся факторов риска развития КН.
Пристальное внимание клиницистов последние годы привлекают умеренные КН (УКН), заметные для пациента и окружающих его людей и являющиеся явным клиническим синдромом, подтвержденным с помощью данных нейропсихологического тестирования. При этом наличие УКН не вызывает профессиональной дезадаптации и не нарушает самостоятельности пациента в повседневной жизни. Модифицированные диагностические критерии синдрома УКН [30]:
наличие КН, о которых сообщают пациент и/или лица из его ближайшего окружения;
снижение когнитивных способностей по сравнению с исходным более высоким уровнем, свидетельства которых получены от пациента и/или его ближайшего окружения;
наличие объективных проявлений нарушений памяти и/или других когнитивных функций, по данным нейропсихологических тестов;
отсутствие нарушений привычных для пациента форм повседневной активности, при этом могут отмечаться нарушения сложных видов деятельности;
отсутствие деменции.
Углубленное исследование данных расстройств позволит лучше изучить клинические и патогенетические особенности наиболее ранних дементных нарушений и выявить пациентов с негрубым когнитивным дефицитом, находящихся в группе риска дальнейшего развития деменции [5], а также позволит как можно раньше использовать разнообразные терапевтические стратегии, обоснованные в зависимости от выявленной этиологии.
Этиопатогенетические причины в основе развития КН весьма разнообразны. Значительное число заболеваний, связанных с поражением ЦНС, сопровождаются развитием КН разной степени выраженности. К ним относятся нейродегенеративные и демиелинизирующие заболевания, нейроинфекции, сосудистые заболевания головного мозга, травматические повреждения, опухоли головного мозга и др. В частности, у 10–82% больных после инсульта отмечаются КН в виде снижения скорости психомоторных реакций, нарушения исполнительных и зрительно-пространственных функций и конструктивных способностей [31], при этом восстановление нарушенных функций в течение полугода возможно на 35–80%, в течение 2 лет когнитивный статус значительной части пациентов остается стабильным или улучшается: в 14% случаев — от постинсультной деменции до КН, не достигающих степени деменции [31]. Эти данные свидетельствуют об адаптивной пластической перестройке высших мозговых функций в постинсультный период [5]. Вместе с тем в большинстве исследований оценка когнитивной сферы проводится лишь через 3 мес. от начала заболевания, а адекватное патогенетически обоснованное лечение получает меньшая часть пациентов [31].
Тактика ведения пациентов с когнитивными нарушениями
Общими принципами ведения пациентов с КН являются определение этиопатогенетической причины, характера и выраженности имеющихся расстройств, уменьшение степени и предупреждение прогрессирования когнитивного дефицита, воздействие на сосудистые факторы риска и, таким образом, улучшение качества жизни этой категории больных.
Диагностический алгоритм пациентов с КН начинается с подробного анализа предъявляемых жалоб больного и окружающих его людей, тщательного обследования неврологического статуса, психоэмоциональной сферы и нейропсихологического тестирования. В клинической практике для диагностики КН используются различные шкалы, опросники и тесты (табл. 1), однако недостаточная степень их чувствительности может препятствовать своевременному выявлению нарушений или адекватному анализу когнитивного дефицита. Стратегически важны при ведении больных с КН оценка психоэмоционального статуса и выявление аффективных (тревожных и депрессивных) нарушений, при существенной выраженности которых необходимо привлечение психиатра.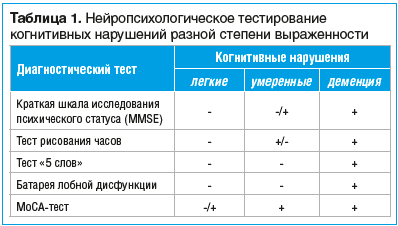
Необходимым этапом диагностического алгоритма являются нейровизуализационные методы исследования (магнитно-резонансная томография, мультисистемная компьютерная томография, реже — позитронно-эмиссионная томография). Это позволяет уточнить локализацию и выраженность структурных изменений головного мозга и обнаружить потенциально курабельные причины для развития КН, например опухоль, гидроцефалию или субдуральную гематому, требующие привлечения нейрохирургов для определения тактики дальнейшего лечения этих пациентов.
Принципиально важным для больных с КН является развернутое клиническое исследование для исключения и своевременной коррекции потенциально обратимых патологических состояний и заболеваний. Большое количество болезней могут приводить к развитию КН, и вполне закономерно, что в клинической практике эта категория пациентов наблюдается у специалистов разного профиля, в т. ч. терапевтов, врачей общей практики, кардиологов, эндокринологов и др. Далеко не полный перечень патологических состояний, приводящих к нарушению когнитивных функций, включает: соматические заболевания (сердечно-сосудистую патологию, нарушение функции печени и почек, дыхательную недостаточность); дефицитарные состояния (недостаточность витаминов В12, В6, В1 и фолиевой кислоты); эндокринную патологию (сахарный диабет, гипо- и гипертиреоз); промышленные, бытовые и лекарственные интоксикации (прием препаратов из группы холинолитиков, бензидиазепинов, барбитуратов, химиотерапевтические средства, алкоголизм, наркоманию, тяжелые металлы и инсектициды).
Лечение пациентов с когнитивными нарушениями
Лечение больных с КН должно быть направлено, по возможности, на этиопатогенетические механизмы заболевания, лежащего в основе развития когнитивного расстройства. Однако на практике это не всегда представляется возможным. В подавляющем большинстве случаев доступна симптоматическая терапия, позволяющая уменьшить выраженность когнитивных и нервно-психических нарушений и тем самым повысить качество жизни пациента и его родственников.
Своевременная диагностика потенциально обратимых состояний позволяет назначить этиотропную терапию пациентам с КН, курабельность которых напрямую зависит от максимально полной коррекции имеющейся соматической патологии.
В повседневной клинической практике лечения пациентов с недементными КН широко используются препараты разных фармакологических групп, направленные на коррекцию различных звеньев патогенеза КН. При этом среди лекарственных средств с преобладающим влиянием на мнестические и познавательные функции, нарушенные при недементных КН, в первую очередь рассматриваются холинергические препараты.
Ацетилхолин является одним из основных нейромедиаторов головного мозга и синтезируется в пресинаптических мембранах холинергических нейронов, широко представленных в различных отделах нервной системы [32], в частности в области базальных ганглиев, мозжечка, таламуса, ядра моста, гиппокампа, хвостатого ядра, передних рогов боковых желудочков, серого вещества полушарий головного мозга и вегетативных образований нервной системы [33]. Многие заболевания протекают на фоне холинергической дисфункции [34]. В условиях патологии, при недостаточном количестве холина или повышенной потребности в ацетилхолине фосфолипиды нейронов становятся основным источником холина, что приводит к разрушению мембран нервных клеток [34] и дальнейшему усугублению имеющихся нарушений, поэтому применение средств, уменьшающих холинергический дефицит, патогенетически обосновано.
Среди эффективных представителей холинергических препаратов можно выделить холина альфосцерат (Церепро®), содержащий 40,5% метаболически защищенного холина, способного проникать через гематоэнцефалический барьер и выступать донором при биосинтезе ацетилхолина, и глицерофосфат — предшественник фосфолипидов, участвующий в синтезе фосфатидилхолина (мембранного фосфолипида) в нейрональных мембранах. Указанные направления фармакологического действия Церепро® приводят к улучшению синаптической передачи, в т.ч.: холинергической трансмиссии, являющейся ключевым фактором развития КН; пластичности и функционального состояния мембранных структур нейронов, т. е. основным процессам нейропластичности, определяющим формирование и поддержание церебрального резерва. Важным преимуществом Церепро® по сравнению с другими пресинаптическими холинотропными средствами является прямое сохранение, а возможно, увеличение и депонирование эндогенного пула ацетилхолина, миелина и фосфолипидов [33]. Терапевтическая эффективность Церепро® определяется также прямым влиянием на другие церебральные нейротрансмиттерные системы — норадренергическую и дофаминергическую. Альфа-адреноблокирующее действие приводит к улучшению кровотока и нормализации пространственно-временных характеристик спонтанной биоэлектрической активности мозга. Препарат обладает широким терапевтическим потенциалом и с успехом используется для лечения КН разной степени выраженности. Эффективность холина альфосцерата при лечении больных с мягкой и умеренной деменцией альцгеймеровского типа доказана во многих международных исследованиях [35, 36]. При этом показано, что длительный и регулярный прием препарата не только уменьшает выраженность КН, но и несколько замедляет прогрессирование заболевания.
В отечественном исследовании пациентов с УКН и с выраженным когнитивным дефицитом (легкой деменцией) на фоне хронических цереброваскулярных заболеваний было показано, что прием холина альфосцерата в течение 3–6 мес. в дозе 1200 мг/сут в составе стандартной гипотензивной и антиагрегантной терапии вызвал у 71,2% больных достоверное улучшение когнитивных функций, по данным нейропсихологических тестов, причем у 48,1% наблюдалась значительная положительная динамика [37].
Клинический эффект Церепро® у больных с разнообразными заболеваниями головного мозга, в т. ч. с демен-
цией и энцефалопатией, заключается в уменьшении выраженности когнитивно-мнестических и поведенческих расстройств: улучшении процессов запоминания, мышления, внимания, мотивации, концентрации внимания и др. Неоднократно продемонстрировано [33, 37, 38] положительное влияние терапии Церепро® на качество жизни больных с хронической ишемией головного мозга, заключавшееся в достоверном повышении физической активности, улучшении общего восприятия состояния своего здоровья и жизнеспособности, а также в достоверном увеличении социальной активности, что имеет очень большое значение для пациентов с прогрессирующей сосудисто-мозговой недостаточностью.
Таким образом, Церепро® обладает не только симптоматическим позитивным эффектом при КН, но и патогенетически обоснованно и прицельно влияет на адаптационные процессы нейропластичности, что позволяет его применять при широком спектре дегенеративных и цереброваскулярных заболеваний и инволюционных изменений разной степени выраженности. Важно подчеркнуть, что холина альфосцерат имеет дозозависимый эффект, поэтому длительный и регулярный прием не только уменьшает выраженность когнитивных расстройств, но и несколько замедляет прогрессирование имеющихся нарушений [33, 38].
На практике при наличии выраженного когнитивного дефицита или обострении текущего хронического заболевания в виде ухудшения мнестических или других когнитивных функций отчетливый клинический эффект имеет парентеральное применение Церепро® в течение 2 нед. в суточной дозе 1000 мг/сут с последующим пероральным длительным приемом препарата в дозе 1200 мг/сут с преимущественным приемом в первой половине дня. Наличие ЛКН или УКН у молодых людей активного трудоспособного возраста с ведущими жалобами на нарушение памяти, концентрации и внимания предполагает назначение повторных, менее продолжительных курсов приема Церепро® (3 мес.) наряду с нефармакологическими методами лечения и поведенческими рекомендациями.
В последние годы активно обсуждается ведущее значение перекисного окисления липидов, окислительного фосфорилирования, оксидантного стресса, нарушения внутриклеточных энергетических процессов и гипоксии в возникновении и развитии различных нарушений, в т. ч. когнитивного дефицита, при поражении головного мозга [16, 39–41]. В связи с этим целесообразно и оправданно применение препаратов с метаболическим, антигипоксическим и антиоксидантным действием, предназначенных для коррекции энергетических процессов, связанных с утилизацией кислорода и глюкозы и получением аденозинтрифосфорной кислоты (АТФ). Одним из таких средств с направленным нейрометаболическим действием является идебенон (Нейромет), замедляющий процессы перекисного окисления липидов, тем самым предохраняющий мембраны нейронов и митохондрий от повреждений; повышающий скорость нейрофизиологических реакций, обменных процессов в головном мозге путем активации синтеза глюкозы и АТФ и улучшающий кровоснабжение и оксигенацию тканей мозга [40, 41].
Протективное действие идебенона посредством предотвращения процессов высвобождения холина из фосфолипидов нейронов и дисфункции нейрональной мембраны было продемонстрировано японскими исследователями в экспериментальных работах еще много лет назад [42]. Это соотносится с наблюдаемыми на практике клиническими эффектами препарата в виде повышения скорости сенсомоторных реакций, улучшения показателей краткосрочной и оперативной памяти и внимания [39, 43], а также с антиастеническим, психостимулирующим, антидепрессивным и ноотропным влиянием уже через 3–4 нед. его приема [43].
Данные мультимодальные эффекты идебенона позволяют рекомендовать Нейромет пациентам с цереброваскулярными расстройствами, психоорганическим синдромом, эмоционально-лабильными нарушениями и астеническими состояниями.
В клинической практике все чаще обсуждается целесообразность комбинаций лекарственных средств однонаправленного действия с взаимодополняющими и синергичными влияниями на нейрональные структуры. Это позволит безопасно и эффективно усилить предполагаемое нейропротективное действие препаратов и повысить эффективность проводимой терапии. Рациональной комбинацией представляется совместное применение препаратов Церепро® и Нейромет, каждый из которых имеет свои точки приложения, при этом конгруэнтно оказывая нейропротективное воздействие, положительно влияя на синтез ацетилхолина, усиливая метаболические процессы в ЦНС, улучшая кровоснабжение и оксигенацию тканей мозга. Комбинированное применение идебенона и холина альфосцерата не имеет противопоказаний и в настоящее время активно обсуждается в действующих методических рекомендациях.
Заключение
Таким образом, КН в клинической практике, как правило, представляют непростую задачу для врачей различных специальностей с точки зрения диагностики и подбора эффективной терапии и нередко требуют привлечения нескольких клиницистов при ведении одного больного. Далеко не каждое снижение когнитивных функций является неуклонно прогрессирующим и приводит к развитию деменции. Своевременное выявление и назначение патогенетически обоснованной терапии принципиально важно, поскольку способствует функциональному восстановлению церебральных структур и предотвращает необратимые последствия.
Несмотря на многолетний опыт использования препаратов с нейропротективным действием, схемы назначения лекарственных средств остаются эмпирическими. Вместе с тем все чаще обсуждается важность дифференцированного и своевременного применения препаратов нейроцитопротективного и нейрометаболического действия, как и необходимость длительного, возможно, постоянного использования патогенетически обоснованных лекарственных средств или их комбинаций, обладающих синергичными и взаимодополняющими эффектами.
Информация с rmj.ru






