Введение
Частота выявления синдрома поликистозных яичников (СПЯ) неуклонно растет, и в настоящее время считается, что он может затрагивать до 15–20% женского населения [1]. Данный синдром характеризуется многогранностью клинических проявлений, включая ановуляцию, ассоциированную с ней олигоаменорею и бесплодие, а также клиническую и/или биохимическую гиперандрогению. Но, вероятно, более важно, что многие патологические изменения, характерные для СПЯ, протекают латентно, без явных фенотипических проявлений, при этом провоцируют значимую соматическую патологию. Они включают нарушения углеводного и жирового обмена и связанные с ними риски формирования сахарного диабета (СД) и сердечно-сосудистых заболеваний (ССЗ) [2, 3]. Представления об этиопатогенетических основах СПЯ менялись на протяжении десятилетий и остаются предметом дискуссий, однако одними из ключевых элементов теории возникновения СПЯ рассматриваются инсулинорезистентность (ИР) и гиперинсулинемия (ГИ) [4].
Углеводный и жировой обмен при СПЯ
Инсулинорезистентность — это патологическое состояние, характеризующееся нарушением способности инсулина стимулировать захват глюкозы клетками-мишенями, вследствие чего ее уровень в сыворотке крови повышается, а синтез инсулина компенсаторно увеличивается [4, 5]. ГИ через центральные рецепторы нарушает пульсационную секрецию гонадотропин-рилизинг-гормона, тем самым индуцируя выработку лютеинизирующего гормона (ЛГ), который, в свою очередь, повышает продукцию андрогенов тека-клетками яичников [5–7]. По разным данным, повышение уровня ЛГ наблюдается у 30–90% пациенток с СПЯ, а те или иные проявления гиперандрогении, включая акне, гирсутизм и алопецию, — у 65–75% [8, 9]. При этом в отличие от других органов и тканей яичники сохраняют нормальную чувствительность к инсулину, что получило название «овариальный парадокс» [6, 10]. Вследствие этого при системной ИР и ГИ яичники подвергаются чрезмерному воздействию инсулина, это снижает чувствительность гранулезных клеток ооцитов к действию ФСГ, что совместно с повышением уровня ЛГ нарушает фолликулогенез [11, 12]. Кроме того, повышенный уровень инсулина может вызывать несвоевременную экспрессию рецепторов ЛГ в мелких фолликулах, что приводит к преждевременной терминальной дифференцировке гранулезы и остановке созревания ооцитов. Исследования показали, что инсулин может напрямую влиять на стероидогенез, в частности индуцировать синтез андрогенов и снижать уровень глобулина, связывающего половые гормоны, без изменения секреции гонадотропинов. Нарушение секреции гонадотропинов, рецепторного аппарата фолликулов и гиперандрогения приводят к ановуляции, олиго- или аменорее и бесплодию, основой которых является ИР [11–13].
Однако на современном этапе развития науки диагностика ИР не столь однозначна. Единственным прямым методом ее оценки является гиперинсулинемический эугликемический клэмп-тест, который сложен в проведении и не применяется в клинической практике. Наиболее распространенные и доступные методы — непрямые, включающие глюкозотолерантный тест, индекс HOMA. Согласно данным литературы ИР затрагивает около 50–70% женщин с СПЯ, а при наличии ожирения частота увеличивается до 95%. Но ввиду несовершенства существующих методов диагностики реальная распространенность ИР может быть еще выше [14–16]. По результатам клэмп-теста, по сравнению со здоровыми женщинами, у пациенток с СПЯ чувствительность к инсулину ниже на 27%, причем без четкой корреляции с индексом массы тела (ИМТ) [17], и может затрагивать до 86,6% пациенток [16, 17].
Инсулинорезистентность тесно взаимосвязана с нарушениями не только углеводного, но и липидного обмена, провоцируя в том числе увеличение висцеральной жировой массы. Так, при СПЯ от 30 до 70% пациенток имеют избыточную массу тела и ожирение [18, 19], к 40 годам у каждой второй может развиться метаболический синдром (МС) или СД 2 типа (СД2) [1], а скорость прогрессии с нарушением толерантности к глюкозе (НТГ) вплоть до СД2 выше, чем в среднем в популяции [19, 20]. В исследовании Г.Е. Чернуха и соавт. [21] избыточная масса тела и ожирение имелись примерно у каждой третьей (37,2%) пациентки с СПЯ, однако по данным двухэнергетической рентгеновской абсорбциометрии (денситометрия), избыток жировой ткани встречался вдвое чаще — у 73,6%. Авторы отмечают высокую распространенность так называемого скрытого ожирения, при котором у женщин с нормальным ИМТ может быть избыток жировой ткани. Согласно этим результатам риск скрытого ожирения имеется уже при ИМТ 23 кг/м2 и более [21]. Важно отметить значительное повышение массы и доли висцеральной жировой ткани, которая считается метаболически более активной и неблагоприятной. Широко известна ассоциированность висцерального ожирения с МС, что обусловлено более выраженными нарушениями липидного и эндокринного обмена, секрецией провоспалительных медиаторов, обусловливающих системное воспаление [21, 22].
Известно, что нарушения углеводного обмена и ожирение тесно связаны с окислительным стрессом, воспалением, накоплением свободных жирных кислот (СЖК) и триглицеридов (ТГ) в печени, и в конечном итоге развитием неалкогольной жировой болезни печени (НАЖБП) — состояния аккумуляции гепатоцитами жировой ткани. При наличии данных факторов частота НАЖБП может достигать 70–90% и более [23]. При НАЖБП липолиз в жировой ткани усиливается, в то время как β-окисление жирных кислот в печени снижается, что приводит к гипертриглицеридемии, гипергликемии, усугубляя ИР и завершая порочный круг СПЯ, ожирения и дислипидемии. Вследствие этого остается неясной первоначальная причина ИР при СПЯ. Считается, что ИР является эндогенной, но может прогрессировать при наличии ожирения [8]. С одной стороны, у пациенток с СПЯ и ожирением в ответ на введение инсулина отмечаются пониженная утилизация глюкозы и липолиз [24], но с другой — аналогичные результаты наблюдались также у женщин с СПЯ при отсутствии ожирения, НТГ, что подтверждает эндогенный генез ИР[1] [25]. С учетом сложности патогенеза заболевания первой линией терапии, согласно клиническим рекомендациям, остаются симптоматическая терапия, в частности комбинированные оральные контрацептивы, стимуляция овуляции и программы вспомогательных репродуктивных технологий (ВРТ) [26, 27]. Разработка патогенетически обоснованной терапии остается приоритетным направлением исследований по СПЯ. С учетом значимой роли ИР инсулиносенситайзеры также входят в современные протоколы ведения пациенток с СПЯ, и в частности их наиболее изученный представитель метформин, хотя его эффективность в отношении регуляции цикла составляет лишь 27–53% [28]. Другим лимитирующим фактором метформина являются побочные эффекты, возникающие, по разным данным, в 60–74% случаев, включая боль в животе, тошноту, рвоту, диарею, потерю аппетита, метеоризм, что снижает комплаентность [27, 29]. Вследствие этого в последние годы один из основных векторов научных исследований направлен на изучение новых звеньев регуляции углеводного обмена и поиск точек терапевтического воздействия на ИР с меньшим количеством побочных эффектов. Одними из таковых стали миоинозитол (МИ), D-хироинозитол (ДХИ) и α-липоевая кислота (АЛК) (см. рисунок).
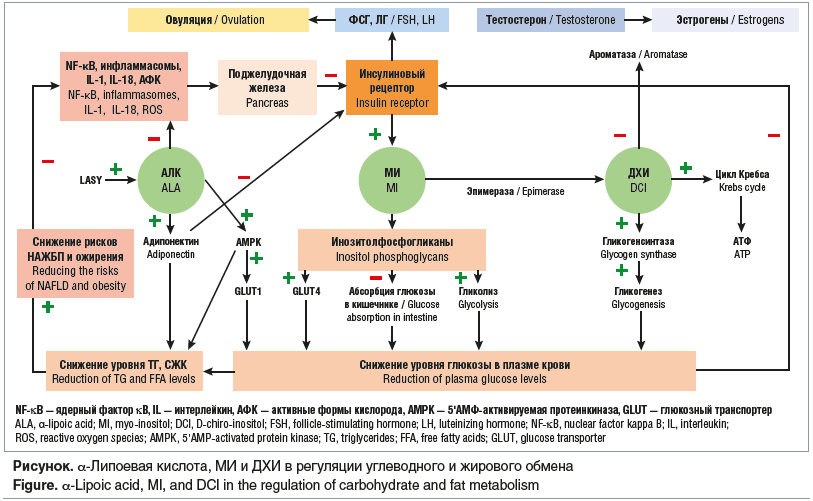
Роль инозитолов в сигналинге инсулина
Инозитол — вторичный мессенджер инсулина, передающий сигнал от инсулинового рецептора к таргетным генам и регулирующий метаболизм глюкозы. В настоящее время установлено участие инозитола в регуляции таких физиологических процессов, как оплодотворение, оогенез, эмбриогенез, регенеративные процессы и жировой обмен [30, 31]. Инозитол представлен в виде девяти стереоизомеров, наиболее биологически важными из которых считаются МИ и ДХИ. В небольшом количестве МИ синтезируется в печени, головном мозге, почках, яичках, молочной железе, но в основном поступает с пищей [31]. При взаимодействии инсулина с рецептором активируется внутриклеточный синтез МИ, а также его метаболитов. Одними из них являются инозитолфосфогликаны, которые подавляют всасывание глюкозы в двенадцатиперстной кишке, участвуют в поглощении глюкозы клетками, индуцируя транслокацию белков — переносчиков глюкозы (в частности, GLUT4) через клеточную мембрану, тем самым снижая уровень глюкозы в крови [8, 32, 33]. Другой метаболит — ДХИ, который стимулирует гликогенсинтазу, ключевой фермент, трансформирующий глюкозу в гликоген. ДХИ способствует включению глюкозы в цикл Кребса, приводящему к синтезу АТФ, тем самым играя ключевую роль в энергетическом обмене [34, 35].
Как МИ, так и ДХИ проявляют инсулиномиметические свойства, снижая уровень глюкозы в крови после приема пищи, однако их действие разнонаправленно. При воздействии ДХИ метаболизм глюкозы смещается в сторону гликогенеза, МИ — в сторону гликолиза и поглощения глюкозы клетками. Существует и обратная взаимосвязь — при ГИ и ИР синтез инозитолов снижается [8, 36]. С учетом их различных функций, для адекватной передачи сигналов инсулина необходимо определенное соотношение МИ и ДХИ в цитоплазме клеток конкретной ткани, соответствующее ее метаболической активности [30, 37]. ДХИ индуцирует гликогенез, поэтому его концентрация выше в тканях, депонирующих гликоген, включая печень, жировую ткань, мышцы, и ниже — в активно использующих глюкозу [30]. И напротив, вследствие способности МИ индуцировать поступление глюкозы в клетки его концентрация выше в органах с высоким энергетическим потреблением, в частности в яичниках. Так, например, в фолликулярной жидкости соотношение МИ и ДХИ составляет 100:1, тогда как в плазме крови — лишь 40:1 [38–40]. Конвертация МИ в ДХИ происходит под действием фермента эпимеразы, активность которой инсулинозависима. В ответ на ГИ в тека-клетках яичников отмечается повышение активности эпимеразы, что приводит к чрезмерной конвертации МИ в ДХИ со снижением соотношения МИ и ДХИ до 0,2:1, что в конечном итоге и нарушает передачу сигнала инсулина. Таким образом, при СПЯ может наблюдаться не только снижение содержания МИ, но и избыток ДХИ [34, 40, 41].
Функции АЛК в углеводном обмене
Помимо инозитолов, не менее важным посредником инсулина выступает АЛК. Это производное жирных кислот, синтезируемое в митохондриях, обладающее выраженным противовоспалительным и антиоксидантным действием, а также играющее важную роль в регуляции углеводного и жирового обмена [42–45]. Основной механизм инсулиноподобного действия АЛК заключается в индукции ею фермента АМPK на плазматической мембране адипоцитов, скелетных мышцах и печени, что приводит к транслокации белков — переносчиков глюкозы GLUT4 и GLUT1. Эти белки транспортируют глюкозу в клетки, тем самым опосредуют эффект инсулина, снижают уровень глюкозы плазмы и ГИ [46]. АМРК также ингибирует синтез СЖК и их накопление в адипоцитах и печени [46, 47]. Во-вторых, АЛК и ее метаболиты являются мощными антиоксидантами и супрессорами воспаления, опосредованного сигнальным путем NF-κB. АЛК блокирует транслокацию NF-κB в ядро, снижая высвобождение провоспалительных цитокинов. Таким образом, АЛК оказывает противовоспалительное и иммуномодулирующее влияние на β-клетки поджелудочной железы, синтезирующие инсулин [48, 49]. В серии исследований было показано, что АЛК снижает выработку ряда активных веществ, вызывающих пироптоз (особый вид программируемой клеточной гибели) и повреждающих β-клетки поджелудочной железы, а также оказывает ингибирующее влияние на воспалительные факторы, включая инфламмасомы, IL-1, IL-18, олеиновую кислоту и АФК. Захват АФК АЛК и ее метаболитами стимулирует выработку антиоксидантных ферментов глутатионпероксидазы и супероксиддисмутазы 1, защищая клетку от окислительного повреждения [49–51]. Таким образом, АЛК снижает секрецию инсулина и повышает чувствительность к нему, что является компенсаторным механизмом, защищающим β-клетки от истощения и оказывающим протективный эффект в отношении формирования ИР и СД [52, 53]. Соответственно дефицит АЛК ассоциирован с нарушением поглощения глюкозы клетками, а следовательно, способствует индукции системной ИР [54]. Это подтверждается тем, что у пациентов с ИР наблюдается дефицит фермента синтазы липоевой кислоты (LASY), ответственного за синтез АЛК. Дефицит LASY приводит к снижению концентрации АЛК, затем AMPK, GLUT4, снижению поглощения глюкозы, а соответственно, к ИР [54]. При комбинированном дефиците LASY и эпимеразы, ответственной за конверсию МИ и ДХИ, риск развития ГИ и СД повышается в еще большей степени [54]. Кроме того, поскольку основной источник инозитолов экзогенный (алиментарный), то АЛК синтезируется внутриклеточно и представляет собой своего рода «резервную систему» транслокации глюкозы при недостаточной концентрации МИ. На основании вышесказанного можно заключить, что для нормального функционирования яичников необходимо восстановление физиологических концентраций и соотношения всех участников передачи сигнала инсулина, включая МИ, ДХИ и АЛК [30, 39].
Роль вторичных мессенджеров инсулина в терапии СПЯ
За последние годы накоплен существенный пул исследований, изучавших терапевтические механизмы и эффективность медиаторов инсулина. Известно, что у пациенток с СПЯ МИ индуцирует транслокацию глюкозы в клетки, снижая ее уровень в крови и тем самым компенсируя ГИ, а также повышает чувствительность яичников к ФСГ. Это улучшает энергообмен ооцитов, повышает мейотическую активность, качество ооцитов и регулирует менструальный цикл [55]. Восстановление менструальной функции происходит за счет нормализации гипоталамо-гипофизарно-яичниковой оси, ввиду снижения ГИ и гиперандрогении, а также снижения активности эпимеразы в тека-клетках яичников у женщин с СПЯ [55]. Дотация МИ и ДХИ может улучшать оогенез, качество ооцитов и эмбрионов, что продемонстрировано в программах ВРТ, в которых требовалась меньшая суммарная доза гонадотропинов и были короче протоколы стимуляции [56, 57]. Помимо этого, восстановление чувствительности тканей к инсулину при приеме инозитола является ключевым механизмом улучшения метаболических показателей, ассоциированных с ИР. В многочисленных исследованиях [58, 59] показано, что применение добавок МИ и ДХИ увеличивает внутриклеточную концентрацию фосфогликанов инозитола, снижает уровень инсулина и индекс HOMА. При этом инозитолы не вызывали побочных эффектов в отличие от препаратов группы бигуанидов. Вследствие вышеуказанного инозитол был включен в международные клинические протоколы по СПЯ, в том числе наиболее актуальные на данный момент рекомендации 2023 г. Европейского общества по репродукции человека и эмбриологии (ESHRE) [27], как рекомендованная терапия при СПЯ. Систематический Кохрейновский обзор, проанализировавший 42 рандомизированных клинических исследования (РКИ) эффективности различных инсулиносенситайзеров, заключил, что терапия ДХИ повышала вероятность овуляции в 3,57 раза, в то время как метформин — лишь в 1,72 раза. Однако авторы указывают, что необходимы дальнейшие исследования для повышения достоверности результатов [60, 61]. Кроме того, существуют обратные данные, что монотерапия ДХИ ассоциирована с негативным влиянием на активность фермента ароматазы и еще большим увеличением продукции андрогенов яичниками [62, 63].
При этом комбинация МИ и ДХИ продемонстрировала высокую эффективность в многочисленных исследованиях. Их прием в течение 3–6 мес. может восстанавливать овуляторный менструальный цикл, снижать содержание биомаркеров оксидативного стресса, нормализовать гормональный профиль у женщин с СПЯ, включая уровень андрогенов и ЛГ, а также метаболические показатели: ИР, глюкозу, инсулин, индекс HOMA, ИМТ [64–68]. В работе О.А. Пустотиной [69] на фоне трехмесячного курса приема комбинации МИ и ДХИ в соотношении 40:1 отмечено статистически значимое снижение ИМТ, ИР и количества пациенток с ГИ в 2,4 раза, а также уровней общего тестостерона в 1,3 раза, свободного тестостерона в 1,45 раза.
Наибольшая эффективность данного соотношения была доказана в ряде научных публикаций. Так, в исследовании на мышах продемонстрировано, что применение МИ и ДХИ в соотношении 40:1 приводило к более быстрому регрессу морфологических изменений яичников и восстановлению фертильности при СПЯ по сравнению с концентрациями 5:1; 20:1; 80:1, а более высокое содержание ДХИ негативно влияло на структуру яичников [70]. В исследовании M. Nordio et al. [71] проводилось сравнение эффективности различных концентраций МИ и ДХИ (1:3,5; 2,5:1; 5:1; 20:1; 40:1, 80:1) при СПЯ в течение 3 мес. У пациенток, получавших МИ и ДХИ в соотношении 40:1, наблюдалось наиболее выраженное, по сравнению с другими, снижение уровня ЛГ, тестостерона, инсулина и индекса HOMA, а в 62,5% случаев отмечена нормализация ритма менструального цикла. Схожие результаты получены в плацебо-контролируемом исследовании E. Benelli et al. [72], где отмечается, что прием комбинации МИ и ДХИ в соотношении 40:1 в течение 6 мес. приводил к снижению уровня ЛГ, свободного тестостерона, инсулина натощак и индекса HOMA. На основании данных результатов, согласно консенсусному заключению экспертов по терапии СПЯ и инсулинонезависимого СД инозитолом «The Expert Group on Inositol», прием МИ и ДХИ в соотношении 40:1 служит важным фактором нормализации их соотношения в фолликулярной жидкости и функции яичников у женщин с СПЯ [41].
Наличие множества крупных исследований позволило совету экспертов сделать также заключение об эффективности АЛК и рекомендовать рассмотрение ее в качестве перспективного терапевтического средства при эндокринных заболеваниях, ассоциированных с ИР, в частности СПЯ [54]. Так, например, в работе U. Masharani et al. [44] проводилась монотерапия АЛК пациенток с СПЯ без ожирения и НТГ. Ключевым преимуществом данной работы была оценка ИР с помощью гиперинсулинемического эугликемического клэмп-теста. После 16 нед. терапии отмечено статистически значимое повышение чувствительности к инсулину и захвата глюкозы, а также снижение уровня ТГ, что указывает также на антиатерогенное действие АЛК. Эффективность АЛК при СПЯ подтверждается результатами наиболее крупного и актуального на сегодняшний день систематического обзора и метаанализа 2024 г. Согласно его данным, прием АЛК приводит к снижению уровня глюкозы натощак (стандартизованная разность средних (SMD) -0,60), индекса НОМА (SMD -2,03), инсулина (SMD -0,74), ЛГ в первые 12 нед. (SMD -5,09). Полученные данные, по мнению авторов, могут указывать на перспективность применения АЛК при СПЯ, однако требуются более подробные исследования с оценкой дозы и длительности терапии [73]. Ряд метаанализов продемонстрировал, что АЛК способствует небольшому, но статистически значимому снижению массы тела и ИМТ по сравнению с плацебо. Это указывает на то, что АЛК влияет на важные патогенетические звенья нарушенного углеводного обмена, но для нормализации массы тела ключевым элементом остается формирование стойкого дефицита калорий [74, 75].
В научной литературе большая часть исследований описывает влияние АЛК при СПЯ при совместном приеме с МИ. A.D. Genazzani et al. [76] оценивали эффективность комбинации 400 мг АЛК и 1 г МИ в течение 12 нед. у пациенток с СПЯ и ожирением. Результаты продемонстрировали снижение ИМТ, а также уровня ТГ, инсулина и глюкозы натощак и после углеводной нагрузки в рамках глюкозотолерантного теста. Причем МИ и АЛК модулируют различные части сигналинга инсулина, которые по-разному контролируют активность ЛГ и GLUT4 [13, 77]. В недавнем исследовании A.D. Genazzani et al. [77] сравнили эффективность МИ, АЛК и их комбинации у пациенток с СПЯ и избыточной массой тела. Пациентки во всех группах продемонстрировали положительный эффект: МИ значительно снизил уровень ЛГ, умеренно — инсулина, индекса HOMA; АЛК в большей степени улучшала показатели инсулина, индекса НОМА и ИМТ, существенно не влияя на ЛГ; тогда как комбинация МИ и АЛК влияла как на метаболический, так и на гормональный профиль [77]. В других работах у пациенток с СПЯ на фоне приема МИ и АЛК также продемонстрировано укорочение менструального цикла, снижение ИМТ, индекса НОМА [78]. Синергический эффект МИ и АЛК может быть объяснен восстановлением различных механизмов передачи сигнала от инсулина к рецептору, а далее восстановлением пульсовой секреции ГнрГ, нормализацией секреции гонадотропинов и половых стероидов, в частности андрогенов [13]. По данным многочисленных исследований, у пациенток с СПЯ и ожирением при приеме МИ в комбинации с АЛК в течение 3 мес. наблюдалось укорочение цикла в среднем в 1,7–2,0 раза, тогда как полное восстановление менструального цикла отмечено у 24–51% пациенток. Также отмечено снижение других метаболических показателей: инсулина на 34–36%, глюкозы на 5,3–11%, индекса НОМА на 30–45%, ИМТ на 4,5–8,1%, липопротеинов низкой плотности (ЛПНП) на 5,5% и повышение уровня липопротеинов высокой плотности (ЛПВП) на 12,8%, наблюдались морфологические изменения, включая уменьшение объема яичников и числа антральных фолликулов [78, 79]. Примечательно, что у пациенток без признаков ГИ, НТГ и с нормальным индексом НОМА наблюдалось менее выраженное изменение вышеуказанных показателей [79, 80].
Помимо регуляции углеводного обмена, есть данные, что у пациенток с наследственной предрасположенностью к СД и с повышенным риском НАЖБП на фоне приема АЛК также наблюдалась нормализация уровней АЛТ и АСТ, что свидетельствует о положительном влиянии АЛК на функцию печени [81–83]. В исследовании H. Tutunchi et al. [23] оценивалось влияние МИ и АЛК на метаболические показатели у пациентов с НАЖБП. В работе отмечалось, что на фоне приема МИ в течение 3 мес. наблюдалось снижение уровней глюкозы, АЛТ, АСТ, общего холестерина и индекса НОМА, тогда как в группе АЛК отмечалось снижение показателей ЛПНП и АЛТ. Кроме того, систематический обзор и метаанализ [84] 14 РКИ с участием пациенток с СПЯ и другими метаболическими расстройствами продемонстрировал благоприятное влияние МИ на концентрации ТГ, холестерина и ЛПНП в сыворотке крови. А в РКИ I. Capasso et al. [85] на фоне 6-месячной комбинированной терапии МИ и АЛК отмечено снижение индекса HOMA более чем на 20% у 66,7% пациенток с метаболическим синдромом, уровня инсулина — у 89,3%, ТГ — у 43,2% и повышение уровня ЛПВП на 48,6% по сравнению с группой, принимавшей плацебо. Одним из предполагаемых механизмов улучшения липидного профиля под действием АЛК, по-видимому, является коррекция ИР как одного из важнейших факторов риска НАЖБП. Но также значимым фактором выступает способность АЛК повышать активность липопротеинлипазы и лецитин-холестеринацилтрансферазы, участвующих в липолизе и синтезе ТГ, повышении активности AMPK и снижении окисления липидов, благодаря своим антиоксидантным и противовоспалительным свойствам. Кроме того, АЛК подавляет дифференцировку адипоцитов, а также регулируют секрецию адипокинов и лептина, которые играют важную роль в формировании жирового гепатоза [23, 86].
На основании вышеизложенного можно сделать вывод о важной и взаимодополняющей роли МИ, ДХИ и АЛК в передаче сигнала инсулина, коррекции ИР и ГИ. Как показали крупные систематические обзоры и метаанализы, дотация данных элементов может приводить к статистически значимому улучшению показателей углеводного и липидного обмена, и, как следствие, облегчению клинической симптоматики у пациенток с СПЯ. В России зарегистрирована биологически активная добавка (БАД) Дифертон, содержащая в двух таблетках (суточная доза) инозит 1127,6 мг, включая МИ 1100 мг, ДХИ 27,6 мг, АЛК 75 мг, которая показана к применению женщинам с СПЯ, а также с нарушенной чувствительностью к инсулину[2].
Собственный опыт терапии комбинацией МИ, ДХИ и АЛК пациенток с СПЯ
В рамках апробации терапии комбинацией МИ, ДХИ и АЛК на базе ФГБУ «НМИЦ АГП им В.И. Кулакова» Минздрава России в отделении гинекологической эндокринологии БАД Дифертон в течение 3 мес. применялась у пациенток с диагнозом СПЯ, которым не требовалась контрацепция. Диагноз СПЯ установлен на основании Роттердамских критериев, в соответствии с клиническими рекомендациями РОАГ (2021). На фоне лечения у всех пациенток оценивали клинический эффект, показатели гормонов (ФСГ, ЛГ, тестостерон общий), липидограммы, индекс HOMA, а также содержание печеночных ферментов (АЛТ, АСТ, щелочная фосфатаза).
Пациентка К., 21 год. На момент обращения менструации нерегулярные, через 35–45 дней, в среднем 40 дней, ИМТ 28,5 кг/м2 (избыточная масса тела). Уровень гормонов исходно на 3-й день менструального цикла (д.м.ц.): ФСГ 6,2 мМЕд/мл, ЛГ 13,2 мМЕд/мл, тестостерон 1,54 нмоль/л, что не превышало пороговых значений. Индекс НОМА был повышен и составил 2,8, тогда как уровень ТГ — 1,5 ммоль/л, ЛПНП — 3,1 ммоль/л и ЛПВП — 0,9 ммоль/л, т. е. были в норме. Через 3 мес. терапии Дифертоном отмечено укорочение менструального цикла в среднем на 4 дня, до 36 дней, что соответствует нормальным значениям, снижение уровня ЛГ до 9,4 мМЕд/мл, индекса НОМА до 2,2. Отмечались также изменения липидного профиля: уровень ТГ снизился до 1,4 ммоль/л, ЛПНП — до 2,8 ммоль/л и ЛПВП — до 1,1 ммоль/л. На фоне рационализации питания и терапии ИМТ также снизился до 25,1 кг/м2.
Пациентка Л., 19 лет. Нарушение ритма менструации — через 32–47 дней, в среднем 38 дней, избыточная масса тела (ИМТ 26,5 кг/м2). Исходный уровень гормонов на 3-й д.м.ц.: ФСГ 5,4 мМЕд/мл, ЛГ 9,8 мМЕд/мл, тестостерон повышен до 1,96 нмоль/л. Индекс НОМА, уровни ТГ, ЛПНП и ЛПВП были в рамках референтной нормы. Через 3 мес. приема Дифертона менструальный цикл сократился на 5 дней, до 33 дней, что соответствует норме, уровни ФСГ, ЛГ, индекс НОМА без существенной динамики, уровень тестостерона нормализовался и составил 1,65 нмоль/л. Отмечено также снижение ИМТ до 25,2 кг/м2.
Пациентка Б., 25 лет. Поликистозное строение яичников по данным УЗИ, олигоменорея, гиперандрогения, акне. Менструации через 32–67 дней, в среднем 45 дней, ИМТ 32,1 кг/м2, что соответствует ожирению I степени. Уровень гормонов до старта терапии на 2-й д.м.ц.: ФСГ 8,3 мМЕд/мл, ЛГ 18,4 мМЕд/мл, тестостерон 2,1 нмоль/л. Индекс НОМА 2,7. Показатели жирового обмена также были нарушены: ТГ 1,6 ммоль/л, ЛПНП 3,3 ммоль/л и ЛПВП 0,8 ммоль/л. В течение 3 мес. приема Дифертона цикл укоротился на 4 дня и составил 41 день, уровень ЛГ составил 12,9 мМЕд/мл, индекс НОМА также снизился до 1,5, концентрация ТГ составила 1,5 ммоль/л, ЛПНП — 3,0 ммоль/л и ЛПВП — 0,9 ммоль/л. Уровень тестостерона снизился до 1,81 нмоль/л, но оставался выше референтных значений, что, вероятно, связано с сохраняющимся избытком жировой ткани. ИМТ через 3 мес. составил 29,8 кг/м2.
На основе полученных результатов терапии Дифертоном можно отметить тенденцию к укорочению менструального цикла, что привело к его нормализации у двух пациенток за 3 мес. лечения. Также констатировали снижение массы тела, уровней ЛГ, общего тестостерона, ТГ, ЛПНП, индекса НОМА и повышение — ЛПВП, при этом ни в одном случае не отмечено побочных эффектов. Ни у одной из пациенток исходно не отмечалось повышение уровня печеночных трансаминаз. Необходимо дальнейшее наблюдение для уточнения эффекта от более длительной терапии.
Заключение
Обобщая данные литературы, можно заключить, что изучение новых патогенетических звеньев ИР является ключевым в вопросах разработки новых патогенетически обоснованных методов терапии СПЯ. Инозитол является сенсибилизатором инсулина и реализует его разнонаправленные эффекты через стереоизомеры МИ и ДХИ, модулируя поглощение глюкозы клетками и синтез гликогена. АЛК — важный регулятор транслокации глюкозы в клетке, антиоксидант и противовоспалительный фактор. Комбинация МИ, ДХИ и АЛК оказывает синергическое влияние, снижающее ИР у пациенток с СПЯ, в том числе при ожирении и избыточной массе тела. Это оказывает положительный фенотипический эффект в виде регуляции менструального цикла, восстановления овуляции и снижения уровня андрогенов, а также улучшения показателей углеводного и жирового обмена, ускорения снижения массы тела, тем самым уменьшая риски ССЗ, НАЖБ и СД2. Ѓ
СВЕДЕНИЯ ОБ АВТОРАХ:
Иванов Илья Андреевич — к.м.н., научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0003-0751-7566.
Табеева Гюзяль Искандеровна — к.м.н., старший научный сотрудник отделения гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0003-1498-6520.
Сметник Антонина Александровна — к.м.н., президент Российского общества специалистов по гинекологической эндокринологии и менопаузе; заведующая отделением гинекологической эндокринологии ФГБУ «НМИЦ
АГП им. В.И. Кулакова» Минздрава России; 117997, Россия, г. Москва, ул. Академика Опарина, д. 4; ORCID iD 0000-0002-0627-3902.
Контактная информация: Иванов Илья Александрович, e-mail: doctor.i.ivanov@yandex.ru.
Прозрачность финансовой деятельности: никто из авто-
ров не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.03.2024.
Поступила после рецензирования 28.03.2024.
Принята в печать 22.04.2024.
ABOUT THE AUTHORS:
Ilya A. Ivanov — C. Sc. (Med.), researcher of the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-0751-7566.
Gyuzyal’ I. Tabeeva — C. Sc. (Med.), senior researcher of the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-1498-6520.
Antonina A. Smetnik — C. Sc. (Med.), President of the Russian Society of Experts in Gynecological Endocrinology and Menopause; Head the Department of Gynecological Endocrinology, V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology; 4, Academician Oparin str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-0627-3902.
Contact information: Ilya A. Ivanov, e-mail: doctor.i.ivanov@yandex.ru.
Financial Disclosure: no authors have a financial or property
interest in any material or method mentioned.
There is no conflict of interest.
Received 01.03.2024.
Revised 28.03.2024.
Accepted 22.04.2024.
Информация с rmj.ru



