Содержание статьи
Введение
Внутрипеченочный холестаз беременных (ВХБ) (син.: холестатический гепатоз) — это обратимая форма холестаза, характерная для беременности и проявляющаяся интенсивным кожным зудом, повышением уровня желчных кислот в сыворотке крови и/или ферментов печени, со спонтанным разрешением в послеродовом периоде (как правило, в течение 2–6 нед.) при отсутствии альтернативных причин. ВХБ осложняет течение 0,7% всех беременностей в мультиэтнической популяции [1]. Патогенез ВХБ связан с генетическими, гормональными факторами, а также воздействием окружающей среды. Например, у женщин Индо-Азиатского и Пакистано-Азиатского регионов ВХБ осложняет течение 1,2–1,5% беременностей, в Чили — 2,4%, в Скандинавских странах — 2,8%, а наибольшая частота ВХБ в мире наблюдается у беременных араукано-
индейской народности. В странах Европы распространенность ВХБ составляет менее 1% [2].
Факторами риска развития ВХБ являются наследственность, хронические заболевания печени, в т. ч. гепатит С и желчнокаменная болезнь, прием медикаментов, многоплодная беременность, индуцированная беременность (экстракорпоральное оплодотворение) [3]. Наиболее значимыми факторами риска являются наследственная предрасположенность и ВХБ в анамнезе. В таких случаях частота развития ВХБ в последующие беременности составляет 45–90% [2].
Диагностика ВХБ
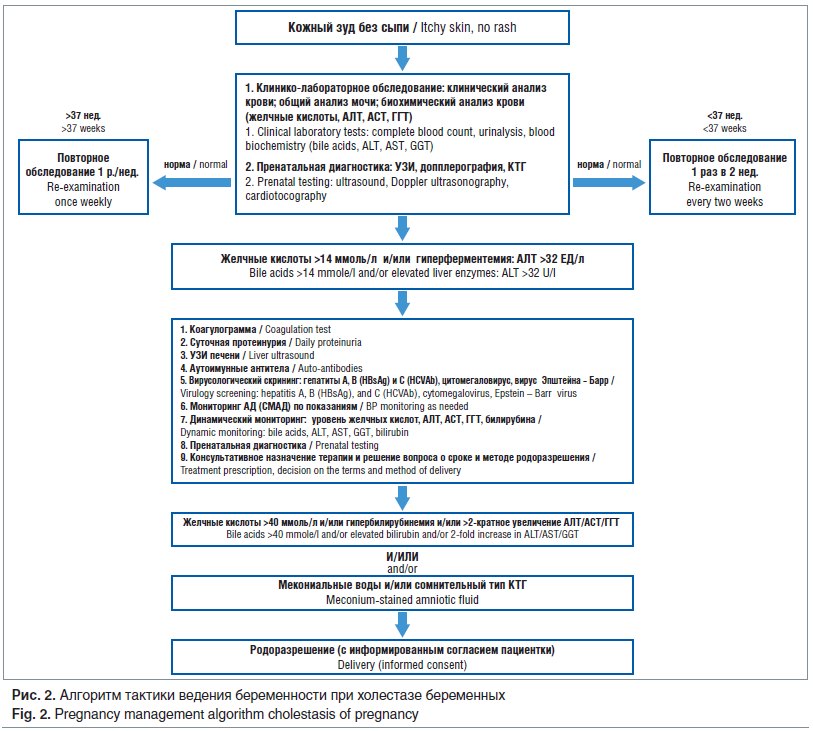
Диагностика ВХБ основывается на анализе клинической картины, лабораторных и инструментальных исследованиях [4]. Критериями диагноза являются наличие кожного зуда (который не может быть объяснен другими причинами) и повышение уровня ферментов печени и желчных кислот в сыворотке крови. При ВХБ зуд возникает у 23% беременных, как правило, после 24 нед. и нередко в течение длительного времени остается единственным симптомом. Типичная локализация зуда — ладони, стопы, живот, где, как правило, выявляются расчесы. Интенсивность зуда возрастает в ночное время, поскольку процесс желчеобразования непрерывен, и в ночной период суток практически весь пул желчных кислот (около 4 г) остается в желчном пузыре. Это снижает качество жизни беременных. Зуд может появиться за несколько дней до изменений биохимических маркеров функции печени [5]. В 10% случаев наблюдается легкая желтуха за счет конъюгированного билирубина. Крайне редкими симптомами холестаза являются светлый стул (стеаторея) и темная моча. Однако ВХБ не является доминирующей причиной желтухи и зуда, и с целью исключения других причин необходимо проведение дополнительных исследований [4].
Ранними лабораторными (биохимическими) маркерами и основанием для постановки диагноза при бессимптомном течении ВХБ является повышение концентрации в сыворотке крови желчных кислот и/или ферментов печени, а в дальнейшем конъюгированного билирубина. У большинства беременных отмечается увеличение 1–2 ферментов печени [5]. Уровень желчных кислот является самым чувствительным маркером ВХБ и может повышаться до изменения других печеночных проб. Во время беременности уровень желчных кислот в сыворотке крови остается в пределах нормы для небеременных, но может несколько повышаться в III триместре за счет изменения метаболизма желчных кислот в результате высоких уровней циркулирующих эстрогенов и прогестерона и свидетельствовать о риске развития холестаза при нормальной беременности. Изолированное повышение сывороточного уровня желчных кислот и билирубина встречается редко, однако нормальные концентрации не исключают диагноз ВХБ. Оценка концентрации желчных кислот и ферментов печени должна проводиться с учетом референсных значений для беременных строго натощак, т. к. уровень желчных кислот в плазме крови значительно увеличивается после приема пищи. Верхняя граница физиологических значений печеночных проб у беременных на 20% ниже, чем у небеременных. Нормальными показателями биохимических параметров следует считать концентрацию желчных кислот <14 мкмоль/л, концентрацию аланинаминотрансферазы (АЛТ) <32 МЕ/л [4, 5].
Дифференциальный диагноз ВХБ
Дифференциальный диагноз ВХБ необходимо проводить с кожными болезнями, в т. ч. экземой, атопическим дерматитом, пиодермией, фолликулитом и др.; осложнениями беременности: преэклампсией, HELLP-синдромом [Н (hemolysis) — внутрисосудистый гемолиз, EL (elevated liver enzimes) — повышение печеночных ферментов, LP (low platelet count) — снижение уровня тромбоцитов], острой жировой дистрофией печени; желчнокаменной болезнью; гепатитами А, В, С; инфекционным мононуклеозом (вирус Эпштейна — Барр) и цитомегаловирусной инфекцией; первичным билиарным циррозом (антимитохондриальные антитела, антитела к гладкомышечным волокнам) (табл. 1) [6].
Отдельного рассмотрения заслуживают случаи лекарственного холестаза, встречающиеся с частотой от 1 случая на 10 000 до 1 случая на 100 000 пациентов, принимающих лекарства в терапевтических дозах (рис. 1) [5, 6].
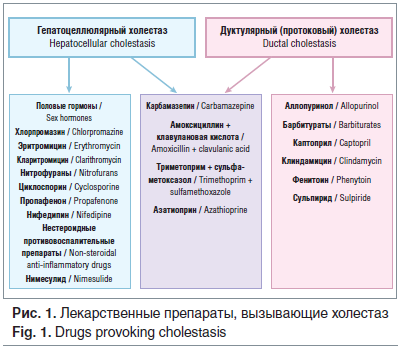
Лекарственные поражения печени (ЛПП) могут быть обусловлены ингибированием экспрессии и/или функции гепатобилиарных транспортеров, приводящим к нарушению секреции желчи на гепатоцеллюлярном уровне, либо индукцией воспаления по типу идиосинкразии или гиперчувствительности на холангиоцеллюлярном уровне. Индивидуальная чувствительность к развитию холестаза под действием различных лекарственных препаратов может быть обусловлена генетически детерминированной экспрессией гепатобилиарных транспортеров и энзимов, участвующих в реакциях биотрансформации. ЛПП принято подразделять в зависимости от уровня повышения основных печеночных проб на гепатоцеллюлярные, холестатические и смешанные. Если уровень АЛТ повышен более чем в 5 раз от верхней границы нормы и индекс R (отношение АЛТ к щелочной фосфатазе (ЩФ)) ≥5, то следует предполагать гепатоцеллюлярное поражение печени. Повышение уровня ЩФ более чем в 2 раза и индекс R≤2 свидетельствуют о холестатическом поражении печени. Доля холестатических поражений печени среди всех лекарственных гепатопатий составляет около 30%. Как правило, холестатические ЛПП протекают легче, чем гепатоцеллюлярные, но разрешаются значительно медленнее. При смешанном ЛПП отмечается одновременное повышение уровней АЛТ и ЩФ более чем в 2 раза от верхней границы нормы, а индекса R — от 2 до 5 [6].
При диагностированном ЛПП рекомендуется прекращение приема препарата и тщательное наблюдение за клинической симптоматикой и биохимическими показателями (III/С2). Применение урсодезоксихолевой кислоты (УДХК) и кортикостероидов при ЛПП часто бывает эффективно, однако доказательная база в виде контролируемых исследований отсутствует (III/С2) [6].
Мониторинг холестаза беременных
При постановке диагноза ВХБ мониторирование концентрации печеночных ферментов и/или желчных кислот должно проводиться не реже 1 р./нед. до родоразрешения. В случаях персистирующего зуда и нормальных биохимических показателей необходимо проведение повторного анализа печеночных ферментов и желчных кислот не реже 1 р./нед. до появления патологических результатов или прекращения зуда [5]. Возвращение концентрации печеночных ферментов к нормальным значениям, вероятно, свидетельствует о неправильном диагнозе ВХБ.
Клиническое значение и перинатальные риски при беременности, осложненной ВХБ
Развитие ВХБ связано с потенциальным риском преждевременных родов (4–12%), в первую очередь ятрогенных (7–25%), увеличением частоты кесарева сечения
(с 10 до 36%), пассажа мекония (при доношенной беременности до 25–44,3% в сравнении с 7,6–12% в популяции, при недоношенной — до 18 при 3% соответственно) и послеродовых кровотечений (с 2 до 22%) [7, 8]. Риск перинатальных осложнений, в т. ч. преждевременных родов, мекониального пассажа и асфиксии плода, значительно повышается при раннем начале зуда (до 34 нед. беременности) и концентрации желчных кислот >40 мкмоль/л [9]. Так, частота мекониального пассажа возрастает линейно на 19,7% при увеличении концентрации желчных кислот на каждые 10 мкмоль/л и при концентрации желчных кислот >40 мкмоль/л составляет 10–44%. Риск мертворождения при развитии ВХБ составляет 0–11‰, при этом более 70% случаев наблюдаются до 37 нед. беременности [7–10]. Достоверные биохимические критерии и специфические методы антенатального мониторинга плода, прогнозирующие мертворождение, отсутствуют. Гибель плода при ВХБ, как правило, внезапная и не имеет связи с критериями плацентарной недостаточности, в т. ч. с задержкой роста плода, маловодием и патологическими параметрами допплерометрии.
Мониторинг состояния плода включает субъективную оценку шевеления плода, данные ультразвуковой эхографии, кардиотокографии (КТГ), амниоскопии (с 36–37 нед. при установленном диагнозе ВХБ). Прогностическая ценность ультразвуковой эхографии и КТГ в отношении оценки состояния плода и перинатального исхода при холестазе слабая [11].
Родоразрешение при ВХБ
При ВХБ показана дородовая госпитализация в 36 нед. с целью решения вопроса о времени и методе родоразрешения, в т. ч. об индукции родов. Доказательных данных о необходимости досрочного родоразрешения при ВХБ нет, однако существует практика индукции родов при тяжелых формах холестаза с выраженной гиперферментемией и концентрацией желчных кислот >40 мкмоль/л [5, 7]. При обсуждении вопроса о родоразрешении необходимо предупредить о невозможности точного прогнозирования перинатальных осложнений при ВХБ и целесообразности досрочного родоразрешения с целью снижения риска мертворождения. Также необходимо предупредить о риске проведения интенсивной терапии новорожденным. Так, частота госпитализации в отделение реанимации и интенсивной терапии новорожденных при досрочной индукции родов в 37 нед. составляет 7–11%, в 38 нед.— 6% и в 39 нед.— 1,5%. Решение о родоразрешении должно основываться не только на лабораторных результатах, но и на других факторах риска, т. к. сильной корреляции уровня печеночных ферментов и исхода для плода не выявлено. Принятие окончательного решения о времени и методе родоразрешения возможно только после полного информирования беременной о рисках для плода при индукции родов и возможном ухудшении состояния плода при пролонгировании беременности [5].
Лечение
При развитии зуда или повышении уровня печеночных ферментов необходимо по возможности прервать медикаментозную терапию. В первую очередь исключаются медикаменты, часто вызывающие холестаз, в т. ч. эритромицин, амоксициллин + клавулановая кислота.
Местное лечение. Водорастворимые кремы и гели с ментолом временно уменьшают интенсивность зуда и безопасны при беременности. Однако доказательная база, подтверждающая их эффективность, отсутствует. Возможен кратковременный эффект.
Системная терапия
Урсодезоксихолевая кислота (УДХК) уменьшает интенсивность зуда и нормализует функцию печени. УДХК замещает в желчи более гидрофобные эндогенные желчные кислоты и снижает их повреждающий эффект на мембраны гепатоцитов. УДХК обладает плейотропными свойствами, цитопротективным, антиоксидантным и антифибротическим эффектами, снижает восприимчивость гепатоцитов к воспалительным агентам и нормализует спектр липидов. Комбинация УДХК и витамина E имеет цитопротективный и метаболический эффекты, способствует снижению скорости апоптоза, активности сывороточных трансаминаз, восстанавливает циркулирующий уровень адипонектина [12]. При холестерин-ассоциированной патологии билиарного тракта, в т. ч. билиарном сладже, холецистолитиазе и холестерозе желчного пузыря, заместительная урсотерапия значительно снижает уровень холестерина и приводит к устранению билиарного сладжа. Для лечения клинически манифестных холестатических заболеваний печени у беременных УДХК применяется во II и III триместрах (I/В1). При ВХБ прием УДХК уменьшает выраженность зуда и концентрацию печеночных ферментов (I/В1) [6, 13, 14]. Однако достоверное снижение перинатальной смертности при применении УДХК отсутствует [15]. Рекомендуемая доза составляет 10 мг на 1 кг массы тела в сутки. Начальная доза может составлять 1 г/сут (по 250 мг 4 раза) и быть увеличена до 1,5 г/сут. Принимать препарат целесообразно с приемом пищи или сразу после еды. Побочных эффектов применения УДХК у матерей и новорожденных не зафиксировано [16].
Антигистаминные препараты — блокаторы гистаминовых Н1-рецепторов — могут иметь положительный седативный эффект при приеме на ночь, но не оказывают существенного влияния на интенсивность зуда [16].
Адеметионин образуется из метионина в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой, и участвует в биохимических реакциях
трансметилирования, транссульфатирования, трансаминирования и декарбоксилирования. Реакции метилирования необходимы для синтеза эндогенного фосфатидилхолина в гепатоцитах. В реакциях транссульфатирования адеметионин является предшественником цистеина, таурина, глутатиона. Адеметионин снижает токсичность желчных кислот в гепатоците, осуществляя их конъюгирование и сульфатирование. Конъюгация с таурином повышает растворимость желчных кислот и выведение их из гепатоцита. Процесс сульфатирования желчных кислот способствует их элиминации почками, облегчает прохождение через мембрану гепатоцита и выведение с желчью. Сульфатированные желчные кислоты защищают мембраны клеток печени от токсического действия несульфатированных желчных кислот, в высоких концентрациях присутствующих в гепатоцитах при внутрипеченочном холестазе. В реакциях трансметилирования (85% которых протекает в печени) адеметионин является донором метильной группы для синтеза фосфолипидов клеточных мембран, нейротрансмиттеров, нуклеиновых кислот и белков. При ВХБ адеметионин снижает выраженность кожного зуда и концентрацию ферментов печени. Оказывает холеретическое и гепатопротективное действие, сохраняющееся до 3 мес. после прекращения лечения. Рекомендованная доза и режим введения адеметионина составляет 400–800 мг/сут (1–2 флакона) внутривенно в течение 2 нед. Поддерживающая пероральная терапия — 800–1600 мг/сут в течение 2–4 нед. [5, 16]. Препарат противопоказан в I и II триместрах беременности.
Глюкокортикоиды не являются препаратами терапии холестаза первой линии. Рандомизированные доказательные исследования эффективности препаратов отсутствуют. В некоторых исследованиях рекомендована схема применения дексаметазона по 10 мг перорально в течение 7 дней с перерывом в 3 дня [5, 16]. Использование преднизолона безопасно во II и III триместрах беременности и при лактации, однако при применении в I триместре увеличивается риск развития расщелины твердого неба у детей [6].
Витамин К. ВХБ возникает в результате сниженной абсорбции пищевого жира вследствие недостаточной секреции желчных кислот в ЖКТ и снижения формирования мицелия. Увеличенная экскреция жира при ВХБ может быть субклинической (но с повышенным содержанием жира в кале) или клинической (стеаторея), что влияет на абсорбцию витамина К, который необходим для синтеза факторов II, VII, IX, X. У женщин с жировой мальабсорбцией, в первую очередь при обструкции желчевыводящих путей и заболеваниях печени, может наблюдаться дефицит витамина К. Водорастворимый витамин К (менадиона натрия бисульфит) может применяться при ВХБ и при увеличении протромбинового времени в дозе 5–10 мг/сут с 34 нед. беременности до родоразрешения с целью снижения риска послеродовых кровотечений более чем в 3 раза (III/С2), при этом необходимо соотнести пользу для матери и риск для плода [5, 6]. В случаях холестаза, стеатореи или доказанного низкого уровня жирорастворимых витаминов рекомендуется комплексное применение витаминов А, Е и К (III/С2) [6].
Ведение в послеродовом периоде
Снижение гиперферментемии после родов подтверждает диагноз ВХБ. Родильницам с ВХБ необходимо проведение биохимического анализа крови в течение 7–10 дней после родов с целью подтверждения диагноза, а с целью оценки динамики снижения концентрации печеночных ферментов и/или желчных кислот — через 6 и 8 нед. после родов [5, 16]. Если после родов симптоматика не купируется (или прогрессирует), необходимо провести дифференциальную диагностику с другими хроническими заболеваниями печени, в т. ч. с первичным билиарным циррозом, первичным склерозирующим холангитом, хроническим гепатитом С, при которых кожный зуд может появиться на последних неделях беременности.
Родильницам с ВХБ целесообразно избегать эстрогенсодержащие методы контрацепции, которые провоцируют появление зуда у 10% женщин.
Заключение
Ввиду прогрессивного увеличения возраста беременных и сопутствующей экстрагенитальной патологии вопросы своевременной диагностики нарушений функции печени и желчевыводящих путей и рациональной акушерской тактики являются актуальными и требуют дифференцированного подхода. Некоторые осложнения беременности, в т. ч. преэклампсия, HELLP-синдром, нередко имеют неспецифические симптомы печеночной дисфункции. Таким образом, знание алгоритмов дифференциальной диагностики и акушерской тактики позволяет достоверно уменьшить риски материнской и перинатальной заболеваемости и смертности (рис. 2).
Сведения об авторах:
1Козлов Павел Васильевич — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, врач высшей категории, ORCID iD 0000-0002-9916-6128;
2Самсонова Инна Владимировна — к.м.н., заместитель главного врача по медицинской части, врач высшей категории, ORCID iD 0000-0002-1228-1765.
1ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
2ГБУЗ «ГКБ № 52 ДЗМ». 123182, Россия, г. Москва, ул. Пехотная, д. 3.
Контактная информация: Козлов Павел Васильевич, e-mail:
drkpv@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.08.2019.
About the authors:
1Pavel V. Kozlov — MD, PhD, professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-9916-6128;
2Inna V. Samsonova — MD, PhD, Deputy Head Doctor for Medical Work, ORCID iD 0000-0002-1228-1765.
1Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federa-
tion.
2City Clinical Hospital No. 52. 3, Pekhotnaya str., Moscow, 123182, Russian Federation.
Contact information: Pavel V. Kozlov, e-mail: drkpv@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.08.2019.
Информация с rmj.ru




