Внутриматочная патология у женщин, прошедших первую попытку экстракорпорального оплодотворения и переноса эмбрионов
Е. Б. Рудакова*, доктор медицинских наук, профессор
П. В. Давыдов**
В. В. Давыдов***
*ГУЗ Московский областной перинатальный центр, Балашиха
**ГБОУ ВПО ОмГМА,
***МСЦМ «Евромед», Омск
Среди супружеских пар детородного возраста частота бесплодия в разных регионах России колеблется от 8% до 19% [1, 2]. Проблема бесплодия приобретает не только медицинское, но и социально-демографическое значение. В связи с этим к вспомогательным репродуктивным технологиям (ВРТ) проявляют повышенный интерес не только в России, но и за рубежом.
Повышение эффективности методов ВРТ является одной из важнейших задач современной медицины, решаемой в рамках национального проекта по оказанию высокотехнологичной медицинской помощи «Здоровье».
Эффективность результатов экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов (ПЭ) во многом зависит от функционально полноценного эмбриона на стадии бластоцисты, а также наличия внутриматочной патологии [3, 4]. Правильно функционирующий эндометрий необходим не только для имплантации, являющейся наиболее незащищенным этапом программ ВРТ, но и для вынашивания беременности. В развитии неполноценной имплантации или ее отсутствии имеет значение сочетание действия различных неблагоприятных факторов. Одними из главных причин неполноценной или неудачной имплантации являются поврежденная структура и нарушенная функция эндометрия, которая может иметь две формы: анатомические изменения полости матки и микронарушения в эндометрии. В 54% случаев женское бесплодие сопровождается патологическими изменениями в матке, при этом нарушения функции эндометрия диагностируются у 41% женщин [5]. Поэтому важным при обследовании пациенток с бесплодием и/или привычным невынашиванием беременности является оценка полости матки и эндометрия [6, 7].
Эндометрий представляет собой абсолютно гормонально зависимую ткань как на уровне функционального, так и базального слоев. Нормальное развитие эндометрия и его циклические изменения зависят не только от секреции эстрогенов и прогестерона, но и от экспрессии рецепторов к ним. Комплексная дифференцированная подготовка эндометрия с учетом экспрессии рецепторов позволяет повысить эффективность лечения бесплодия методами ВРТ [5, 8, 9]. Наличие признаков хронического эндометрита (ХЭ) сопровождается снижением экспрессии эстрогеновых и прогестероновых рецепторов [9].
У женщин с бесплодием ХЭ диагностируется в среднем в 10% случаев, у женщин с ХЭ бесплодие встречается в 60% случаев, из которых в 25% — первичное, 36% — вторичное [10].
Женщины, имеющие неудачи по программе ВРТ, в анамнезе должны обязательно обследоваться для исключения ХЭ. Однако парадокс состоит в том, что при использовании «золотого стандарта» для постановки диагноза «хронический эндометрит» — гистологического исследования — необходимо провести инвазивную внутриматочную процедуру, которая сама является фактором риска развития эндометрита. С высокой долей вероятности диагноз «хронический эндометрит» можно поставить и без использования инвазивных процедур [11, 12].
По данным литературных источников, второе место в структуре внутриматочной патологии у женщин, проходящих программы ВРТ, занимают гиперпластические процессы эндометрия [6], которые могут доходить до 55% случаев [13]. Решающим методом диагностики гиперпластических процессов эндометрия является гистологическое изучение полного его соскоба, позволяющее определить характер морфоструктурных изменений. В доклинической диагностике гиперпластических процессов приоритет среди неинвазивных методов диагностики принадлежит УЗИ. Для дифференциальной диагностики полипов эндометрия от миомы матки или гиперплазии эндометрия возможно применение контрастной сонографии [14]. Лечение гиперпластических процессов эндометрия обязательно включает лечебно-диагностическое выскабливание слизистой оболочки матки с последующей гормонотерапией. Консервативные методы лечения гиперплазии эндометрия включают прогестины, комбинированные оральные контрацептивы (КОК), антигонадотропные препараты, агонисты гонадолиберина. Чаще во всем мире используются прогестины и прогестинсодержащие препараты. Но введение прогестинов в виде монотерапии в длительном режиме сопровождается сиюминутными и долговременными побочными эффектами, снижающими переносимость терапии. Улучшения переносимости прогестагенов можно добиться добавлением низких доз эстрогенов в составе комбинированных эстроген-гестагенных препаратов. Одним из вариантов выбора эстроген-гестагенных препаратов являются КОК, которые могут назначаться сексуально активным пациенткам репродуктивного возраста при отсутствии клеточной атипии по результатам морфологического исследования эндометрия. Выбор КОК по характеристикам прогестина, в него входящего, обычно проводится между препаратами, содержащими прогестины третьего поколения, а именно: гестоден (Линдинет-20), дезогестрел (Новинет), норгестимат (Силест) [1]. Среди них одним из перспективных можно считать современный КОК Линдинет (содержащий 20 мкг этинилэстрадиола и 75 мкг гестодена) благодаря его высокой эффективности, а также минимальному биохимическому, метаболическому и иммунологическому воздействию на организм. Благодаря улучшенным свойствам гестодена, а также минимальной дозе этинилэстрадиола, Линдинет не оказывает клинически значимого влияния на метаболизм, характеризуется хорошей переносимостью и высокой безопасностью при длительном применении. Линдинет как препарат, содержащий прогестин III поколения, помимо всех благоприятных неконтрацептивных свойств, присущих современным КОК, характеризуется высокой контрацептивной надежностью, хорошим контролем менструального цикла, низкой частотой побочных эффектов.
Следующей внутриматочной патологией по частоте встречаемости у женщин с бесплодием является аденомиоз. У фертильных женщин эндометриоз диагностируется в 6–7% случаев. А у женщин, страдающих бесплодием, этот показатель колеблется от 20% до 48% [15]. В структуре генитального эндометриоза наиболее часто встречается аденомиоз. Бесплодие при эндометриозе обусловлено: нарушением транспортной функции маточных труб; нарушением функциональных взаимосвязей в системе гипоталамус–гипофиз–яичники; развитием аутоиммунной реакции; перитонеальным фактором; нарушением половой функции [16]. По данным некоторых исследователей, у женщин, вступающих в программы ЭКО и ПЭ, среди внутриматочной патологии аденомиоз может даже занимать второе месте и быть выявленным в 44% случаев [13]. Лучшим методом диагностики внутреннего эндометриоза на сегодняшний день является контрастная гистеросальпингосонография (КГССГ). По данным Е. М. Долговой, чувствительность КГССГ с целью выявления эндометриоза тела матки составляет 93,7%, специфичность — 83,9%, диагностическая точность — 91,6% [14]. Лечение данной патологии зависит от степени распространенности процесса, т. е. от стадии заболевания. При аденомиозе 1–2 стадий допустимо назначение монофазных КОК, содержащих прогестин III поколения (Линдинет, Новинет, Силест, Силует). При аденомиозе 3-й и 4-й стадии, а также при эндометриоидных кистах проводятся лапароскопическое удаление очагов и кист, разделение спаек, восстановление проходимости маточных труб. Терапию целесообразно проводить агонистами гонадотропинрилизинггормонов (Гн-РГ) (Бусерилин-депо 3,75 мг, Диферелин 3,75 мг) или антигонадотропными препаратами (даназол, Неместран).
Методы ВРТ могут однозначно повысить частоту наступления беременности у женщин с эндометриозом, хотя их результативность несколько ниже, чем в группе женщин с трубным фактором [17].
Не так часто встречающейся, но не менее серьезной патологией является субмукозная и интрамуральная с центрипетальным ростом узлов миома матки. По данным зарубежных исследователей, частота имплантации после ЭКО у больных с миомой матки равна 22,1%, а частота невынашивания — 36% [18]. Доказано, что при проведении ЭКО и ПЭ отмечается снижение индекса частоты наступления беременности на каждый перенос эмбриона до 27% у больных с субмукозной или интрамуральной миомой матки, причем большее значение имеет не размер узлов, а их число и расположение [19, 20]. Наличие субмукозной или интрамуральной миомы является постоянным раздражающим фактором, что приводит к нарушению сократительной активности миометрия. Также миома может деформировать полость матки, что затрудняет проходимость сперматозоидов и яйцеклетки [21]. При наступлении беременности на фоне субмукозных миоматозных узлов отмечается повышенный риск спонтанного аборта [22].
Первое место в диагностике миомы матки занимает УЗИ [23]. Применение цветного допплеровского картирования для исследования показателей внутриопухолевого кровотока позволяет исключить озлокачествление миометрия [24]. При подозрении на субмукозное расположение миоматозного узла применяется гистероскопия, но она является инвазивным и травматичным методом исследования. Для определения типа субмукозного узла возможно использовать КГССГ, имеющую достаточную диагностическую точность выявления внутриматочной патологии до 96% [14]. Для лечения миомы матки субмукозной локализации используют трансцервикальную миомэктомию. Возможность проведения трансцервикальной миомэктомии зависит от величины узла и от его формы. Удаление субмукозных узлов 0-го и 1-го типа возможно без предварительной предоперационной подготовки агонистами гонадолиберина. Для удаления подслизистых узлов 2-го типа с выраженным интерстициальным компонентом и размерами свыше 5 см в диаметре необходимо проведение предоперационной подготовки агонистами Гн-РГ не менее трех месяцев.
В качестве профилактики рецидивов после миомэктомии и лечения маленьких миоматозных узлов используют двухэтапную схему.
На первом (регрессионном) этапе эффективно используют агонисты Гн-РГ, продолжительность лечения 3–4 месяца, либо антигестагенные препараты курсом лечения 3–6 месяцев.
На втором (стабилизирующем) этапе используют микро- или низкодозированные КОК с гестагенным компонентом третьего поколения, о которых указывалось выше (например, Линдинет), по контрацептивной схеме или в пролонгированном режиме.
Значительных усилий также требует тактика ведения беременности уже после ЭКО и ПЭ. К этому процессу необходим дифференцированный подход, так как течение индуцированных беременностей дает высокую частоту осложнений и репродуктивных потерь. По данным большинства исследователей, от 30% до 70% беременностей после циклов ВРТ протекают с угрозой прерывания, а частота самопроизвольных выкидышей в первом триместре достигает 21% [25–27].
Таким образом, прогресс в поиске стратегий, позволяющих уменьшить число неудач в лечении бесплодия методами ВРТ, может быть достигнут не только на этапе переноса эмбрионов в матку и их имплантации, но и оптимизации тактики ведения беременности после ЭКО и ПЭ.
Повысить результативность ВРТ, по нашему мнению, также позволит изучение дополнительных методов диагностики внутриматочной патологии и внедрение их в практику. Поэтому целью нашего исследования стал анализ структуры внутриматочной патологии и у женщин, вступающих в программы ЭКО и ПЭ, а также сравнение их результатов в зависимости от патологии.
Объект исследования: 156 супружеских пар, страдающих бесплодием.
Материалом исследования послужили 156 супружеских пар, впервые принимающих участие в программах ВРТ в Омском центре репродуктивной медицины (ОЦРМ) за период 2010 г.
Все женщины ранее безуспешно лечились от бесплодия. Диагноз и оценка их состояния были обусловлены данными анамнеза и результатами общеклинического, ультразвукового и гормонального исследований. Состояние эндометрия у женщин оценивали с помощью УЗИ и допплерометрии сосудов эндометрия, КГССГ, гистероскопии и гистологического исследования соскоба слизистой оболочки матки.
Результаты и обсуждение
Возраст женщин колебался от 22 до 40 лет и в среднем составил 31 ± 2 года. Первичное бесплодие наблюдалось у 89 (57%) пациенток, вторичное — у 67 (42,3%). Продолжительность бесплодия составляла от 1 года до 20 лет. Пациенток с продолжительностью бесплодия до 5 лет — 61 (39%), от 5 до 10 лет — 78 (50%) и более 10 лет — 17 (10,9%).
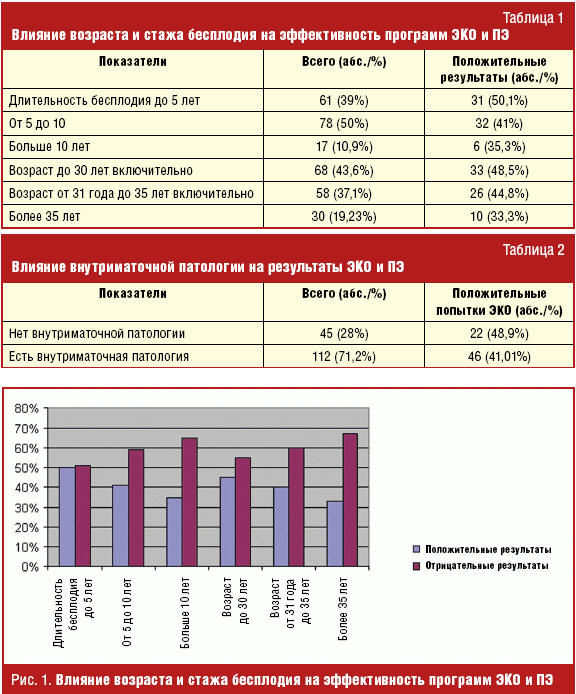
Шансы очень сильно зависят как от возраста пациентки, так и от стажа бесплодия. В табл. 1 заметно, как снижается процент наступления беременности с помощью процедуры экстракорпорального оплодотворения по мере увеличения возраста женщин и стажа бесплодия. У пациенток моложе 35 лет эта процедура намного чаще заканчивается беременностью и родами, причем эти показатели достаточно стабильны. Что же касается женщин после 35 лет, то чем старше пациентка, тем ниже эффективность ЭКО и ПЭ. То же мы можем сказать и об обратной зависимости между стажем бесплодия и эффективностью программ ЭКО и ПЭ. Это наглядно видно на рис. 1.
В исследуемой группе пациенток внутриматочная патология встречалась в 112 (71%) случаев, из которых у 46 (41,01%) женщин положительные попытки ЭКО и ПЭ. Эффективность методов ВРТ у пациенток из той же группы без внутриматочной патологии на 8% выше и составляет 22 случая из 45 (табл. 2).
Для оценки дихотомических данных были использованы критерии шансов. Показатель «абсолютный риск» в группе женщин с патологией в полости матки составил 0,7, в группе женщин без патологии матки — 1,0. Разница рисков (risk difference) — 1,41. ДИ (95% доверительный интервал) — 0,5 OR ± SE = от 0,9 до 1,9. Выявленная внутриматочная патология показала, что шансы наступления беременности в программах ЭКО у женщин без патологии полости матки в среднем в 1,4 раза выше по сравнения с пациентками, у которых внутриматочная патология выявлена.
Частота встречаемости внутриматочной патологии в зависимости от возраста пациенток распределилась следующим образом. У женщин, вступивших в программы ЭКО и ПЭ до 31 года, частота выявления внутриматочной патологии доходит до 67%, а результативность программ у женщин без внутриматочной патологии в этой группе, как видно из табл. 3, почти на 10% выше. В возрастной группе от 31 до 35 лет частота встречаемости внутриматочной патологии снижается до 58%, а результативность программ у женщин с внутриматочной патологией и без нее практически одинакова — 44% и 45,8% соответственно. В возрастной группе более 36 лет частота встречаемости внутриматочной патологии более 90%. Можно предположить, что влияние внутриматочной патологии на репродуктивную функцию женщин до 30 лет большее, чем на женщин старшего возраста. Показатель «абсолютный риск» в группе женщин до 30 лет с внутриматочной патологией составил 1,2, в группе женщин до 30 лет без внутриматочной патологии — 0,84. Разница рисков (risk difference) — 1,42. Показатель «абсолютный риск» в группе женщин от 30 до 35 лет с внутриматочной патологией составил 0,84, в группе женщин от 30 до 35 лет без внутриматочной патологии — 0,79. Разница рисков (risk difference) — 1,07. Т. е. у женщин до 30 при выявленной внутриматочной патологии шанс получить неудачу в цикле ЭКО и ПЭ на 1,4 раза выше, чем у пациенток без внутриматочной патологии. У пациенток старше 30 лет таких связей не прослеживается.
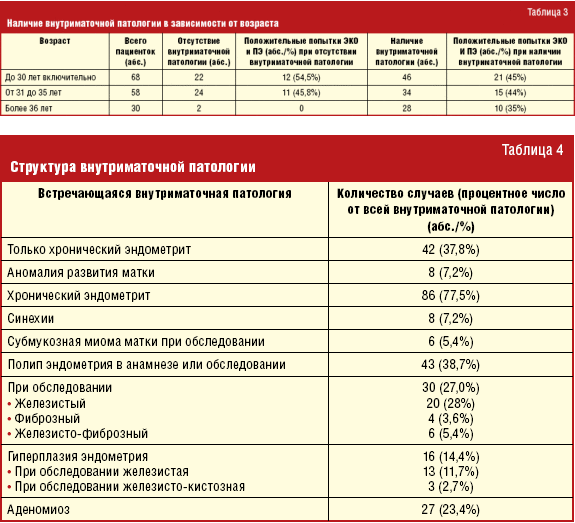
ХЭ занимает первое место в структуре внутриматочной патологии исследуемой группы и обнаружен у 86 пациенток (77,5% от всех случаев внутриматочной патологии) (табл. 4). Частота встречаемости ХЭ у женщин с вторичным бесплодием выше, чем с первичным, и составляет 62 пациентки (68,1% от всех женщин со вторичным бесплодием) против 66 (55,9%) пациенток с первичным бесплодием, но эта разница при статистическом исследовании с помощью четырехпольной таблицы 2×2 дала невысокую статистическую значимость — р = 0,38. Женщины, имеющие из внутриматочной патологии только ХЭ, составили 42 (37,8%). Синехии в полости матки встречались у женщин только с верифицированным ХЭ, а именно у 8 пациенток. У пациенток с морфологически подтвержденным ХЭ, т. е. у 34 (40%), при микробиологическом исследовании содержимого полости матки были выявлены возбудители инфекционного процесса, представленные в табл. 5.
Результаты ЭКО в первом цикле у женщин с морфологически верифицированным ХЭ были положительны в 45% случаев. У пациенток с наличием патогенной микрофлоры в полости матки положительным результатом в первом цикле закончились 12 из 34 программ ЭКО, а у женщин с невыявленной патогенной микрофлорой 27 из 52. Показатель «абсолютный риск» в группе женщин с патогенной микрофлорой в полости матки составил 0,55, в группе женщин без патогенной микрофлоры — 1,08. Разница рисков (risk difference) — 1,98. ДИ (95% доверительный интервал) — 0,8 OR ± SE = от 1,18 до 2,78. Шансы наступления беременности в ЭКО у женщин без выявленного инфекционного агента в полости матки при морфологически верифицированном эндометрите повышаются в среднем в 1,98 раза по сравнению с пациентками, у которых патогенная микрофлора выявлена.
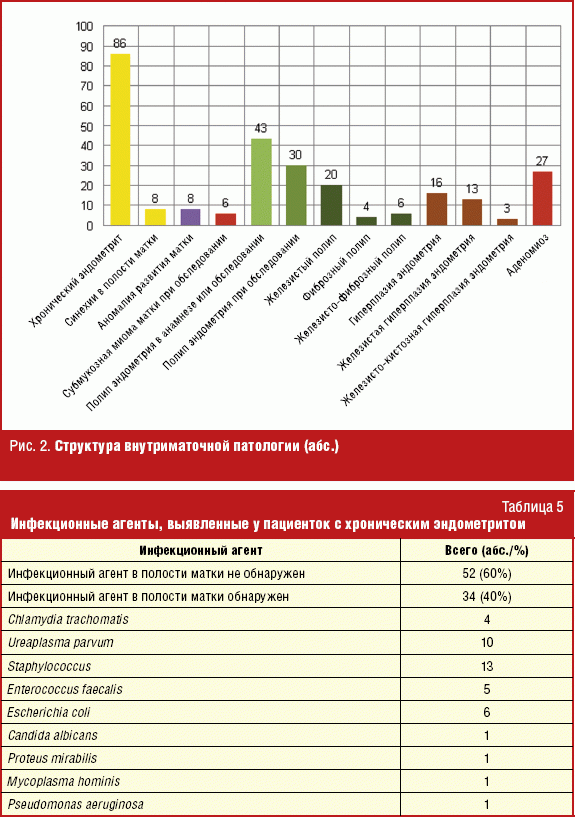
Аномалии развития матки выявлены у 8 пациенток: 2 случая двурогой матки, 2 гипоплазии, 4 седловидных матки (рис. 2). Субмукозная миома матки встречалась в 6 случаях, из которых только у одной пациентки в первой программе ЭКО наступила беременность. Полипы эндометрия выявлены при обследовании у 30 женщин, из них 20 железистых, 4 фиброзных и 6 железисто-фиброзных. Еще у 13 пациенток полипы эндометрия были обнаружены и пролечены до обращения в ОЦРМ. Из всех пациенток с когда-либо выявленными полипами эндометрия 32 с первичным бесплодием и 11 с вторичным. При сравнении этих 2 групп с помощью четырехпольной таблицы 2×2 (Хи-квадрат = 7,02) выявлены достоверные различия (р = 0,008), которые свидетельствуют о более высокой встречаемости полипов эндометрия у женщин с первичным бесплодием. Гиперплазия эндометрия при обследовании выявлена у 16 пациенток, из которых 13 женщин с железистой гиперплазией и 4 с железисто-кистозной. Статистические различия между встречаемостью первичного и вторичного бесплодия по этой патологии сомнительные (р = 0,09), но не могут быть исключены. Эндометриоз выявлен у 43 (38%) пациенток, из которых 27 с аденомиозом. Различия по частоте встречаемости аденомиоза между вторичным и первичным бесплодием статистически незначимы. Из 27 пациенток с аденомиозом 12 женщин получили беременность в первом цикле ЭКО (44%). Из 27 пациенток с аденомиозом 19 были с верифицированным ХЭ. Из этих женщин с сочетанной патологией 8 получили беременность в первом цикле (отношение шансов — 1,27), т. е при сочетанной патологии положительный исход в 1,27 раза менее вероятен. Из 16 случаев с морфологически верифицированной гиперплазией эндометрия 10 сочеталось с ХЭ, из которых 3 цикла закончились беременностью.
Выводы. Возраст пациенток является одним из определяющих факторов в успехе ЭКО и ПЭ [3, 28]. В возрастной группе до 30 лет внутриматочная патология является одним из определяющих факторов бесплодия, после 31 года такое влияние в нашем исследовании не прослеживалось.
Первое место в структуре внутриматочной патологии занимает ХЭ, который преобладает у женщин с вторичным бесплодием. Полученные результаты микробиологического исследования биоптатов эндометрия показали, что персистенция микроорганизмов в эндометрии при ХЭ встречается лишь у 40% больных. Причем эффективность ЭКО в первом цикле у пациенток без персистенции микроорганизмов в эндометрии почти в 2 раза выше. Эти данные свидетельствуют о том, что микробиологическое исследование эндометрия является важным диагностическим компонентом, результаты которого влияют на эффективность ВРТ. У женщин с первичным бесплодием преобладают гиперпластические процессы, а именно: полип эндометрия и гиперплазия эндометрия. Шансы наступления беременности в программах ЭКО у женщин без патологии полости матки в среднем в 1,4 раза выше по сравнения с пациентками, у которых патология матки выявлена. Причем сочетания внутриматочной патологии, такие как аденомиоз и ХЭ, полипы эндометрия и гиперплазия, еще больше уменьшают шансы наступления беременности в программах.
Таким образом, результаты ЭКО зависят от многих факторов. Одними из основных являются состояние эндометрия, наличие внутриматочной патологии и возраст женщины.
Литература
- Кулаков В. И., Манухин И. Б., Савельева Г. М. Гинекология. Национальное руководство. М.: ГЭОТАР-Медиа, 2007. С. 890–897.
- Кулаков В. И. Репродуктивное здоровье населения Poccии // Consilium medicum. 2007. № 2. С. 26.
- Бурлеев В. А., Кузмичев Л. Н., Щетинина Н. С. и др. Состояние молекулярного имплантационного окна: роль в исходах ЭКО (обзор литературы) // Проблемы репродукции. 2009. № 6. С. 24–27.
- Светлаков А. В., Яманова М. В., Егорова А. Б., Михуткина С. В. Молекулярно-биологические аспекты имплантации у человека и животных // Проблемы репродукции. 2002. № 2. С. 16–28.
- Корнеева И. Е. Современная концепция диагностики и лечения бесплодия в браке: автореф. дис. … д-ра мед. наук. М., 2006. 48 с.
- Здановский В. М., Буравченко Н. В. Результаты применения вспомогательных репродуктивных технологий у бесплодных пациенток с патологией эндометрия // Российский вестник акушера-гинеколога. 2010. № 4. С. 39–42.
- Шестакова И. Г. Реабилитация эндометрия после потери беременности // Гинекология. 2009. № 4. С. 55–57.
- Бессмертная B. C., Самойлов М. В., Бабиченко И. И., Серебренникова К. Г., Мусаева М. Г. Рецепторы к эстрогенам и прогестерону в эндометрии женщин при бесплодии // Вестник РУДН. Серия: Медицина. 2007. № 2. С. 48–52.
- Кострова Е. В. Рецепторный статус эндометрия у женщин с различными формами бесплодия: автореферат дис. … канд. мед. наук. Казань, 2007. 23 с.
- Кулаков Л. Н. Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии / Под ред. Кулакова В. И., Леонова Б. В., Кузмичева Л. Н. М.: Медицинское информационное агентство, 2005. 592 с.
- Рудакова Е. Б., Бесман И. В. Вспомогательные репродуктивные технологии. Проблемы потерь беременности // Лечащий Врач. 2010. № 3. С. 46–49.
- Рудакова Е. Б., Лузин А. А., Богданова О. Н. Хронический эндомиометрит: от совершенствования диагностического подхода к оптимизации лечения // Лечащий Врач. 2008. № 10. С. 6–10.
- Копылова Т. П. Гистероскопия как этап подготовки к программе ЭКО: необходимость и целесообразность // Репродуктивная медицина: научно-практический журнал Казахстанской ассоциации репродуктивной медицины. 2011 №. 1. С. 19–21.
- Долгова Е. М. Способы контрастного ультразвукового исследования репродуктивной системы женщины // Вестн. Новосиб. гос. ун-та. Сер.: Биология, клин. медицина. 2009. Т. 7. Вып. 2. C. 26–33.
- Кулакова В. И., Леонова Б. В. Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия (теоретические и практические подходы): руководство для врачей. М.: Медицинское информационное агентство, 2000. 782 с.
- Унанян А. Л. Эндометриоз и репродуктивное здоровье женщин // Акушерство, гинекология и репродукция. 2010. № 3. С. 6–11.
- Barnhart K., Dunsmoor-Su R., Coutifaris C. Effect of endometriosis on in vitro fertilization // Fertil Steril. 2002; 77: 1148–1155.
- Farhi J. Effects of uterine leiomyomata on the results of in vitro fertilization treatment // Hum Reprod. 1995; 10: 10: 2576–2578.4.
- Краснопольская К. В., Сичинава Л. Г., Калугина А. С. Использование ЭКО и ПЭ у больных миомой матки небольших размеров // Акушерство и гинекология. 2000. № 1. С. 56–58.
- Stovall D. W., Parrish S. B. Uterine leiomyomas reduce the efficacy of assisted reproduction cycles // Hum Reprod. 1997; 13: 192–197.
- Петракова С. А. Возможности миомэктомии в коррекции репродуктивного здоровья женщин с лейомиомой матки // Рос. вестн. акушерства и гинекологии. 2009. Т. 9. № 1. С. 30–35.
- Berek Jonathan S. Novak’s Gynecology. New York, 1996; 359–361.
- Адамян Л. В., Ткаченко Э. Р. Современные аспекты лечения миомы матки // Медицинская кафедра. М., 2003. № 4 (8). С. 110–118.
- Семенов Н. С. Возможности эхографии, ЦДК и допплерометрии в диагностике миомы матки и оценке восстановления репродуктивной системы при консервативной миомэктомии: автореф. дис. канд. мед. наук. М., 2000. 21 с.
- Гнипова В. В., Сидельникова В. М. Особенности ведения беременности, наступившей после ЭКО и осложнившейся кровотечением в I триместре // Проблемы репродукции. 2008. № 4. С. 39–43.
- Сидельникова В. М. Привычная потеря беременности. М.: Триада-Х, 2005. 304 с.
- Стрельченко М. Б. Особенности течения беременности после ЭКО и ПЭ: автореф. дис. … канд. мед. наук. М., 2002. 22 c.
- Коваленко Л. В., Бондарева Е. В., Корнеева Е. В., Шишанок О. Ю., Белоцерковцева Л. Д. Влияние возраста пациенток на частоту биологических потерь в программах ЭКО: опыт работы // Проблемы репродукции. 2008. № 3. С. 53–56.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






