Введение
Пролапс тазовых органов — опущение тазовых органов, возникающее вследствие слабости связочного аппарата тазового дна, причиной которого могут служить множество факторов. Наиболее сложным для коррекции и наименее прогностически благоприятным видом пролапса является постгистерэктомический, при котором стенки влагалища обычно выпадают вместе с содержимым брюшной полости. Отсутствие матки, несостоятельность фасциально-связочного аппарата таза, необходимость синхронной коррекции всех отделов тазового дна, последствия ранее перенесенных хирургических вмешательств — основные факторы, которые усложняют лечение пациенток с энтероцеле. При энтероцеле брюшина находится в прямом контакте с выпавшими стенками влагалища, фактически без промежуточной фасции (рис. 1). Это происходит в результате дефектов или отрывов пубоцервикальной и ректовагинальной фасций (чаще в области апекса влагалища) [1]. В большинстве случаев причиной энтероцеле служит предшествующая гистерэктомия, реже пролапс развивается самостоятельно, без предшествующей операции. Апекс влагалища после гистерэктомии формируется за счет сшивания лобково-цервикальной фасции с ректовагинальной фасцией. Именно дефекты фасций в этой зоне (зоне сшивания) и приводят к развитию апикального пролапса и энтероцеле.
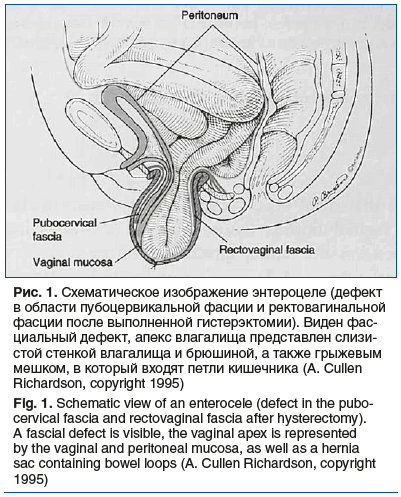
Энтероцеле — грыжа заднего и апикального сводов влагалища, чаще всего содержащая в себе петли тонкого кишечника, если грыжевой мешок содержит сигмовидную кишку, то пролапс носит название «сигмоидоцеле», в случае, когда содержимым грыжевого мешка является предбрюшинный жир, — «перитонеоцеле» [2].
Хирургические принципы коррекции апикального пролапса и энтероцеле включают в себя два основных этапа — устранение грыжевого мешка и придание поддержки влагалищу [3]. Последнее осуществляется за счет коррекции фасциальных дефектов путем укрепления пубоцервикальной и ректовагинальной фасций. Коррекция апикального пролапса осуществляется путем протезирования несостоятельного связочного аппарата [1].
Цель исследования: оценить эффективность трансвагинальной коррекции постгистерэктомического апикального пролапса и энтероцеле при помощи билатеральной сакроспинальной кольпопексии с применением одного или двух сетчатых имплантов.
Содержание статьи
Материал и методы
Исследование проспективное. Предоперационное обследование помимо стандартных методик предусматривало осмотр на гинекологическом кресле, УЗИ содержимого грыжевого мешка и органов мочевой системы. Проводили оценку акушерско-гинекологического анамнеза, оценивали длительность менопаузы, продолжительность проведения заместительной гормональной терапии, выполняли анкетирование пациенток по опросникам: оценки сексуальной функции (Pelvic Organ Prolapse/Urinary Incontinence Sexual Questionnaire, PISQ-12), состояния тазового дна (Pelvic Floor Distress Inventory, PFDI-20 (включая POPDI-6, CRADI-8, UDI-6)), влияния на тазовое дно (Pelvic Floor Impact Questionnarie, PFIQ-7 (включая UIQ, CRAIQ, POPIQ)). Для определения степени пролапса использовали систему количественной оценки пролапса тазовых органов (Pelvic Organ Prolapse Quantifications System, POP-Q).
В исследование были включены 8 пациенток с энтероцеле 3-й стадии и выше, которым в период с 2021 по 2024 г. проведена трансвагинальная коррекция пролапса с применением 1 (рис. 2, табл. 1) или 2 сетчатых имплантов (полипропиленовая лента + проленовая сетка) (рис. 3, табл. 2).
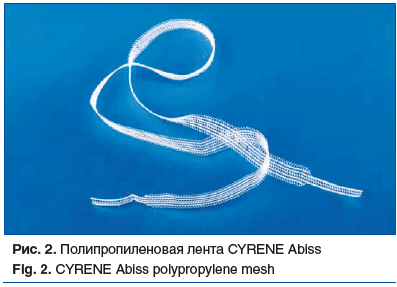
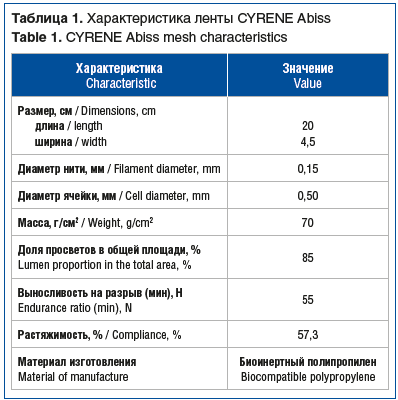
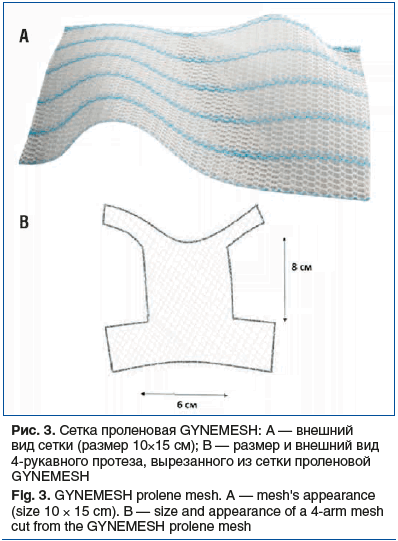
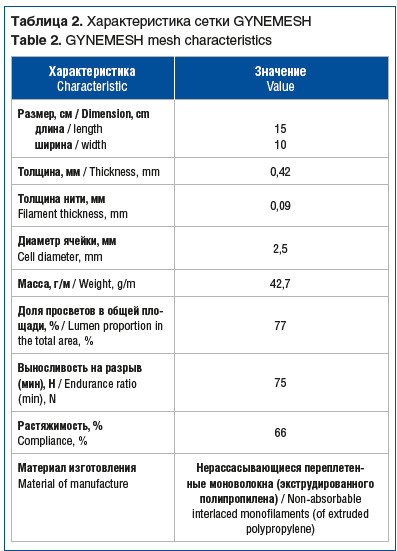
Имплант (лента CYRENE Abiss), устанавливаемый транссакроспинально, служил для поддержки апикального отдела влагалища. Четырехрукавный прямоугольный протез вырезали из проленовой сетки для реконструкции тазового дна 10×15 см GYNEMESH (см. табл. 2, рис. 3А) и применяли для замещения несостоятельной ректовагинальной фасции и укрепления заднего отдела тазового дна.
Из восьми пациенток шести (75%) установлено два протеза (лента и имплант). В двух наблюдениях удалось использовать нативную ректовагинальную фасцию. Операцию проводили по запатентованной нами методике [4]. Двум (25%) пациенткам выполнена установка одной ленты.
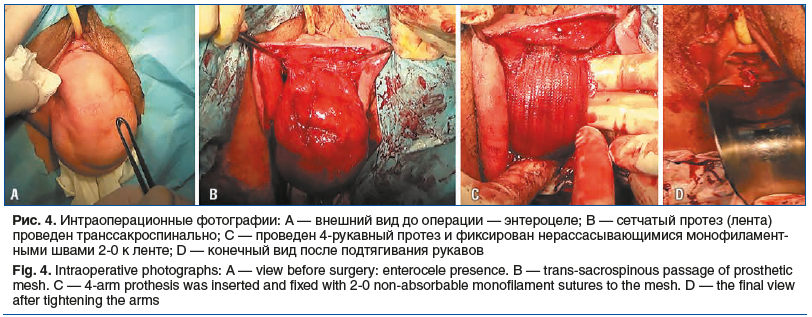
Техника установки двух протезов. Предварительная субфасциальная гидродиссекция, продольный разрез задней и частично (не доходя 1 см до шейки мочевого пузыря) передней стенок влагалища с мобилизацией грыжевого мешка. Формирование указательным пальцем параректальных каналов к седалищным остям с обеих сторон. Обнажение передней поверхности сакроспинальных связок. С помощью транссакроспинального троакара — прокол сакроспинальной связки в области ее средней трети на середине ширины. Проведение лигатурных нитей. Мобилизация и смещение краниально нижнеампулярного отдела прямой кишки. Разрез кожи ягодиц длиной 2–3 мм на середине воображаемой линии, проведенной между седалищным бугром и анусом. Формирование проколов через эти разрезы в рану влагалища с обеих сторон с помощью стилета передним трансобтураторным троакаром с аналогичным проведением провизорных лигатур. Фиксация 4-рукавного протеза нерассасывающимися монофиламентными швами 2-0 к слингу, затем — к культям кардинальных и крестцово-маточных связок и висцеральной поверхности апекса влагалища — краниально, к промежностному телу — каудально. Проведение рукавов ленты транссакроспинально, каудальные рукава широкого протеза — через ягодичные проколы, используя пары ранее подготовленных провизорных лигатур. Мобилизация краев пубоцервикальной фасции с последующим ее подшиванием и расправлением к протезу-ленте монофиламентной нерассасывающейся нитью 2-0. Ушивание разреза влагалища викрилом 2-0. Протягивание сакроспинальных рукавов до натяжения, корректируя таким образом апикальный и передние дефекты тазового дна. Подтягивание задних «ягодичных» рукавов, устраняя задние дефекты. Восстановление нормального анатомического положения купола и стенки влагалища.
В двух случаях при сохранной ректовагинальной фасции обходились протезом-лентой. Задние дефекты корректировали путем подшивания нативной фасции к комплексу, состоящему из ленты и культей кардинальных и крестцово-маточных связок. В подобных обстоятельствах не требовалась мобилизация ампулярного отдела прямой кишки и брюшек леваторов (рис. 4). В остальном принципиального отличия между модификациями не было.
После операции контрольный осмотр проводили через 1, 3, 6 мес., далее ежегодно либо при необходимости. Проводили осмотр на гинекологическом кресле и анкетирование. Также выполняли мультиспиральную компьютерную томографию (МСКТ) с внутривенным контрастированием и 3D-моделирование с целью уточнения локализации сетчатого импланта и его расположения относительно нижних мочевыводящих путей.
Статистическая обработка данных проведена с использованием программного обеспечения SPSS v.25 (IBM Corp., США). Полученные данные были проверены на нормальность распределения (критерий Шапиро — Уилка). Данные в сравниваемых группах, распределение которых не удовлетворяло требованиям параметрического анализа, были представлены в виде значения медианы и минимального и максимального значений (Ме (min–max)). Данные, удовлетворяющие нормальному распределению, представлены в виде значений средней арифметической величины и стандартной ошибки (М±m). Качественные показатели представлены в виде абсолютных значений и процентных долей.
Результаты исследования
Из восьми пациенток, включенных в исследование, шести проведена трансвагинальная коррекция энтероцеле при помощи 2 сетчатых имплантов, двум пациенткам — с использованием одного импланта-ленты. Характеристика пациенток представлена в таблице 3, основные операционные данные — в таблице 4. У одной пациентки показаниями к гистерэктомии были и опущение матки, и аденомиоз.
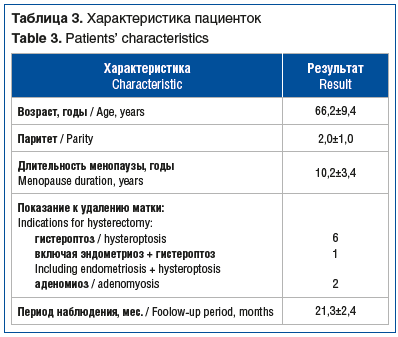
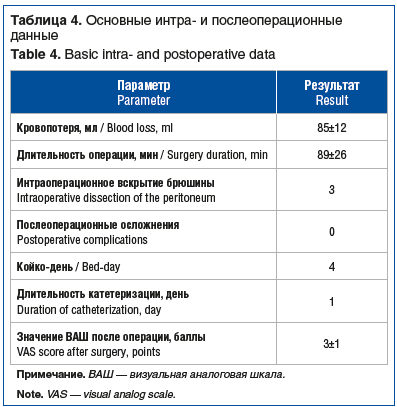
Средний срок наблюдения составил 21,3±2,4 мес. Анатомические результаты, согласно классификации POP-Q, представлены в таблице 5 и на рисунках 5 и 6. За период наблюдения ни в одном случае не выявлено клинически значимого рецидива. Субъективные и функциональные результаты представлены в таблицах 6 и 7. Хирургическая коррекция привела к значимому уменьшению дизурии и обструктивной дефекации.

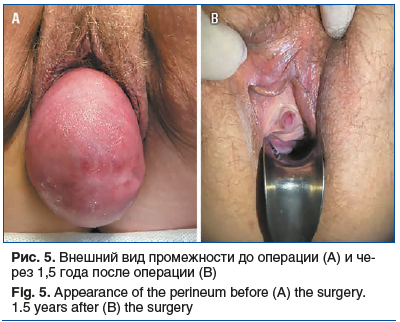
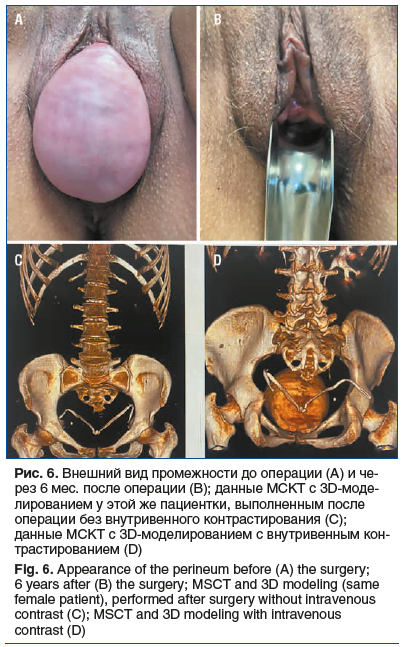
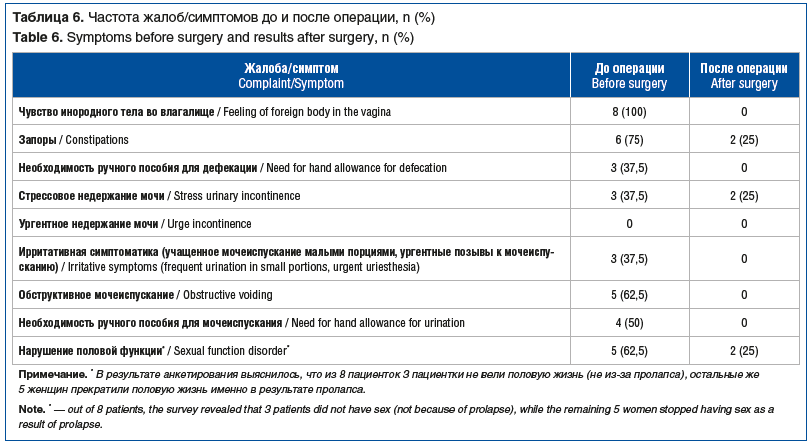
У трех пациенток до операции выявлено стрессовое недержание мочи. В одном случае после операции достигнута континенция de novo. В двух случаях стрессовое недержание мочи не купировано. В настоящее время пациентки воздерживаются от установки петли в связи с недержанием легкой степени. Используют одну страховочную прокладку. Ни в одном случае не выявлено стрессового недержания мочи de novo. Послеоперационной тазовой боли также не было выявлено ни в одном случае. В двух случаях у пациенток сохранились запоры. Пациентки были направлены к колопроктологу, проводится терапия по принципу биологической обратной связи (БОС) — с эффектом. Ухудшения дефекации не было диагностировано ни у одной пациентки.
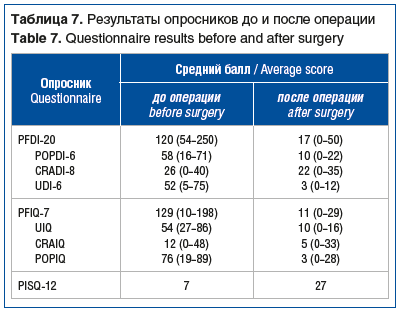
Результаты анкетирования пациенток по опросникам PISQ-12, PFDI-20 и PFIQ-7 представлены в таблице 7.
Обсуждение
Первое зарегистрированное описание энтероцеле приписывается C. Garengeot и датируется 1736 г. В 1885 г. M. Thomas описал различные виды хирургического лечения энтероцеле (цит. по [5]). И только в 1957 г. M. McColl описал свою технику кульдопластики [6]. Первое описание абдоминальной сакрокольпопексии было сделано в 1957 г. H. Arthure и D. Savage [7]. Сакроспинальная кольпопексия была описана K. Richter в 1967 г. и внедрена в практику C. Randall et al. в 1971 г. (цит. по [8]). В 1998 г. B.L. Schull [9] описал влагалищное восстановление энтероцеле путем ресуспензии к остаткам крестцово-маточной связки с последующим устранением дефекта эндопельвикальной фасции. Из всех перечисленных процедур эта является наиболее специфичной [10].
Гистерэктомия — одна из самых частых гинекологических операций. Удаление матки является фактором риска развития постгистерэктомического пролапса. В случае, когда показанием к удалению матки является опущение органов малого таза, риск рецидива пролапса с формированием энтероцеле возрастает. Это продемонстрировано в крупном исследовании, где риск развития пролапса после гистерэктомии, выполненной по поводу гистероптоза, увеличивается в 4,7 раза [11].
Существуют различные хирургические доступы и способы устранения энтероцеле: с использованием сетки или без нее, трансвагинальный, лапароскопический и открытый доступы. Апикальная поддержка является основной опорой для успешного восстановления [12]. Однако в случае энтероцеле выбор доступа дискутабелен.
Преимущества выбора абдоминального/лапароскопического доступа заключаются в лучшей визуализации пресакрального и ректовагинального пространств, а также в лучшем гемостазе, чем при трансвагинальном доступе. Выбор абдоминального/лапароскопического доступа позволяет избегать так называемых «слепых этапов», которые неизбежны при трансвагинальном доступе. К недостаткам относятся необходимость эндотрахеального наркоза, увеличение операционного времени, увеличение расходов на госпитализацию в связи с увеличением времени работы в операционной и использованием одноразовых инструментов. Выполнение абдоминальной/лапароскопической операции может быть осложнено в результате предшествующих операций на брюшной полости и малом тазу, которые могут привести к образованию спаек, что может удлинить время операции и отрицательно сказаться на операционно-анестезиологических рисках, в особенности у коморбидных пациенток [13]. Основным недостатком абдоминального/лапароскопического доступа является неспособность надлежащего устранения передних дефектов [14].
С учетом перечисленных недостатков трансвагинальный доступ под спинномозговой анестезией становится серьезным «оппонентом» абдоминальному/лапароскопическому. Особенно «привлекательными» и даже незаменимыми трансвагинальные операции могут стать у пациенток с отягощенным соматическим статусом с крайне высокими рисками наркоза и обширной внутрибрюшинной диссекции.
При помощи лапароскопического или открытого доступа обычно выполняют промонтофиксацию, при этом эффективность составляет 78–100%. Эта методика обычно считается «золотым стандартом» лечения апикального пролапса после гистерэктомии благодаря отличным анатомическим и физиологическим результатам. Однако ограничением вышеописанных доступов является необходимость широкой диссекции, что может привести к значительному венозному кровотечению из пресакральных вен. Кроме того, хорошо известно, что абдоминальная операция характеризуется более высоким уровнем послеоперационного болевого синдрома и более длительным периодом реабилитации по сравнению с трансвагинальной операцией [15].
Трансвагинальный доступ, применяемый при реконструкциях тазового дна, имеет ряд объективных преимуществ перед трансабдоминальным/лапароскопическим доступом: ниже риск развития послеоперационных инфекционных осложнений и болевого синдрома, меньше срок реабилитации и лучше косметический эффект [16]. При трансвагинальной коррекции послеоперационные болевые ощущения сведены к минимуму благодаря отсутствию рассечения кожи, фасций и мышц живота [17, 18].
При этом основным преимуществом трансвагинального доступа является возможность синхронного устранения всех дефектов тазового дна из одного разреза. Для сравнения сакрокольпопексия при наличии значимых дефектов переднего отдела тазовой фасции может быть дополнена реконструктивными этапами, осуществляемыми из влагалищного доступа через дополнительный разрез, что соответственно повышает сложность вмешательства и его риски [19].
После появления синтетических сеток, разработанных для оптимизации лечения урогенитального пролапса, большинство продуктов такого рода были изъяты из продажи. Обусловлено это было сравнительно высоким риском осложнений, связанных как с самими протезами, так и со способами и техникой их фиксации. Наиболее серьезными осложнениями были повреждения мочеточников, прямой кишки, кровотечения. Из поздних осложнений грозными являлись тазовый болевой синдром, требовавший в ряде случаев эксплантации протеза, и протрузии импланта [20]. Это заставило хирургов вновь обратиться к использованию нативных тканей. Такая хирургия сопряжена с более низкой стоимостью и лишена mesh-ассоциированных рисков. Однако операции с использованием нативных тканей связаны с более высоким риском рецидива в долгосрочной перспективе, что особенно актуально при постгистерэктомическом пролапсе, возникающем в условиях несостоятельности как связочного, так и фасциального компонента тазового дна женщины. В качестве основных факторов риска рецидива выступают возраст, паритет, а также такой специфический фактор, как стадия пролапса [21, 22].
Хирургическое устранение апикального пролапса при энтероцеле может быть выполнено с использованием сакроспинальных связок, способных благодаря своим характеристикам удерживать слинг с фиксированной к нему верхушкой влагалища и его связками. Действительно, по сравнению с абдоминальной/лапароскопической сакрокольпопексией и вагинальной гистерэктомией с подвешиванием крестцово-маточной связки влагалищный доступ с сакроспинальной вагинопексией представляется патогенетически предпочтительным, менее травматичным, менее дорогостоящим как с точки зрения времени операции, так и с точки зрения реабилитации женщин, поскольку время до возвращения к повседневной деятельности короче. Возможность одновременного устранения всех дефектов тазового дна с интраоперационным принятием решений о применении импланта или реконструкции нативной фасции делает методику особенно привлекательной.
Идентификация крестцово-маточных связок, правильное наложение швов, реапроксимация пубоцервикальной и ректовагинальной фасций с закрытием грыжевого отверстия являются ключевыми моментами для достижения хирургического успеха [23, 24].
Заключение
Проведенный нами анализ показал, что трансвагинальная коррекция постгистерэктомического пролапса и энтероцеле с использованием полипропиленовых имплантов является эффективной и безопасной методикой. При использовании указанных протезов и техник их имплантации мы не столкнулись с mesh-ассоциированными осложнениями ни во время операции, ни в отдаленном послеоперационном периоде.
Наиболее изученная сакроспинальная вагинопексия остается надежной универсальной методикой коррекции апикального пролапса, в том числе и в случае его постгистерэктомического происхождения. В случае несостоятельности заднего листка тазовой фасции последняя может быть спротезирована при помощи специально сконструированного проленового крупнопористого облегченного протеза. Более стабильная и прочная в силу возложенных на нее биомеханических нагрузок пубоцервикальная фасция в случае равномерного расправления и фиксации ее нерассасывающимся шовным материалом к ленте позволяет компенсировать как поперечный и срединный, так и боковые дефекты переднего тазового компартмента.
Объективные, субъективные, функциональные результаты операций и последующее качество жизни женщин удовлетворительные. Следовательно, предложенные методики могут рассматриваться как альтернативные сакровагинопексии варианты лечения энтероцеле, особенно у пожилых и коморбидных пациенток. Однако для подтверждения наших результатов необходимы проспективные данные с большим количеством пациенток.
СВЕДЕНИЯ ОБ АВТОРАХ:
Снурницына Олеся Вячеславовна — к.м.н., врач-уролог Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-2238-9347
Никитин Александр Николаевич — врач акушер-гинеколог ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 123154, Россия, г. Москва, ул. Саляма Адиля, д. 2/44, стр. 1.
Слободянюк Борис Александрович — к.м.н., врач акушер-гинеколог, ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; доцент кафедры акушерства и гинекологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117321, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0005-9578-1755
Шпикина Анастасия Дмитриевна — врач-уролог Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0006-5521-290X
Бабаевская Диана Ивановна — врач-уролог Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-1692-0445
Лобанов Михаил Владимирович — к.м.н., врач-уролог Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2.
Рапопорт Леонид Моисеевич — д.м.н., профессор, заместитель директора по лечебной работе Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-7787-1240
Еникеев Михаил Эликович — д.м.н., заведующий 2-м урологическим отделением, профессор Института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-3007-1315
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117321, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-9091-4097
Контактная информация: Снурницына Олеся Вячеславовна, e-mail: sovdoctor@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.11.2024.
Поступила после рецензирования 20.12.2024.
Принята в печать 14.01.2025.
ABOUT THE AUTHORS:
Olesya V. Snurnitsyna — C. Sc. (Med.), urologist at the Institute of Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0003-2238-9347
Alexander N. Nikitin — obstetrician-gynecologist, L.A. Vorokhobov City Clinical Hospital No. 67; 2/44, build. 1, Salama Adilya str., Moscow, 123154, Russian Federation.
Boris A. Slobodyanyuk — C. Sc. (Med.), obstetrician-gynecologist, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; Associate Professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0005-9578-1755
Anastasia D. Shpikina — urologist at the Institute of Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0009-0006-5521-290X
Diana I. Babaevskaya — urologist at the Institute of Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0003-1692-0445
Mikhail V. Lobanov — C. Sc. (Med.), urologist at the Institute of Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD
Leonid M. Rapoport — D. Sc. (Med.), Professor, Deputy Director for Therapeutic Work of the Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-7787-1240
Mikhail E. Enikeev — D. Sc. (Med.), Head of the 2nd Urology Department, Professor at the Institute of Urology and Reproductive Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0002-3007-1315
Yulia E. Dobrokhotova — D. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-9091-4097
Contact information: Olesya V. Snurnitsyna, e-mail: sovdoctor@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.11.2024.
Revised 20.12.2024
Accepted 14.01.2025.
Информация с rmj.ru






