СИНТЕЗ И ИССЛЕДОВАНИЕ ГЕТЕРОГЕННЫХ КАТАЛИЗАТОРОВ НА ОСНОВЕ ТЕТРАСУЛЬФОФТАЛОЦИАНИНА КОБАЛЬТА И МОДИФИЦИРОВАННОГО МОНТМОРИЛЛОНИТА
Научная статья
Коваленко О.Н.1, *, Хрустова К.А.2
1 ORCID: 0000-0002-7887-9110;
2 ORCID: 0000-0002-6170-4648;
Институт катализа СО РАН, Новосибирск, Россия
* Корреспондирующий автор (oven[at]catalysis.ru)
Аннотация
Изучена адсорбция тетрасульфофталоцианина кобальта (ТСФК) из водных растворов на природном в Na-форме и модифицированном гидроксокомплексами алюминия [Al13O4(OH)24(H2O)12]7+ монтмориллоните (Na-М и Al-М, соответственно). Установлено, что величина и характер адсорбции зависят от природы носителя. На na-М адсорбция ТСФК обратима, в то время как 0.7 мг ТСФК/г Al-М адсорбируется необратимо. Методом спектроскопии диффузного отражения показано, что необратимо адсорбированный ТСФК закреплен на поверхности Al-М в мономерной форме. Установлено, что прочное закрепление ТСФК на Al-М не приводит к снижению его активности в реакции окисления раствора сульфида натрия кислородом: ТСФК, закрепленный в мономерной форме на носителе, и находящийся в растворе в виде мономеров, имеют одинаковую активность.
Ключевые слова: тетрасульфофталоцианин кобальта, монтмориллонит, адсорбция, окисление, сероводород.
SYNTHESIS AND RESEARCH OF HETEROGENEOUS CATALYSTS BASED ON TETRASULPHOPHTHALOCYANINE COBALT AND MODIFIED MONTMORILLONITE
Research article
Kovalenko O.N.1, *, Khrustova K.A.2
1 ORCID: 0000-0002-7887-9110;
2 ORCID: 0000-0002-6170-4648;
Institute of Catalysis SB RAS, Novosibirsk, Russia
* Corresponding author (oven[at]catalysis.ru)
Abstract
The article studies the adsorption of tetrasulfophthalocyanine cobalt (TSFC) from aqueous solutions on the natural (in the Na form) and modified by aluminum hydroxo complexes [Al13O4 (OH) 24 (H2O) 12] 7+ montmorillonite (Na-M and Al-M, respectively). It is established that the magnitude and nature of adsorption depend on the nature of the carrier. On Na-M, adsorption of TSFC is reversible, while 0.7 mg of TSFC/g Al-M adsorbs irreversibly. It is shown that irreversibly adsorbed TSFC is fixed on the surface of Al-M in monomeric form using diffuse reflectance spectroscopy. It was established that the solid fixing of TSFC on Al-M does not lead to a decrease in its activity in the oxidation reaction of a solution of sodium sulfide with oxygen: TSFC fixed in monomeric form on the carrier in the solution in the form of monomers have the same activity.
Keywords: cobalt tetrasulfophthalocyanine, montmorillonite, adsorption, oxidation, hydrogen sulfide.
Тетрасульфофталоцианин кобальта (ТСФК) – один из наиболее активных гомогенных катализаторов промышленных процессов очистки газов и нефтепродуктов от сероводорода путем жидкофазного окисления H2S до серы либо кислородных сернистых солей [1], [2].
Гетерогенизация этих комплексных соединений может обеспечить увеличение как эффективности их использования за счет многократного применения, так и каталитической активности, например, за счет фиксации степени агрегирования фталоцианиновых комплексов при их закреплении на поверхности носителя.
Согласно [3], [4] активность ТСФК в реакциях окисления определяют следующие факторы.
Возможность обратимых редокс-переходов иона кобальта Co(I) « Co(II) « Co(III) с сохранением органической сопряженной структуры фталоцианина;
Способность к экстракоординации за счет образования координационных соединений с различными лигандами по 5- и 6-му координационным местам центрального атома. В молекуле фталоцианина четыре координационных места центрального атома кобальта занимают атомы азота, 5-е и 6-е аксиальные положения остаются свободными. В реакционной среде их могут занимать различные лабильные заместители.
Способность к образованию ассоциатов в растворе. Наиболее активными являются мономерная и димерная формы ТСФК.
Таким образом, для того чтобы ТСФК не терял каталитической активности при гетерогенизации, необходимо обеспечить его прочное закрепление преимущественно в мономерной либо димерной формах с сохранением заряда центрального атома Co2+ и свободных для присоединения реагентов 5- и 6-го координационных мест.
Выбор исходного материала в качестве носителя и способа закрепления ТСФК были сделал в рамках этого положения.
Известно, что при нанесении фталоцианинов на поверхность традиционных оксидных носителей (Al2O3, SiO2) методом адсорбции не происходит их прочного закрепления, и фталоцианины быстро переходят в раствор под воздействием реакционной среды [5]. Модифицированных оксидных носителей аминами обеспечивает прочное закрепление фталоцианинов на их поверхности за счет образования химической связи центрального атома кобальта с аминогруппой [6]. Однако потеря одного свободного координационного места атома кобальта приводит к снижению или полной потере активности фталоцианина.
Прочное закрепление активного компонента с сохранением его активности может быть достигнуто при использовании методов, предполагающих капсулирование фталоцианина в порах носителя без образования прочной химической связи (например, синтез в порах цеолита с размером ячейки, сопоставимым с размером молекулы фталоцианина [7], либо синтез носителя золь-гельным способом в присутствии фталоцианина [8], [9]). Однако широкому использованию этих методов препятствует их сложность и необходимость использования дорогостоящих реагентов.
Одним из способов решения этих проблем может быть использование в качестве носителей слоистых алюмосиликатов, ширину межслоевого расстояния которых можно увеличить путем интеркаляции воды или гидроксокомплексов поливалентных металлов можно увеличить с 0,2¸1,2 нм до 1,7¸4 нм [10], то есть до величины, сопоставимой с размером молекулы фталоцианина. В этом случае введение комплексов фталоцианина в межслоевое пространство слоистых алюмосиликатов может быть осуществлено адсорбционным способом. Возможность приготовления катализаторов путем введения порфиринов и фталоцианинов в межслоевое пространство катионных смектитных глин и слоистых двойных гидроксидов была продемонстрирована в работах [11], [12], [13].
Целью данной работы было изучить возможность приготовления адсорбционным методом гетерогенных катализаторов, содержащих ТСФК, закрепленный на поверхности слоистого алюмосиликата со структурой монтмориллонита. Другой задачей данной работы было установить взаимосвязь между каталитической активностью и состоянием адсорбированных молекул ТСФК на поверхности носителей в реакции окисления сульфида натрия кислородом.
Экспериментальная часть
В работе использовали два типа носителей: монтмориллонит в натриевой форме (Na-М), и монтмориллонит, модифицированный гидроксокомплексами алюминия [Al13O4(OH)24(H2O)12]7+ (Al-M).
В качестве исходного сырья для получения носителей использовали монтмориллонитовую глину Мухортолинского месторождения (Республика Бурятия), содержащую 90% монтмориллонита. Глинистый материал перед использованием дополнительно очищали отмучиванием.
Na-М и Al-М синтезировали по методикам, описанным в работе [14]. Основные текстурные характеристики используемых носителей представлены в табл. 1.
ТСФК был приготовлен согласно методике [15]. Na2S·9H2O марки «ч» использовали после двукратной перекристаллизации в соответствии с методикой [16, С. 176].
Адсорбционные измерения проводили в термостатируемом, встряхиваемом реакторе при 20оС. В термостатированный встряхиваемый реактор загружали 0.2 г адсорбента и заливали 2 мл раствора, содержащего 5×10-3-1.3 мг/мл ТСФК. Через сутки (по достижении адсорбционного равновесия) раствор отделяли фильтрацией и анализировали спектрофотометрически («Specord M-40», l = 250-800 нм). Предельные значения величин адсорбции ТСФК (aмакс) определяли по изотерме адсорбции ТСФК на участке выхода адсорбционной кривой на плато. Далее образец сушили в течение суток на воздухе, затем в течение суток при 60-70ºС и проводили десорбционные измерения.
Спектры диффузного отражения, адсорбированного ТСФК снимали на спектрометре UV-2501 PC Shimadzu с приставкой диффузного отражения IRS-250A в области 190-900 нм с разрешением 2 нм.
Удельную поверхность определяли методом адсорбции-десорбции азота при 77К на приборе Micromeritics ASAP-2400 и вычисляли по методу БЭТ.
Межслоевое расстояние исследуемых алюмосиликатов определяли методом рентгенофазового анализа на дифрактометре URD-6 с Cu Ka излучением.
Окисление сульфида натрия проводили в стеклянном термостатированном встряхиваемом реакторе объемом 100 мл при рН = 7.2, концентрации Na2S в реакционном растворе 0.05М, давлении кислорода 1 атм и температуре 25оС. В реактор загружали 25 мл раствора и 100 мг катализатора. Скорость встряхивания реактора составляла 400 об/мин, что обеспечивало возможность проводить процесс в кинетической области. Активность катализаторов оценивали по начальной скорости поглощения кислорода (мл О2/мин). Остаточное содержание сернистых соединений (S2-, S2O32-, SO32-) анализировали методом обратного йодометрического титрования при рН = 4÷6 [17, С. 209].
Результаты и их обсуждение
Адсорбция ТСФК на поверхности монтмориллонита
На рис. 1 приведены изотермы адсорбции ТСФК в зависимости от типа носителя. Величины максимальной адсорбции CoPс(SO3Na)4 (аmax) и количество необратимо адсорбированного фталоцианина (анс) представлены в табл. 1.
Таблица 1 – Физико-химические и адсорбционные характеристики носителей
| Носитель | SБЭТ, м2/г | d001, нм | Адсорбционные данные | |
| амах | анс | |||
| Na-M | 141 | 1,2 | 1,2 | – |
| Al-M | 200 | 1,9 | 4.0 | 0,7 |
Адсорбция ТСФК на Na-М с межслоевым пространством 1,4 нм является полностью обратимой. Адсорбционная кривая имеет ленгмюровский вид с плато. аmax составляет 1.2 мг ТСФК/г Na-М.
Характер адсорбции ТСФК на Al-М принципиально отличается от описанного выше. Во-первых, предельное значение величины адсорбции ТСФК в 4 раза выше величины адсорбции ТСФК на Na-М и, кроме того, около 0.7 мг ТСФК на 1 г носителя адсорбируется необратимо. Во-вторых, на адсорбционной кривой наблюдается 2 плато, первое из которых соответствует области необратимой адсорбции ТСФК (0.4-0.7мг/г). Наиболее вероятной причиной необратимой адсорбции является капсулирование молекул фталоцианина в межслоевом пространстве Al-М, поскольку межслоевое расстояние между слоями Al-М (~1,9 нм) сопоставимо с размерами молекулы ТСФК.
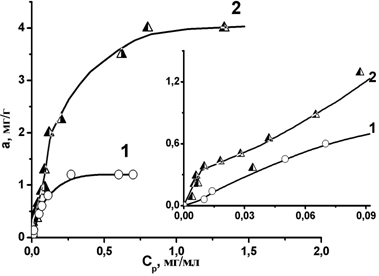
Рис.1 – Изотермы адсорбции ТСФК на Na-М(1) и Al-МC(2) из водного раствора при 25oC
По данным спектроскопии диффузного отражения в спектре образца, содержащего 0.75 мг ТСФК на 1 г Al-М (рис. 2, спектр 2) наблюдается интенсивная полоса в области 667 нм. При увеличении содержания ТСФК на поверхности носителя (рис. 2, спектры 2 и 3) в спектрах появляется полоса в области 610-627 нм. Согласно [26, 27] полоса поглощения в области 660-670 нм характеризует мономерную форму ТСФК; а полоса в области 610-627 нм – агрегированные структуры ТСФК. В спектрах адсорбированного ТСФК не наблюдается смещения максимумов полос поглощения в сравнении со спектрами водных растворов ТСФК [19], что свидетельствует об отсутствии сильного взаимодействия между молекулами ТСФК и поверхностными группами носителя Al-М.
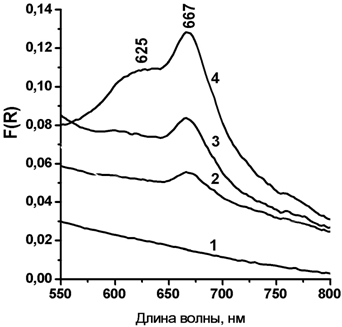
Рис.2 – Спектры диффузного отражения образцов ТСФК/Al-М (1 – Al-М; 2 – 0,75 мг ТСФК/г Al-М; 3 – 2,3 мг ТСФК/г Al-М; 4 – 4 мг ТСФК/г Al-М)
Каталитические свойства ТСФК, необратимо адсорбированного на Al-М
В таблице 2 приведены скорости реакции окисления Na2S кислородом на катализаторах, содержащих 0.04¸0.67 мг ТСФК на 1 г Al-М, нормированные на единицу количества ТСФК и определенные в условиях, когда содержание активного компонента в реакционной среде было одинаковым и составляло 0.019 мг. Видно, что активность катализаторов с различным содержанием ТСФК практически совпадает. Это указывает на то, что в области необратимой адсорбции молекулы ТСФК слабо ассоциированы и находятся преимущественно в виде изолированных молекул, что согласуется с данными спектроскопии диффузного отражения (рис. 2).
На рис. 3 представлено сопоставление активностей гетерогенных катализаторов и гомогенного катализатора ТСФК, взятых в эквивалентных количествах. Видно, что гетерогенный катализатор, содержащий 0.004 мг ТСФК на 0.1 г носителя и гомогенный катализатор, взятый в количестве 0.004 мг, имеют одинаковую активность. Но при увеличении концентрации для гетерогенного катализатора скорость реакции возрастает постепенно, а для гомогенного катализатора при низких концентрациях ТСФК (0.004 и 0.02 мг) скорость реакции практически постоянна, и лишь при дальнейшем увеличении концентрации возрастает и при концентрации ТСФК в реакционной среде 0.067 мг активность гомогенного катализатора почти в 2 раза выше активности гетерогенного катализатора.
Согласно данным УФ-спектроскопии водных растворов фталоцианина кобальта (рис. 4) при низкой концентрации ТСФК (0.00024 мг/мл) наблюдается пик в области 667 нм, что характерно для мономерной формы ТСФК (спектр 1). При увеличении концентрации в растворе образуется димерная форма, которой соответствует пик в области 628 нм (спектр 2). Таким образом, можно предположить, что возрастание активности с увеличением концентрации ТСФК в растворе связано с ассоциацией молекул в димерную форму, которая обладает более высокой активностью в данной реакции, чем мономерная. Для гетерогенных систем в области концентраций 0.04¸0.67 мг ТСФК/г каталитическая активность определяется мономерной формой ТСФК.
Таблица 2 – Скорость реакции окисления Na2S кислородом на катализаторе ТСФК/Al-М (25оС, рН=7.2, 0,05М Na2S, Vраствора = 25мл, содержание активного компонента в реакционной среде 0.019 мг)
| ТСФК/Al-М, мг×г-1 | W, мл О2×мин-1×мг ТСФК-1 |
| 0.04 | 104 |
| 0.19 | 107 |
| 0.67 | 112 |
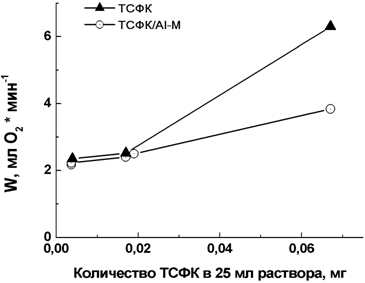
Рис. 3 – Зависимость скорости реакции окисления Na2S кислородом в присутствии гомогенного и гетерогенного ТСФК от концентрации ТСФК (25оС; рН = 7.2; 0.05 M Na2S; объем реакционного раствора – 25 мл)
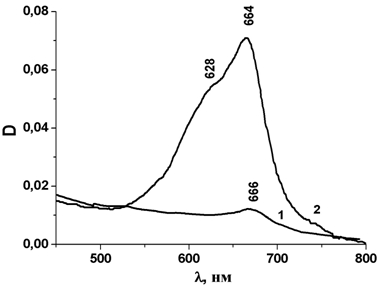
Рис.4 – УФ-cпектры водных растворов ТСФК с концентрацией 0.00024 мг/мл (1) и 0.012 мг/мл (2)
Полученные результаты позволяют заключить, что методом адсорбции из водных растворов можно обеспечить прочное закрепление ТСФК с сохранением реакционной способности центрального атома кобальта (II) на катионных смектитных глинах с межслоевым расстоянием, сопоставимым с размером молекулы фталоцианина.
| Финансирование
Работа выполнена при поддержке РАН и ФАНО России в рамках государственного задания ИК СО РАН (проект №0303-2016-0014). |
Funding
This work was supported by the Russian Academy of Sciences and the Russian Academy of Science and Industry within the framework of the state assignment of the IC SB RAS (project No.0303-2016-0014). |
| Конфликт интересов
Не указан. |
Conflict of Interest
None declared. |
Список литературы / References
- Коваленко О. Н. Низкотемпературное каталитическое окисление сероводорода кислородом в растворах и газовой фазе и возможности его применения для процессов сероочистки / О. Н. Коваленко, Н. Н. Кундо // Химия в интересах устойчивого развития. 1999. – Т. 7. – № 4 – С. 397-409.
- Mazgarov A. M. New catalysts and processes for removal of mercaptans from petroleum and petroleum products / A. M. Mazgarov, A.F. Vil’danov // Petroleum Chemistry. 1999. – V. 39. – № 5. – P. 336-343.
- Кундо Н. Н. Механизм каталитического действия тетрасульфофталоцианина кобальта / Н. Н. Кундо, Н.П. Кейер // Журнал физической химии. 1968. – Т. 42. – № 6. – С. 1352-1358.
- Schutten J. H. Autooxidation of mercaptanes promoted by a bifunctional catalyst prepared by polymer attachment of cobalt-phthalocyanine / J. H. Schutten, J. Zwart // Journal of Molecular Catalysis. 1979. – V. 5. – № 2. – P. 109-123.
- Денисова Е. П. Адсорбционные взаимодействия нитрозамещенных фталоцианинов кобальта и железа с носителями различной природы / Е. П. Денисова, С. А. Борисенкова, Е. Г. Гиренко и другие // Вестник Московского Университета. Серия 2. Химия. 1996. – Т. 37. – № 6. – С. 575-579.
- Akopyans Y. G. Synthesis and characterization of cobalt phthalocyanines covalently attached to silica / Y. G. Akopyans, S. A. Borisencova, O. L. Kaliya and others // Journal of Molecular Catalysis. 1993. – V. 83. – № 1-2. – P. 1-16.
- Haber J. Cationic metalloporphyrins and other macrocyclic compounds in zeolite matrix as catalysts for oxidation with dioxygen / J. Haber, K. Pamin, J. Połtowicz // Journal of Molecular Catalysis. A: Chemical. 2004. – V. 224. – № 1-2. – P. 153-159.
- Iliev V. I. Oxidation and photooxidation of sulfur-containing compounds in the presence of immobilized phthalocyanine complexes / V. I. Iliev, A. I. Ileva, L. Bilyarska // Journal of Molecular Catalysis. A: Chemical. 1997. – V. 126. № 2-3. – P. 99-108.
- Stuchinskaya T. Cobalt phthalocyanine derivatives supported on TiO2 by sol–gel processing: Part 2. Activity in sulfide and ethanethiol oxidation / T. Stuchinskaya, N. Kundo, L. Gogina and others // Journal of Molecular Catalysis. A: Chemical. 1999. – V. 140. № 3 – P. 235-240.
- Розенгарт М. И. Слоистые силикаты как катализаторы / М. И. Розенгарт, Г. М. Вьюнова, Г. В. Исагулянц // Успехи химии. – Т. 57. – № 2 – С. 204-227.
- Liu H. Catalytic oxidation of mercaptans by bifunctional catalysts composed of cobalt phthalocyanine supported on Mg–Al hydrotalcite-derived solid bases: effects of basicity / H. Liu, E. Min // Green Chemistry. 2006. – V. 8. – № 7. – P. 657-662.
- Tang X. Heterogeneous photo-Fenton degradation of methylene blue under visible irradiation by iron tetrasulphophthalocyanine immobilized layered double hydroxide at circumneutral pH / X. Tang, Y. Liu // Dyes and Pigments. 2016. – V. 134 – N 11. – P. 397-408.
- Jagtap N. Encapsulation of Co phthalocyanine in alumina-pillared clays and their characterization / N. Jagtap., V. Ramaswamy // Clays and Clay Minerals. 2006. – V. 54. – № 1. – P. 54-61.
- Ramaswamy V. Immobilization and characterization of copper chlorophthalocyanine on alumina-pillared montmorillonite/ V. Ramaswamy, M. S. Krishnan, A. V. Ramaswamy // Journal of Molecular Catalysis. A: Chemical. 2002. – V. 181. – № 1-2. – Р. 81-89.
- Khankhasaeva S. Ts. The Effect of Modification on the Structural, Acidic, and Catalytic Properties of a Layered Aluminosilicate / S. Ts. Khankhasaeva, S. V. Badmaeva, E. Ts. Dashinamzhilova and others // Kinetics and Catalysis. 2004. – Т. 45. – № 5. – С. 708-713.
- Weber J. H. Complexes Derived from Strong Field Ligands. XIX. Magnetic Properties of Transition Metal Derivatives of 4,4′,4″,4”’-Tetrasulfophthalocyanine / J. H. Weber, D. H. Bush // Inorganic Chemistry. 1965. – V.4. – № 4 – P. 469-471.
- Карякин Ю. В. Чистые химические вещества. / Ю. В. Карякин, И. И. Ангелов – 4-е изд. – М.: Химия, 1974. – 408 c.
- Лурье Ю.Ю. Аналитическая химия промышленных и сточных вод. / Ю.Ю. Лурье – 4-е изд. – М.: Химия, 1984. – 448 c.
- Abel, E. W. The association of cobalt (II) tetrasulphophthalocyanine / E. W. Abel, J. M. Pratt, R. Whelan // Journal of the Chemical Society, Dalton Transactions. – 1976. – P. 509-514.
Список литературы на английском языке / References in English
- Kovalenko O. H. Nizkotemperaturnoe kataliticheskoe okislenie serovodoroda kislorodom v rastvorah i gazovoj faze i vozmozhnosti ego primenenija dlja processov seroochistki [Low-temperature catalytic oxidation of hydrogen sulfide by oxygen in solutions and gas phase and the possibility of its application for desulfurization processes] / O. H. Kovalenko, H. H. Kundo // Himija v interesah ustojchivogo razvitija [Chemistry for Sustainable Development]. 1999. – V. 7. – № 4 – P. 397-409. [In Russian]
- Mazgarov A. M. New catalysts and processes for removal of mercaptans from petroleum and petroleum products / A. M. Mazgarov, A.F. Vil’danov // Petroleum Chemistry. 1999. – V. 39. – № 5. – P. 336-343.
- Kundo N. N. Mehanizm kataliticheskogo dejstvija tetrasul’foftalocianina kobal’ta [Mechanism of catalytic action of cobalt tetrasulfophthalocyanine] / N. N. Kundo N. P. Keier // Zhurnal fizicheskoj himii [Journal of Physical Chemistry]. 1968. – V. 42. – № 6. – P. 1352-1358. [In Russian]
- Schutten J. H. Autooxidation of mercaptanes promoted by a bifunctional catalyst prepared by polymer attachment of cobalt-phthalocyanine / J. H. Schutten, J. Zwart // Journal of Molecular Catalysis. 1979. – V. 5. – № 2. – P. 109-123.
- Denisova E. P. Adsorbcionnye vzaimodejstvija nitrozameshhennyh ftalocianinov kobal’ta i zheleza s nositeljami razlichnoj prirody [Adsorption interactions of nitro-substituted phthalocyanines of cobalt and iron with carriers of various types] / Denisova E. P., Borisenkova C. A., Girenko E. G. and others // Vestnik Moskovskogo universiteta. Serija 2. Himija [Bulletin of the Moscow University. Series 2. Chemistry]. 1996. – V. 37. – № 6. – P. 575-579. [In Russian]
- Akopyans Y. G. Synthesis and characterization of cobalt phthalocyanines covalently attached to silica / Y. G. Akopyans, S. A. Borisencova, O. L. Kaliya and others // Journal of Molecular Catalysis. 1993. – V. 83. – № 1-2. – P. 1-16.
- Haber J. Cationic metalloporphyrins and other macrocyclic compounds in zeolite matrix as catalysts for oxidation with dioxygen / J. Haber, K. Pamin, J. Połtowicz // Journal of Molecular Catalysis. A: Chemical. 2004. – V. 224. – № 1-2. – P. 153-159.
- Iliev V. I. Oxidation and photooxidation of sulfur-containing compounds in the presence of immobilized phthalocyanine complexes / V. I. Iliev, A. I. Ileva, L. Bilyarska // Journal of Molecular Catalysis. A: Chemical. 1997. – V. 126. № 2-3. – P. 99-108.
- Stuchinskaya T. Cobalt phthalocyanine derivatives supported on TiO2 by sol–gel processing: Part 2. Activity in sulfide and ethanethiol oxidation / T. Stuchinskaya, N. Kundo, L. Gogina and others // Journal of Molecular Catalysis. A: Chemical. 1999. – V. 140. № 3 – P. 235-240.
- Rozengart M. I. Sloistye silikaty kak katalizatory [Layered Silicates as Catalysts] / M. I. Rozengart, G. M. V’yunova, G. V. Isagulyants // Uspehi himii [Russian Chemical Reviews] 1988. – V. 57 – № 2. – P. 204-227. [In Russian]
- Liu H. Catalytic oxidation of mercaptans by bifunctional catalysts composed of cobalt phthalocyanine supported on Mg–Al hydrotalcite-derived solid bases: effects of basicity / H. Liu, E. Min // Green Chemistry. 2006. – V. 8. – № 7. – P. 657-662.
- Tang X. Heterogeneous photo-Fenton degradation of methylene blue under visible irradiation by iron tetrasulphophthalocyanine immobilized layered double hydroxide at circumneutral pH / X. Tang, Y. Liu // Dyes and Pigments. 2016. – V. 134 – N 11. – P. 397-408.
- Jagtap N. Encapsulation of Co phthalocyanine in alumina-pillared clays and their characterization / N. Jagtap., V. Ramaswamy // Clays and Clay Minerals. 2006. – V. 54. – № 1. – P. 54-61.
- Ramaswamy V. Immobilization and characterization of copper chlorophthalocyanine on alumina-pillared montmorillonite/ V. Ramaswamy, M. S. Krishnan, A. V. Ramaswamy // Journal of Molecular Catalysis. A: Chemical. 2002. – V. 181. – № 1-2. – Р. 81-89.
- Khankhasaeva S. Ts. The Effect of Modification on the Structural, Acidic, and Catalytic Properties of a Layered Aluminosilicate / S. Ts. Khankhasaeva, S. V. Badmaeva, E. Ts. Dashinamzhilova and others // Kinetics and Catalysis. 2004. – Т. 45. – № 5. – С. 708-713.
- Weber J. H. Complexes Derived from Strong Field Ligands. XIX. Magnetic Properties of Transition Metal Derivatives of 4,4′,4″,4”’-Tetrasulfophthalocyanine / J. H. Weber, D. H. Bush // Inorganic Chemistry 1965. – V.4. – № 4 – P. 469-471.
- Karjakin Ju. V., Angelov I.I. Chistye himicheskie veshhestva [Pure chemicals] / Ju. V. Karjakin, I.I. Angelov – 4th edition – M.: Himija, 1974. – 408 p. [In Russian]
- Lur’e Ju. Ju. Analiticheskaja himija promyshlennyh i stochnyh vod. [Analytical chemistry of industrial and waste water] / Ju. Ju. Lur’e – 4th edition – M.: Himija, 1984. – 448 p. [In Russian]
- Abel, E. W. The association of cobalt (II) tetrasulphophthalocyanine / E. W. Abel, J. M. Pratt, R. Whelan // Journal of the Chemical Society, Dalton Transactions. – 1976. – P. 509-514.




