Ключевые слова: атопический дерматит, уход за кожей, эмоленты, лечение, профилактика.
Для цитирования: Мигачева Н.Б. Роль современных средств ухода за кожей в лечении и профилактике атопического дерматита // РМЖ. 2017. №5. С. 373-380
Migacheva N.B.
Samara State Medical University
Atopic dermatitis, the most common allergic disorder in children, is an important medical issue due to its chronic recurrent nature, diversity and severity of clinical manifestations, negative impact on the quality of life, and the lack of curative treatment. Considering this, the major goals are the improvement of treatment approaches and the development of effective preventive measures. As we extend our knowledge on the pathogenic mechanisms of atopic dermatitis and the role of compromised skin barrier in the development and maintenance of chronic skin inflammation, it becomes clear that topical agents promoting corneal layer reparation should be the heart of basic therapy. Moreover, recent date demonstrate that these agents are potentially effective for primary prevention of atopic dermatitis. This paper reviews pathogenic role of epidermal barrier dysfunction in atopic dermatitis as well as the importance of skin care products for the prevention and treatment of this disorder.
Key words: atopic dermatitis, skin care, emollients, treatment, prevention.
For citation: Migacheva N.B. Modern skin care products for the prevention and treatment of atopic dermatitis // RMJ. 2017. № 5. P. 373–380.
В статье рассмотрена роль современных средств ухода за кожей в лечении и профилактике атопического дерматита
Одной из наиболее значимых тенденций наступившего тысячелетия, по мнению экспертов ВОЗ, стал неуклонный рост распространенности хронических неинфекционных заболеваний, среди которых особое место занимают аллергические болезни [1]. При этом сегодня мы имеем дело с так называемой второй волной эпидемии – резким скачком распространенности пищевой аллергии и атопического дерматита (АтД) [2].
Именно АтД является самым частым из хронических заболеваний кожи вообще [3] и одним из первых проявлений аллергии у детей, дебютирует в раннем возрасте (в подавляющем большинстве случаев – до 1 года), характеризуется хроническим рецидивирующим течением, многообразием и тяжестью клинических проявлений, в связи с чем представляет собой серьезную проблему современной педиатрии [4]. Все больше данных свидетельствуют о том, что АтД оказывает негативное влияние на качество жизни пациентов и их семей, а также является причиной значительного экономического бремени как на семейном, так и на государственном уровне [5]. Более того, АтД почти у половины детей становится первым шагом на пути реализации атопического марша, характеризующегося последующим развитием симптомов респираторной аллергии в виде аллергического ринита и/или бронхиальной астмы [6].
Именно поэтому внимание специалистов в области аллергологии-иммунологии, дерматологии, педиатрии сегодня приковано к изучению механизмов формирования аллергической сенсибилизации при АтД и созданию новых эффективных стратегий лечения и профилактики этого заболевания. Ключевым звеном в этом поиске становятся новые данные о патофизиологии АтД и понимание роли дисфункции кожного барьера в формировании и поддержании хронического воспалительного процесса в коже [7], а также доказательства эффективности воздействия на эти механизмы с помощью современных увлажняющих и смягчающих косметических средств.
Целью настоящего обзора является систематизация накопленных к настоящему времени данных о значении дисфункции кожного барьера в патогенезе АтД и формировании аллергической сенсибилизации, о роли современных средств ухода за кожей в программах лечения заболевания, а также о новых перспективах их использования с целью первичной профилактики АтД и других аллергических болезней.
Содержание статьи
Дисфункция кожного барьера при АтД
Серьезный прогресс в понимании патогенеза АтД в последние годы связан в первую очередь с пересмотром роли барьерной функции кожи и ее нарушения у пациентов-атопиков. Безусловно, АтД является мультифакториальным заболеванием, в развитии которого имеют значение как генетические, так и средовые факторы [8]. Однако большинство проведенных в настоящее время исследований подтверждают, что именно дисфункция эпидермального барьера на фоне измененного иммунного ответа играет важнейшую роль как в развитии АтД [7], так и в последующем формировании чрескожной сенсибилизации и реализации атопического марша [9].
В сложный патогенетический процесс вовлечены все виды кожного барьера: физический (роговой слой, десмосомы, плотные межклеточные контакты), биохимический (липиды, органические кислоты, лизосомы, антимикробные пептиды), иммунный (лимфоциты, нейтрофилы, моноциты, клетки Лангерганса). В результате нарушения их функций при АтД происходят, с одной стороны, увеличение трансэпидермальной потери влаги (TEWL – transepidermal water loss) и снижение способности связывания влаги кожей больного, а с другой стороны – усиление проницаемости кожного барьера для внешних неблагоприятных агентов (микробных и химических антигенов, токсинов, аллергенов) [10].
Основные события, приводящие к нарушению барьерной функции кожи, разворачиваются в самом поверхностном – роговом – слое (Stratum Corneum), дефекты функционирования которого обусловлены множеством врожденных и приобретенных механизмов [11]. Одним из наиболее хорошо изученных факторов, принимающих участие в этом процессе, является дефект гена филаггрина – структурного белка кожи, без которого не может осуществляться процесс дифференцировки клеток эпидермиса [12]. Филаггрин образуется из профилаггрина в зернистом слое эпидермиса и распадается на аминокислоты в верхней части рогового слоя, где продукты его метаболизма участвуют в поддержании оптимального значения pH кожи и обеспечивают необходимую влажность рогового слоя [13]. Показано, что носительство мутации гена филаггрина, приводящее к его отсутствию или недостаточной продукции, достоверно коррелирует с недостаточной увлажненностью кожи и высокой трансэпидермальной потерей влаги [14], что, в свою очередь, ассоциировано с риском пищевой сенсибилизации и более тяжелым течением АтД [15]. В то же время мутации гена филаггрина обнаруживаются у 3–55% пациентов с АтД и не являются единственным и/или обязательным условием для его формирования, вероятно, лишь способствуя развитию заболевания при наличии у индивидуума других генетических и эпигенетических предпосылок [16].
К таким предпосылкам относится изменение pH кожного покрова в сторону повышения, приводящее к увеличению его проницаемости [17], что связано с деградацией липид-процессируемых энзимов, необходимых для образования натурального увлажняющего фактора из молекул филаггрина [18]. Кроме того, повышение pH кожи у пациентов с АтД и мутациями гена филаггрина является одной из предпосылок, поддерживающих рост инфекционных агентов, в частности S. аureus [19]. Недавние исследования на мышиных моделях показали возможность частично предотвращать формирование дисфункции кожного барьера и подавлять иммунные нарушения при АтД за счет повышения кислотности рогового слоя [20], что может послужить основой для создания новых направлений лечения и профилактики этого заболевания.
Еще одним фактором, необходимым для обеспечения адекватного функционирования кожного барьера, являются плотные межклеточные контакты, которые играют основную роль в ограничении и регуляции парацеллюлярной диффузии и миграции клеток воспаления, а также в процессах пролиферации, поляризации и дифференцировки эпителиальных клеток [21]. Накоплено множество доказательств наличия у пациентов с АтД композиционного и функционального дефекта плотных контактов [22, 23], что способствует повышению проницаемости кожного барьера. Более того, в исследованиях на животных показано, что блокирование продукции клаудина – основного белка плотных контактов – приводит к нарушению формирования у мышей рогового слоя, значительному повышению трансэпидермальной потери влаги и гибели животных [24]. Наконец, было продемонстрировано снижение в очагах поражения кожи у пациентов с АтД активации Toll-подобных рецепторов (TLR2), необходимой как для обеспечения адекватного функционирования плотных контактов в кератиноцитах [25], так и для распознавания различных микробных антигенов и регуляции активности антимикробных пептидов, в частности бета-дефензина [26].
Антимикробные пептиды (AMPs), являясь важнейшим компонентом врожденной иммунной защиты кожи против различных инфекционных агентов и опухолевых антигенов, обладают также способностью влиять на воспалительный ответ и процессы регенерации и репарации в коже [27]. У пациентов с АтД описано снижение продукции AMPs и локальной бактерицидной активности [28, 29], что является главной причиной инфицирования и колонизации кожи больных бактериальными (S. aureus) и грибковыми агентами и одной из важнейших проблем лечения заболевания, поскольку именно стафилококковые суперантигены способны индуцировать гиперпродукцию IgE и поддерживать воспаление при АтД [30].
Значительную роль в нарушении защитных свойств кожного барьера играют и изменения в составе липидов рогового слоя, основными из которых являются церамиды, жирные кислоты и холестерол [31]. Показано селективное снижение уровня церамидов (в частности, церамида 1) у пациентов с АтД, что связано как с подавлением на фоне нейтральной pH активности энзимов, обеспечивающих процессинг липидов, так и с повышенной кислотной церамидазной активностью [32]. Дефект липидного барьера усугубляет подверженность больных АтД колонизации S. aureus, поскольку нарушенный метаболизм церамидов приводит к снижению уровня в роговом слое сфингозина, обладающего высокой антимикробной активностью [33].
Регуляция метаболизма липидов, а также процесса эпидермальной дифференцировки в значительной степени определяется активностью особых классов рецепторов, экспрессируемых клетками кожи, – рецепторов, активируемых протеиназами (PAR), и рецепторов, активируемых пероксисомными пролифераторами (PPARs). Они принимают участие в контроле процессов клеточной пролиферации и дифференцировки, проницаемости кожного барьера и регуляции воспалительного ответа в коже [34]. Доказано, что клетки кожи, вовлеченные в воспалительный процесс, экспрессируют более высокий уровень PAR-2, активация которого имеет важнейшее значение в развитии зуда при АтД [35]. Напротив, более низкая экспрессия PPARs, выявляемая в очагах поражения у пациентов с АтД, является одним из механизмов нарушения целостности эпидермального барьера и формирования аллергического воспаления [36]. Результаты современных исследований дают серьезные основания полагать, что использование антагонистов PAR-2 и активаторов PPARs, в т. ч. топических, может стать одним из новых направлений лечения АтД [37–39].
Немаловажное значение в поддержании воспалительного процесса в коже при АтД имеет и механическое повреждение кожного барьера. Зуд, являясь одной из важнейших проблем у взрослых и детей с АтД, часто сопровождается расчесыванием и последующим повреждением кожи с разрушением эпителиальных и эндотелиальных клеток [40], что способствует выбросу из них аларминов (ассоциированных с повреждением молекулярных частиц), к которым относятся гистамин, эозинофильный нейротоксин, интерлейкин-33 и др. [41]. Они, в свою очередь, активируют различные типы клеток, участвующих в развитии аллергического воспаления: мастоциты, резидуальные тканевые клетки, врожденные лимфоидные клетки 2 типа [42]. Именно поэтому поиск средств, эффективно подавляющих зуд, является одной из приоритетных задач в лечении пациентов с АтД.
Роль нарушения функции кожного барьера в формировании аллергической сенсибилизации
В течение длительного времени не вызывала сомнений идея о том, что кожа является эффективным барьером на пути проникновения извне различных антигенов и препятствует развитию патологического иммунного ответа, в т. ч. сенсибилизации к поверхностно воздействующим аллергенам [13]. Предполагалось, что белки с высоким молекулярным весом не абсорбируются через кожу. Однако в последующем выяснилось, что такие высокомолекулярные протеины могут захватываться дендритными клетками, что приводит к реализации иммунного ответа, в т. ч. патологического [43]. Так, анализ результатов проспективного когортного исследования почти 1500 дошкольников в Великобритании в 2003 г. обнаружил ассоциацию между наличием у детей аллергии на арахис и использованием в раннем возрасте средств для ухода за кожей, содержащих арахисовое масло [44]. В то же время было доказано, что кожа может способствовать формированию толерантности при эпикутанном контакте с аллергеном, что и было продемонстрировано у пациентов с пищевой и пыльцевой аллергией, а также на мышиных моделях [45, 46].
Ответ на вопрос, в каких случаях воздействие антигена на кожу приводит к развитию сенсибилизации, а в каких – к толерантности, стал проясняться после доказательства индукции Th2-опосредованного иммунного ответа и экспрессии тимического стромального лимфопоэтина (TSLP) у пациентов с АтД на фоне механического повреждения кожи [47]. В последующем исследовании на моделях животных показали, что именно интактная (неповрежденная) кожа является обязательным фактором безопасности и эффективности эпикутанной иммунотерапии [48]. А в проспективных когортных исследованиях подтвердили, что атопический дерматит является достоверным фактором риска развития сенсибилизации к яйцу [49] и арахису [44], а экзема рук – к латексу [50].
Накопившиеся данные послужили основанием для появления и широкого распространения в научной среде гипотезы «двойной аллергенной экспозиции», согласно которой энтеральное поступление пищевых антигенов в организм приводит к формированию пищевой толерантности, а их накожная экспозиция при АтД – к пищевой сенсибилизации [51]. В настоящее время имеется достаточное количество подтверждений данной гипотезы, в т. ч. и доказанная ассоциация дефекта гена филаггрина с аллергией на арахис и развитием респираторных аллергических заболеваний, несмотря на отсутствие экспрессии филаггрина в кишечной стенке и бронхиальном эпителии [12, 52]. А опубликованный недавно систематический обзор 66 исследований, изучавших взаимосвязь между АтД и пищевой аллергией, показал, что АтД, действительно, часто предшествует развитию пищевой сенсибилизации [53].
Кроме того, имеются основания предполагать, что чрескожной пенетрации аллергенов, в т. ч. антигена клеща домашней пыли, способствуют механические повреждения кожи, изменение ее pH и состава плотных межклеточных контактов, воздействие протеазных антигенов, что увеличивает возможность реализации системного аллергического процесса и является одним из механизмов развития атопического марша [23]. Интересно, однако, что проспективное наблюдение за детьми с различными типами дерматозов в первые месяцы жизни (экзема, себорейный дерматит, интертриго и пеленочный дерматит) выявило более высокую частоту реализации АтД и свистящего дыхания в возрасте 2 лет именно в группе младенцев с экземой [54].
Таким образом, современные данные подтверждают, что нарушение функции эпидермального барьера на фоне измененного иммунного ответа не только играет важнейшую роль в патогенезе АтД (рис. 1), но и способствует формированию эпикутанной аллергической сенсибилизации и последующей реализации атопического марша [9]. А это, в свою очередь, дает возможность переосмыслить роль средств ухода за кожей в программах лечения пациентов с АтД, а также их использование для профилактики аллергических заболеваний.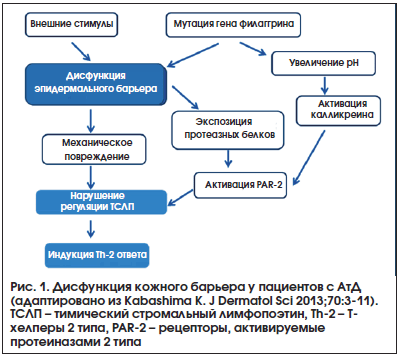
Современные средства ухода за кожей в лечении АтД
Значительное улучшение понимания патофизиологии АтД в последние десятилетия внесло серьезные коррективы в подходы к ведению пациентов. Поскольку дисфункция кожного барьера в настоящее время рассматривается в качестве ключевого механизма патогенеза этого хронического заболевания, одним из важнейших направлений его лечения стало обязательное использование пациентами специальных средств ухода за кожей, что определяется всеми современными международными и отечественными согласительными документами как базовая терапия АтД [3, 55, 56]. Главными целями такого базового ухода являются увлажнение кожи и нормализация основных функций эпидермального барьера, в т. ч. снижение трансэпидермальной потери влаги, а также чрескожной пенетрации аллергенов и инфекционных агентов [57], что достигается путем использования топических смягчающих и увлажняющих средств.
Интересно, что в настоящее время не существует официального консенсуса в отношении определения увлажняющих и смягчающих средств ухода за кожей [58], так же как нет доказательств преимуществ использования конкретных их классов при определенных фенотипах АтД [59]. Термин «увлажнители» (“moisturizers”) впервые был предложен в конце прошлого века американскими маркетологами, хотя желание нанести на сухую кожу смягчающие маслянистые вещества можно считать столь же старым, как само человечество [60]. В зависимости от механизма действия все увлажняющие и смягчающие косметические средства можно разделить на 4 основных класса [61]: эмоленты, хумектанты, окклюзивные вещества и восстановители белка. При этом у пациентов с АтД используются преимущественно продукты первых 3 классов (табл. 1).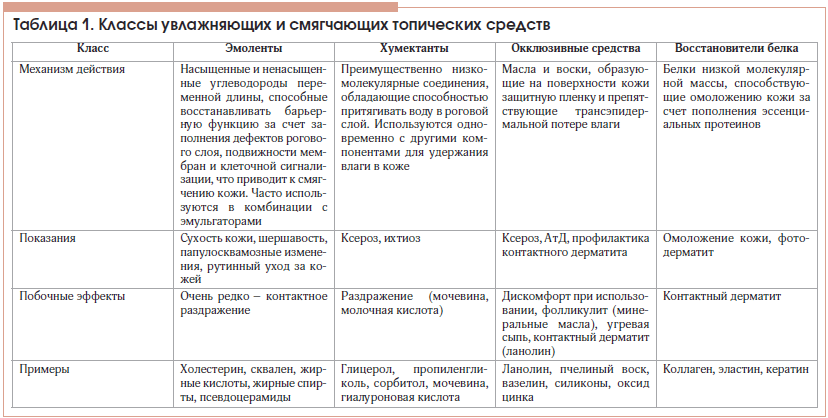
При обсуждении вопросов, связанных с базовой терапией АтД, все средства ухода за кожей часто объединяют термином «эмоленты». Это, действительно, один из самых необходимых для пациентов с АтД классов косметических средств, включающий компоненты (чаще всего липиды и масла), подобные натуральным липидам рогового слоя и себума, способные придавать коже мягкость и эластичность [62]. Холестерин, церамиды или псевдоцерамиды, длинноцепочечные насыщенные жирные кислоты (линолевая, линоленовая, олеиновая и др.) восстанавливают эпидермальный барьер, встраиваясь в естественную архитектуру липидного матрикса кожи [63]. Так, было показано, что использование крема на основе псевдоцерамидов у пациентов с АтД хотя и не влияло на тяжесть течения заболевания, однако значительно улучшало влажность кожи, а также снижало потребность пациентов в применении топических кортикостероидов [64]. Сквален, являясь одним из важных липидов, продуцируемых клетками кожи человека, и компонентом кожного сала, также широко используется в составе эмолентов, обладая дополнительной способностью защищать поверхность кожи от перекисного окисления липидов в результате воздействия ультрафиолетового и других источников ионизирующего излучения [61].
Хумектанты (собственно увлажняющие средства) – гигроскопические соединения, способные привлекать молекулы воды в эпидермис как из дермы, так и из окружающей среды при соответствующих условиях. Многие хумектанты обладают одновременно и качествами эмолентов [63]. Так, натуральный увлажняющий фактор, состоящий из смеси низкомолекулярных гигроскопических соединений (молочная кислота, пирролидон карбоновой кислоты, аминокислоты), является «важнейшим игроком на арене поддержания высокой влажности кожи» [63]. Наиболее часто используемыми ингредиентами из этой группы являются глицерин, мочевина, пропиленгликоль. Однако в связи с возможностью раздражающего действия средства, содержащие мочевину и пропиленгликоль, не рекомендуются для применения у детей раннего возраста [65, 66]. В двойном слепом плацебо-контролируемом исследовании был показан положительный эффект увлажняющего средства на основе глицерина на состояние кожи у пациентов с АтД, сопровождавшийся значительным повышением влажности рогового слоя [67].
Окклюзивные компоненты, среди которых наиболее часто используются вазелин, ланолин, минеральное масло и силиконы, представляют собой вещества, физически блокирующие трансэпидермальную потерю влаги за счет создания на поверхности кожи гидрофобного барьера. Показано, что вазелин обладает наиболее мощным влагосберегающим эффектом, в минимальной концентрации 5% снижая показатель TEWL более чем на 98% [68]. Тем не менее применение средств этой группы может быть несколько ограничено в связи с наличием запаха, ощущения жирности кожи после их использования и потенциальной аллергенности.
Современные средства ухода за кожей пациентов с АтД содержат, как правило, комплекс ингредиентов, обладающих различными механизмами действия, что значительно повышает их эффективность. Кроме того, в последние годы появляется все больше продуктов для ухода, содержащих в своем составе дополнительные компоненты, к которым относятся различные растительные субстанции (алоэ, аллантоин, бисаболол, экстракты овса, ячменя, масло ши и др.), витамины (Д-пантенол, ниацинамид, альфа-токоферол и пр.), соли магния и цинка, а также лизаты бактерий и пребиотики [61, 69]. Помимо дополнительного смягчающего, увлажняющего и антиоксидантного действия такие ингредиенты способны оказывать противовоспалительный, противозудный и антимикробный эффект. Так, в клинических исследованиях подтверждены более высокая эффективность у пациентов с АтД средств ухода за кожей, содержащих масло ши, по сравнению с обычным эмолентом на основе церамидов [70], а также значительное улучшение кожной гидратации при использовании увлажняющих средств с аргановым маслом [71].
Одним из таких примеров является новая разработка российской компании «Аванта» (Краснодар) – линия специализированных косметических средств atopic® для детей с АтД, которые в качестве основного ингредиента содержат патентованную формулу на основе масла ши, арганового масла и воска ячменного зерна (торговая марка Stimu-Tex® AS, Pentapharm, Швейцария). Открытое несравнительное наблюдение пациентов с АтД, получавших в качестве средств ухода за кожей atopic®, подтвердило клиническую эффективность продуктов серии [72]. Показано, что они достоверно улучшают состояние кожи у детей с АтД, не оказывают раздражающего и сенсибилизирующего действия. При регулярном использовании Крем для ежедневного ухода atopic® улучшает показатель увлажненности кожи и снижает значение показателя трансэпидермальной потери влаги. Применение Крема успокаивающего atopic® приводило к значительному снижению индекса SCORAD за 14 дней применения, при этом резко уменьшались субъективные симптомы, такие как зуд и нарушения сна у детей.
Результаты других исследований продемонстрировали, что пребиотик Биолин в составе эмолентов способствует повышению влажности кожи, увеличивает продукцию кожного сала и снижает TEWL [73], а эмолент на основе термальной воды с входящим в состав крема экстрактом Aquaphilus dolomiae обладает положительным действием на состав кожной микрофлоры [74]. Наконец, доказано, что некоторые дополнительные компоненты увлажняющих средств (флавоноиды, агонисты PPARs) способны подавлять продукцию провоспалительных цитокинов и оказывать значительный клинический эффект в отношении не только признаков воспаления и сухости кожи, но и интенсивности зуда [75–77].
Завершая обсуждение роли современных средств ухода за кожей в программах лечения пациентов с АтД, можно выделить их основные эффекты, к которым относятся:
• Увлажняющее и смягчающее действие – гидратация, обеспечивающая повышение содержания влаги в роговом слое, и восстановление липидного матрикса кожи [60, 63, 68].
• Противовоспалительное действие: некоторые ингредиенты современных увлажняющих средств подавляют выработку провоспалительных цитокинов путем блокирования активности циклооксигеназы, оказывая таким образом успокаивающее действие на воспаленную кожу [65, 75, 78].
• Противозудное действие: многие из эмолентов способны подавлять зуд за счет торможения продукции цитокинов. Кроме того, использование увлажняющих средств на водной основе сопровождается испарением воды с поверхности кожи, что приводит к развитию охлаждающего эффекта [61, 75, 77].
• Антимикробное действие: подавляют активность микроорганизмов на поверхности кожи, что имеет большое значение в поддержании контроля за бактериальной и грибковой контаминацией у пациентов с АтД [80, 81].
• Репаративное действие: гиалуроновая кислота и некоторые другие компоненты могут оказывать положительный эффект на процесс заживления ран, расчесов и трещин кожи [61, 63].
В совокупности все перечисленные эффекты приводят к улучшению клинического течения АтД: уменьшению частоты обострений и их выраженности [59, 63, 82, 83], снижению потребности в ТКС [64, 84, 85], положительно влияют на микробиоту кожи больных, что способствует снижению риска вторичного инфицирования [79, 80, 86], а также улучшают качество жизни пациентов и их семей [59, 87].
Как видим, необходимость использования средств ухода за кожей у взрослых и детей с АтД не вызывает сомнений, однако пациентам зачастую непросто сделать конкретный выбор. В первую очередь это связано с тем, что до настоящего времени масштабные сравнительные исследования эффективности различных классов и типов топических увлажняющих и смягчающих средств в мире не проводились [58, 79]. Поэтому существующие согласительные документы и клинические рекомендации по лечению АтД предлагают осуществлять такой выбор пациенту совместно с лечащим врачом, индивидуально, в зависимости от формы и тяжести заболевания, его стадии (обострение или ремиссия), сезонных и климатических условий, специфического статуса больного и даже его финансовых возможностей [3, 55, 56, 65, 89]. Немаловажную роль в этом выборе играет форма выпуска средства ухода за кожей (табл. 2). При этом необходимо принимать во внимание, что жидкие формы (лосьоны и эмульсии) и гели рекомендуются для использования в острый период заболевания, при процессах, сопровождающихся мокнутием, а также в кожных складках и волосистых частях тела. Легкие кремы с высоким содержанием воды применяются преимущественно у детей раннего возраста, а также у пациентов с сухой кожей в области лица, особенно в летний период. Наконец, мази (особенно жирная мазь, не содержащая в своем составе воды) обладают наиболее выраженным окклюзионным эффектом, что обеспечивает их высокую эффективность у пациентов с более тяжелым течением заболевания, выраженным ксерозом, преимущественно в холодное время года, но делает неприемлемым их нанесение на участки мокнутия и кожные складки [55, 59, 65, 88]. 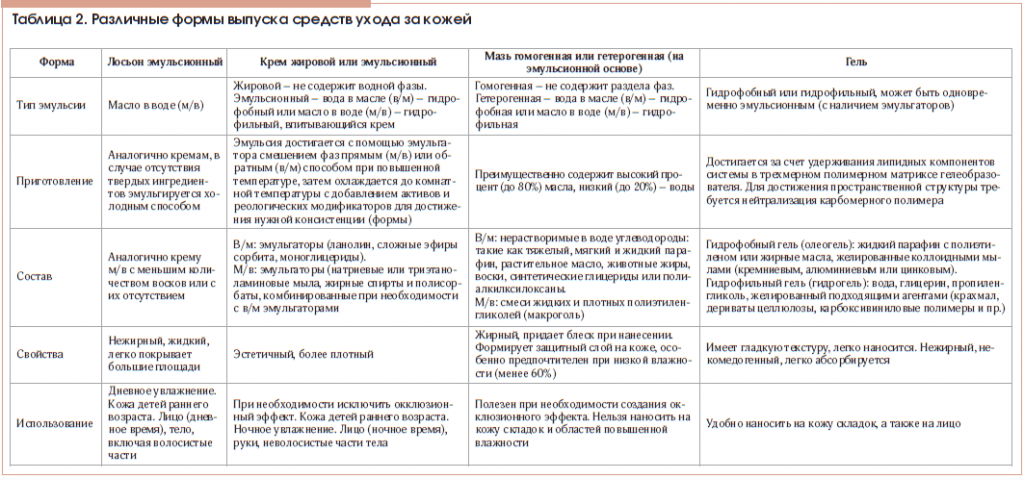
Важно помнить, что использование эмолентов, составляющее основу базовой терапии АтД, должно проводиться в соответствии с определенными правилами ухода за кожей, представленными на рисунке 2. Результаты многочисленных исследований показали, что клиническая эффективность такого базового ухода в значительной мере зависит от продолжительности применения топических средств, кратности их нанесения и количества используемого продукта [63, 67, 90, 91]. Кроме того, продемонстрировано значительное улучшение течения АтД и удовлетворенности пациентов результатами его лечения после проведения образовательных мероприятий, организованных с участием специально подготовленного персонала [92, 93]. Наконец, в некоторых исследованиях была подтверждена и экономическая эффективность рационального ухода за кожей [94, 95]. Следовательно, обучение больных и поддержание высокого уровня комплаентности пациента (или родителей больного ребенка) являются основой достижения контроля над таким хроническим заболеванием кожи, как АтД, и должны стать приоритетными направлениями в программах его лечения.
Перспективы использования специальных средств ухода за кожей с целью первичной профилактики АтД
В связи с углублением знаний о роли нарушения защитных функций кожи в патогенезе АтД и последующем развитии атопического марша место средств ухода за кожей, способных восстанавливать эпидермальный барьер, в стратегиях ведения пациентов с АтД было серьезно переоценено [96]. Стало очевидным, что длительное регулярное применение эмолентов больными в качестве базового ухода фактически является основной мерой вторичной профилактики заболевания, способствующей снижению частоты и тяжести обострений, риска развития инфекционных осложнений и, вероятно, возможности формирования аллергической сенсибилизации и реализации симптомов респираторной аллергии [97]. Более того, результаты недавних исследований создали серьезные предпосылки для появления новых подходов к решению проблемы первичной профилактики АтД, что еще до недавнего времени не представлялось реальным [98].
Идея новой концепции заключается в использовании специальных средств ухода за кожей младенцев с самого раннего возраста, до появления симптомов АтД, с целью повышения функциональных свойств эпидермального барьера. Начиная с 2010 г. было проведено несколько пилотных исследований, продемонстрировавших, что раннее начало применения эмолентов в виде кремов или масляных ванн у здоровых малышей приводит к значительному улучшению состояния их кожи, повышению ее увлажненности и с большой долей вероятности уменьшает частоту развития у них АтД [99–101]. Причем подобный исход был отмечен у детей как из группы риска по развитию аллергических заболеваний, так и без отягощенного семейного анамнеза. Такие обнадеживающие результаты, безусловно, послужили основанием для организации более серьезных проектов в данной области, и к настоящему времени уже опубликованы первые итоги двух подобных исследований.
Так, в международном рандомизированном контролируемом исследовании, проведенном в США и Великобритании, определялась кумулятивная частота АтД в 6 мес. у 124 детей из группы высокого риска по развитию аллергических заболеваний, часть которых получала уход за кожей с применением эмолентов с первого месяца жизни [102]. Было показано, что ежедневное использование специальных увлажняющих средств у детей раннего возраста снижает частоту развития АтД на 50% по сравнению с детьми, не получавшими специального ухода за кожей (ОР 0,50; 95% ДИ, 0,28–0,9; р=0,017).
Другое аналогичное исследование было проведено в Японии и также изучало эффективность ежедневного использования специальных средств ухода за кожей в виде эмульсии с точки зрения профилактики АтД [103]. 116 новорожденных из группы высокого риска по развитию аллергии наблюдались до 32 нед. Помимо общего клинического обследования у детей проводились изучение состояния эпидермального барьера (TEWL, влажность рогового слоя и pH кожи), а также исследование аллергической сенсибилизации. В результате наблюдения оказалось, что у детей, получавших эмоленты, риск развития АтД снижался на 32% по сравнению с контрольной группой (р=0,012). Кроме того, была показана более высокая частота реализации АтД и сенсибилизации к овомукоиду у детей с исходно повышенными показателями TEWL (p
Таким образом, имеющиеся на сегодняшний день данные дают серьезные основания полагать, что применение специальных средств ухода за кожей здоровых малышей с самого раннего возраста является эффективным и безопасным способом решения проблемы первичной профилактики АтД, что уже находит свое отражение и в рекомендациях профессиональных сообществ [105].
Заключение
Представленный обзор является попыткой осветить современное состояние проблемы АтД, роли дисфункции эпидермального барьера в его развитии и поддержании хронического воспаления в коже, а также определить место современных средств ухода за кожей в программах лечения и профилактики этого заболевания. В свете представленных доказательств значение увлажняющих и успокаивающих средств для пациентов с АтД в настоящее время не вызывает сомнений с учетом необходимости поддержания достаточной влажности кожного покрова и повышения эффективности защитных свойств кожи против инфекционных и неинфекционных антигенов. В то же время первые обнадеживающие результаты изучения эффективности применения эмолентов с целью первичной профилактики АтД, безусловно, требуют организации и проведения более масштабных исследований для подтверждения данной теории и внедрения более конкретных практических рекомендаций в реальную клиническую практику.
Литература
1. Prescott S.L. Early-life environmental determinants of allergic diseases and the wider pandemic of inflammatory noncommunicable diseases // J Allergy Clin Immunol. 2013. Vol. 131. P. 23–30.
2. Platts-Mills T. The allergy epidemics: 1870-2010 // J Allergy Clin Immunol. 2015. Vol. 136. P. 3–13.
3. Wollenberg A., Oranje A., Deleuran M. et al.; ETFAD/EADV Eczema task force 2015 position paper on diagnosis and treatment of atopic dermatitis in adult and pediatric patients // J Eur Acad Dermatol Venerol. 2016. Vol. 30(5). P. 729–747.
4. Аллергия у детей: от теории – к практике / под ред. Л.С. Намазовой-Барановой. М.: Союз педиатров России, 2010–2011. 668 с. [Allergija u detej: ot teorii – k praktike / pod red. L.S. Namazovoj-Baranovoj. M.: Sojuz pediatrov Rossii, 2010–2011. 668 s. (in Russian)].
5. Drucker A.M., Wang A.R., Li W.Q et al. The Burden of Atopic Dermatitis: Summary of a Report for the National Eczema Association // J Invest Dermatol. 2017. Vol. 137(1). P. 26–30.
6. Dharmage S.C., Lowe A.J., Matheson M.C. et al Atopic dermatitis and the atopic march revisited // Allergy. 2014. Vol. 69. P. 17–27.
7. Kezic S., Novak N., Jakasa I. et al. Skin barrier in atopic dermatitis // Front Biosci. 2014. Vol. 1(19). P. 542–556.
8. Nomura T., Kabashima K. Advances in atopic dermatitis in 2015 // J Allergy Clin Immunol. 2016. Vol. 138(6). P. 1548–1555.
9. Kubo A., Nagao K., Amagai M. Epidermal barrier dysfunction and cutaneous sensitization in atopic diseases // J Clin Invest. 2012. Vol. 122. P. 440–447.
10. Bouwstra J.A., Pilgrim K., Ponec M. Structure of the skin barrier, in Skin barrier, edited by PM Elias, KR Feingold. New York, Naylor and Francis. 2006. P. 65.
11. Zaniboni M.C., Samorano L.P., Orfali R.L., Aoki V. Skin barrier in atopic dermatitis: beyond filaggrin // An Bras Dermatol. 2016. Vol. 91(4). P. 472–478.
12. Ring J., Mohrenschlager M., Weidinger S. Molecular genetics of atopic eczema // Chem Immunol Allergy. 2012. Vol. 96. P. 24–29.
13. Lee S.H., Jeong S.K., Ahn S.K. An update of the defensive barrier function of skin // Yonsei Med J. 2006. Vol. 47. P. 293–306.
14. Kezic S., Kemperman P.M., Koster E.S. et al. Loss-of-function mutations in the filaggrin gene lead to reduced level of natural moisturizing factor in the stratum corneum // J Invest Dermatol. 2008. Vol. 128. P. 2117–2119.
15. Flohr C., Perkin M., Logan K. et al. Atopic dermatitis and disease severity are the main risk factors for food sensitization in exclusively breastfed infants // J Invest Dermatol. 2014. Vol. 134(2). P. 345–350.
16. Bin L., Leung D.Y.M. Genetic and epigenetic studies of atopic dermatitis // Allergy Asthma Clin Immunol. 2016. Vol. 12. P. 52–66.
17. Mauro T., Holleran W.M., Grayson S. et al. Barrier recovery is impaded at neutral pH, independent of ionic effects: implications for extracellular lipid processing // Arch Dermatol Res. 1998. Vol. 290. P. 215–222.
18. Jungersted J.M., Scheer H., Mempel F. et al. Stratum corneum lipids, skin barrier function and fillagrin mutations in patients with atopic eczema // Allergy. 2010. Vol. 65. P. 911–918.
19. Hachem J.P., Man M.Q., Crumrine D. et al. Sustained serine proteases activity by prolonged increase in pH leads to degradation lipid processing enzimes and profound alterations of barrier function and stratum corneum integrity // J Invest Dermatol. 2005. Vol. 125. P. 510–520.
20. Hatano Y., Man M.Q., Uchida Y. et al. Maintenance of an acidic stratum corneum prevents emergence of murine atopic dermatitis // J Invest Dermatol. 2009. Vol. 129. P. 1824–1835. Bäsler K., Bergmann S., Heisig M. et al. The role of tight junctions in skin barrier function and dermal absorption
21. // J Control Release. 2016. Vol. 242. P. 105–118.
22. De Benedetto A., Rafaels N.M., McGirt L.Y. et al. Tight junction defects in patients with atopic dermatitis // J Allergy Clin Immunol. 2011. Vol. 127. P. 773–786.
23. Hae-Jin L., Seung-Hun L. Epidermal permeability barrier defects and barrier repair therapy in atopicdermatitis // Allergy Asthma Immunology Res. 2014. Vol. 6(4). P. 276–287.
24. Sugavara T., Iwamoto N., Akashi M. et al. Tight junction dysfunction in the stratum granulosum leads to aberrant stratum corneum barrier function in claudin-1-deficient mice // J Dermatol Sci. 2013. Vol. 70. P. 12–18.
25. Kuo I.H., Carpenter-Mendini A., Yoshida T. et al. Activation of epidermal tall-like receptor 2 enhances tight junction function: implications for atopic dermatitis and skin barrier repair // J Invest Dermatol. 2013. Vol. 133. P. 988–998.
26. Ahmad-Nejad P., Mrabet-Dahbi S., Breuer K. et al. The toll like receptor 2 R753Q polymorphism defines a subgroup of patients with atopic dermatitis having severe phenotype // J Allergy Clin Immunol. 2004. Vol. 113(3). P. 565–567.
27. Lai Y., Gallo R.L. AMPed in immunity: how antimicrobial peptides have multiple roles in immune defense // Trends Immunol. 2009. Vol. 30. P. 131–141.
28. Ong P.Y., Ohtake T., Brandt C. et al. Endogenous antimicrobial peptides and skin infections in atopic dermatitis // N Engl J Med. 2002. Vol. 347. P. 1151–1160.
29. Aberg K.M., Man M.Q., Gallo R.L. et al. Co-regulation and interdependence of the mammalian epidermal permeability and antimicrobial barriers // J Invest Dermatol. 2008. Vol. 128. P. 917–925.
30. Neuber K., Steinrucke K., Ring J. Staphylococcal enterotoxin B affects in vitro IgE synthesis, interferon-gamma, interleukin-4 and interleukin-5 production in atopic eczema // Int Arch Allergy Immunol. 1995. Vol. 107. P. 179–182.
31. Valdman-Grinshpoun Y., Ben-Amitai D., Zvulunov A. Barrier-restoring therapies in atopic dermatitis: current approaches and future perspectives // Dermatol Res Pract. 2012. Vol. 92. P. 31–34.
32. Elias P.M. Lipid abnormalities and lipid-based repair strategies in atopic dermatitis // Biochim Biophys Acta. 2014. Vol. 1841. P. 323–330.
33. Zhao L.P., Di Z., Zhang L. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in Northeast China // J Eur Acad Dermatol Venerol. 2012. Vol. 26. P. 572–577.
34. Ramot Y., Mastrofrancesco A., Camera E. et al. The role of PPARγ-mediated signalling in skin biology and pathology: new targets and opportunities for clinical dermatology // Exp Dermatol. 2015. Vol. 24(4). P. 245–251.
35. Steinhoff M., Neisius U., Ikoma A. et al. Proteinase-activated receptor-2 mediates itch: a novel pathway for pruritus in human skin // J Neurosci. 2003. Vol. 23. P. 6176–6180.
36. Adachi Y., Hatano Y., Sakai T., Fujiwara S. Expressions of peroxisome proliferator-activated receptors (PPARs) are directly influenced by permeability barrier abrogation and inflammatory cytokines and depressed PRAPalpha modulates expressions of chemokines and epidermal differentiation-related molecules in keratinocytes // Exp Dermatol. 2013. Vol. 22. P. 606–608.
37. Briot A., Lacroix M., Robin A. et al. PAR-2 inactivation inhibits early production of TSLP, but not cutaneous inflammation, in Netherton syndrome adult mouse model // J Invest Dermatol. 2010. Vol. 130. P. 2736–2742.
38. Hatano Y., Elias P.M., Crumrine D. et al. Efficacy of combined peroxisome proliferator-activated receptors-alpha ligand and glucocorticoid therapy in a murine model of atopic dermatitis // Exp Dermatol. 2011. Vol. 131. P. 1845–1852.
39. Gupta M., Mahajan V.K., Mehta K.S. et al. Peroxisome proliferator-activated receptors (PPARs) and PPAR agonists: the ‘future’ in dermatology therapeutics? // Arch Dermatol Res. 2015. Vol. 307(9). P. 767–780.
40. Buddenkotte J., Steinhoff M. Pathophysiology and therapy of pruritus in allergic and atopic diseases // Allergy. 2010. Vol. 65(7). P. 805–821.
41. Yang D., Chen Q., Yang H. et al. High mobility group box-1 protein induces the migration and activation of human dendritic cells and acts as alarmin // J Leukoc Biol. 2007. Vol. 81. P. 59–66.
42. Nakae S., Morita H., Ohno T. et al. Role of interleukin-33 in innate-type immune cells in allergy // Allergol Int. 2013. Vol. 62. P. 13–20.
43. Dioszeghy V., Mondoulet L., Dhelft V. et al. Epicutaneous immunotherapy results in rapid allergen uptake by dendritic cells through intact skin and downregulates the allergen-specific response in sensitized mice // J Immunol. 2011. Vol. 186. P. 5629–5637.
44. Lack G., Fox D., Northstone K., Golding J. Factors associated with the development of peanut allergy in childhood // N Engl J Med. 2003. Vol. 248. P. 977-985.
45. Moingeon P., Mascarell L. Novel routes for allergen immunotherapy: safety, efficacy and mode of action // Immunotherapy. 2012. Vol. 4. P. 201–212.
46. Li W., Zhang Z., Saxon A., Zhang K. Prevention of oral food allergy sensitization via skin application of food allergen in a mouse model // Allergy. 2012. Vol. 67. P. 622–629.
47. Oyoshi M.K., Larson R.P., Ziegler S.F., Geha R.S. Mechanical injury polarizes skin dendritic cells to elicit a T(H)2 response by inducing cutaneous thymic stromal lymphopoietin expression // J Allergy Clin Immunol. 2010. Vol. 126. P. 976–984.
48. Mondoulet L., Dioszeghy V., Puteaux E. et al. Intact skin and not stripped skin is crucial for the safety and efficacy of peanut epicutaneous immunotherapy (EPIT)in mice // Clin Transl Allergy. 2012. Vol. 2(1). P. 22–33.
49. Wetzig H., Schulz R., Diez U. et al. Associations between duration of breastfeeding, sensitization to hen’s eggs and eczema infantum in one and two year old children at high risk of atopy // Int J Hyg Environ Health. 2000. Vol. 203. P. 17–21.
50. Lai C.C., Yan D.C., Yu J. et al. Latex allergy in hospital employees // J Formos Med Assoc. 1997. Vol. 96. P. 266–271.
51. Lack G. Epidemiologic risks for food allergy // J Allergy Clin Immunol. 2008. Vol. 121. P. 1331–1336.
52. Brown S.J., Asai Y., Cordell H.J. et al. Loss-of-function variants in the filaggrin gene are a significant risk factor for peanut allergy // J Allergy Clin Immunol. 2011. Vol. 127. P. 661–667.
53. Tsakok T., Marrs T., Mohsin M. et al. Does atopic dermatitis cause food allergy? A systematic review // J Allergy Clin Immunol. 2016. Vol. 137(4). P. 1071–1078.
54. Matsumoto K., Shimanouchi Y., Kawakubo K. et al. Infantile eczema at one month of age is associated with cord blood eosinophilia and subsequent development of atopic dermatitis and wheezing illness until two years of age // Int Asch Allergy Immunol. 2005. Vol. 137. P. 69–76.
55. Федеральные клинические рекомендации. Дерматовенерология, 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс, 2016. 768 с. [Federal’nye klinicheskie rekomendacii. Dermatovenerologija 2015: Bolezni kozhi. Infekcii, peredavaemye polovym putem. 5-e izd., pererab. i dop. M.: Delovoj jekspress, 2016. 768 s. (in Russian)].
56. Nowicki R., Trzeciak M., Wilkowska A. et al. Atopic dermatitis: current treatment guidelines // Postepy Dermatol Alergol. 2015. Vol. 32(4). P. 239–249.
57. Kezic S., Novak N., Jakasa I. et al. Skin barrier in atopic dermatitis // Front Biosci. 2014. Vol. 1(19). P. 542–556.
58. Giam Y.C., Hebert A.A., Dizon M.V. et al. A review on the role of moisturizers for atopic dermatitis // Asia Pac Allergy. 2016. Vol. 6(2). P. 120–128.
59. Lindh J.D., Bradley M. Clinical Effectiveness of Moisturizers in Atopic Dermatitis and Related Disorders: A Systematic Review // Am J Clin Dermatol. 2015. Vol. 16(5). P. 341–359.
60. Loden M., Maibach H. Dry skin and moisturizers: Chemistry and Function. 1st ed. New York: CRC Press; 1999. P. 472.
61. Sethi A., Kaur T., Malhotra S.K. Moisturizers: The Slippery Road // Indian J Dermatol. 2016. Vol. 61(3). P. 279–287.
62. Rawlings A.V., Canestrari D.A., Dobkowski B. Moisturizer technology versus clinical performance // Dermatol Ther. 2004. Vol. 17(1). P. 49–56.
63. Loden M. The clinical benefit of moisturizers // Journal of the European Academy of Dermatology and Venereology. 2005. Vol. 19. P. 672–688.
64. Hon K.L., Wang S.S., Lau Z. et al. Pseudoceramide for childhood eczema: does it work? // Hong Kong Med J. 2011. Vol. 17(2). P. 132–136.
65. Ring J. et al. Guidelines for treatment of atopic eczema (atopic dermatitis). Part I // Journal of the European Academy of Dermatology and Venerology. 2012. Vol. 26(8). P. 1045–1060.
66. Sathishkumar D., Moss C. Topical Therapy in Atopic Dermatitis in Children // Indian J Dermatol. 2016. Vol. 61(6). P. 656–661.
67. Breternitz M., Kowatzki D., Langenauer M. et al. Placebo-controlled, double-blind, randomized, prospective study of a glycerol-based emollient on eczematous skin in atopic dermatitis: biophysical and clinical evaluation // Skin Pharmacol Physiol. 2008. Vol. 21(1). P. 39–45.
68. Lynde C.W. Moisturizers: What they are and how they work // Skin Therapy Lett. 2001. Vol. 6(13). P. 3–5.
69. Varothai S., Nitayavardhana S., Kulthanan K. Moisturizers for patients with atopic dermatitis // Asian Pac J Allergy Immunol. 2013. Vol. 31. P. 91–98.
70. Hon K.L., Tsang Y.C., Pong N.H. et al. Patient acceptability, efficacy, and skin biophysiology of a cream and cleanser containing lipid complex with shea butter extract versus a ceramide product for eczema // Hong Kong Med J. 2015. Vol. 21(5). P. 417–425.
71. Tichota D.M., Silva A.C., Sousa Lobo J.M., Amaral M.H. Design, characterization, and clinical evaluation of argan oil nanostructured lipid carriers to improve skin hydration // Int J Nanomedicine. 2014. Vol. 11(9). P. 3855–3864.
72. Тлиш М.М., Глузмин Н.И., Карташевская М.И., Псавок Ф.А. Атопический дерматит у детей: перспективы применения инновационных средств в наружной терапии // Вестник дерматологии и венерологии. 2016. № 2. С. 96–102 [Tlish M.M., Gluzmin N.I., Kartashevskaja M.I., Psavok F.A. Atopicheskij dermatit u detej: perspektivy primenenija innovacionnyh sredstv v naruzhnoj terapii // Vestnik dermatologii i venerologii. 2016. № 2. S. 96–102 (in Russian)].
73. Narbutt J., Bednarski I.A., Lesiak A. The effect of an emollient with benfothiamine and Biolin prebiotic on the improvement of epidermal skin function // Postepy Dermatol Alergol. 2016. Vol. 33(3). P. 224–231.
74. Мигачева Н.Б., Жестков А.В., Лямин А.В. Влияние средств ухода за кожей на основе термальной воды на состав микрофлоры кожи детей раннего возраста // Международный научно-исследовательский журнал Research Journal of International Studies. Екатеринбург. 2016. № 9 (51). С. 62–64 [Migacheva N.B., Zhestkov A.V., Ljamin A.V. Vlijanie sredstv uhoda za kozhej na osnove termal’noj vody na sostav mikroflory kozhi detej rannego vozrasta // Mezhdunarodnyj nauchno-issledovatel’skij zhurnal Research Journal of International Studies. Ekaterinburg. 2016. № 9 (51). S. 62–64 (in Russian)].
75. Reynertson K.A., Garay M., Nebus J. et al. Anti-inflammatory activities of colloidal oatmeal (Avena sativa) contribute to the effectiveness of oats in treatment of itch associated with dry, irritated skin // J Drugs Dermatol. 2015. Vol. 14(1). P. 43–48.
76. Lio P.A. Efficacy of a Moisturizing Foam in Skin Barrier Regeneration and Itch Relief in Subjects Prone to Atopic Dermatitis // J Drugs Dermatol. 2016. Vol. 15(11). P. 77–80.
77. De Belilovsky C., Roo-Rodriguez E., Baudouin C. et al. Natural peroxisome proliferator-activated receptor-alpha agonist cream demonstrates similar therapeutic response to topical steroids in atopic dermatitis // J Dermatolog Treat. 2011. Vol. 22. P. 359–365.
78. Draelos Z.D. Therapeutic Moisturizers // Dermatol Clin. 2000. Vol. 18(4). P. 597–607.
79. Hon K.L., Leung A.K., Barankin B. Barrier repair therapy in atopic dermatitis: an overview // Am J Clin Dermatol. 2013. Vol. 14(5). P. 389–399.
80. Seite S., Flores G.E., Henley J.B. et al. Microbiome of affected and unaffected skin of patients with atopic dermatitis before and after emollient treatment // J Drugs Dermatol. 2014. Vol. 13(11). P. 1365–1372.
81. Bianchi P., Theunis J., Casas C. et al. Effects of a New Emollient-Based Treatment on Skin Microflora Balance and Barrier Function in Children with Mild Atopic Dermatitis // Pediatr Dermatol. 2016. Vol. 33(2). P. 165–171.
82. Akerstrom U., Reitamo S., Langeland T. et al. Comparison of Moisturizing Creams for the Prevention of Atopic Dermatitis Relapse: a Randomized Double-blind Controlled Multicentre Clinical Trial // Acta Derm Venereol. 2015. Vol. 95. P. 587–592.
83. Mason J.M., Carr J., Buckley C. et al. Improved emollient use reduces atopic eczema symptoms and is cost neutral in infants: before-and-after evaluation of a multifaceted educational support programme // BMC Dermatol. 2013. Vol. 16. P. 13–17.
84. Grimalt R., Mengeaud V., Cambazard F.; Study Investigators’ Group. The steroid-sparing effect of an emollient therapy in infants with atopic dermatitis: a randomized controlled study // Dermatology. 2007. Vol. 214. P. 61–67.
85. Szczepanowska J., Reich A., Szepietowski J. C. Emollients improve treatment results with topical corticosteroids in childhood atopic dermatitis: a randomized comparative study // Pediatr Allergy Immunol. 2008. Vol. 19. P. 614–618.
86. Lynde C.W., Andriessen A., Bertucci V. et al. The Skin Microbiome in Atopic Dermatitis and Its Relationship to Emollients // J Cutan Med Surg. 2016. Vol. 20(1). P. 21–28.
87. Moncrieff G., Cork M., Lawton S. et al. Use of emollients in dry-skin conditions: consensus statement // Clin Exp Dermatol. 2013. Vol. 38. P. 231–238.
88. Grey K., Maguiness S. Atopic Dermatitis: Update for Pediatricians // Pediatr Ann. 2016. Vol. 45(8). P. 280–286.
89. Saeki H., Nakahara T., Tanaka A. et al.; Committee for Clinical Practice Guidelines for the Management of Atopic Dermatitis of Japanese Dermatological Association. Clinical Practice Guidelines for the Management of Atopic Dermatitis 2016 // J Dermatol. 2016. Vol. 43(10). P. 1117–1145.
90. Chiang C., Eichenfield L.F. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis // Pediatr Dermatol. 2009. Vol. 26. P. 273–278.
91. Ivens U.I., Steinkjer B., Serup J. Ointment is evenly spread on a skin in contrast to creams and solutions // Br J Dermatol. 2001. Vol. 145. P. 264–267.
92. Cork M.J., Britton J., Butler L. et al. Comparison of parent knowledge, therapy utilization and severity of atopic eczema before and after explanation and demonstration of topical therapies by a specialist dermatology nurse // Br J Dermatol. 2003. Vol. 149. P. 582–589.
93. Santer M., Muller I., Yardley L. et al. Parents’ and carers’ views about emollients for childhood eczema: qualitative interview study // BMJ Open. 2016. Vol. 6(8). e011887.
94. Norrlid H., Hjalte F., Lundqvist A. et al. Cost-effectiveness of Maintenance Treatment with a Barrier-strengthening Moisturizing Cream in Patients with Atopic Dermatitis in Finland, Norway and Sweden // Acta Derm Venereol. 2016. Vol. 96(2). P. 173–176.
95. Mason J.M., Carr J., Buckley C. et al. Improved emollient use reduces atopic eczema symptoms and is cost neutral in infants: before-and-after evaluation of a multifaceted educational support programme // BMC Dermatol. 2013. Vol. 16. P. 13–17.
96. Lodén M. Treatments Improving Skin Barrier Function // Curr Probl Dermatol. 2016. Vol. 49. P. 112–122.
97. Friedlander S.F., Simpson E.L., Irvine A.D., Eichenfield L.F. The Changing Paradigm of Atopic Dermatitis Therapy // Semin Cutan Med Surg. 2016. Vol. 35(5). P. 97–99.
98. Van Bever H.P., Nagarajan S., Shek L.P., Lee B.W. OPINION: Primary prevention of allergy – Will it soon become a reality? // Ped Allergy Immunol. 2016. Vol. 27. P. 6–12.
99. Simpson E.L., Berry T.M., Brown P.A., Hanifin J.M. A Pilot Study of Emollient Therapy for the Primary Prevention of Atopic Dermatitis // J Am Acad Dermatol. 2010. Vol. 63(4). P. 587–593.
100. Rendell M.E., Baig-Lewis S.F., Berry T.M. et al. Do early skin care practices alter the risk of atopic dermatitis? A case-control study // Pediatr Dermatol. 2011. Vol. 28(5). P. 593–595.
101. Kvenshagen B.K., Carlsen K.H., Mowinckel P. et al. Can early skin care normalise dry skin and possibly prevent atopic eczema? A pilot study in young infants // Allergol Immunopathol (Madr). 2014. Vol. 42(6). P. 539–543.
102. Simpson E.L., Chalmers J.R., Hanifin J.M. et al. Emollient enhancement of the skin barrier from birth offers effective atopic dermatitis prevention // J Allergy Clin Immunol. 2014. Vol. 134(4). P. 818–823.
103. Horimukai K., Morita K., Narita M. et al. et al. Application of moisturizer to neonates prevents development of atopic dermatitis // J Allergy Clin Immunol. 2014. Vol. 134(4). P. 824–830.
104. Horimukai K., Morita K., Narita M. et al. et al. Transepidermal water loss measurement during infancy can predict the subsequent development of atopic dermatitis regardless of filaggrin mutations // Allergjlogy International. 2016. Vol. 65. P. 103–108.
105. Blume-Peytavi U., Lavender T., Jenerowicz D. et al. Recommendations from a European Roundtable Meeting on Best Practice Healthy Infant Skin Care // Pediatr Dermatol. 2016. Vol. 33(3). P. 311–321.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






