В статье проанализировано влияние экзометаболитов кишечной микробиоты на физиологические и патофизиологические процессы в макроорганизме, возникающие при острых кишечных инфекциях, оценено значение короткоцепочечных жирных кислот в формировании воспалительного ответа при кишечных инфекциях
Содержание статьи
Введение
Острые кишечные инфекции (ОКИ) занимают 2-е место по частоте после острых респираторных инфекций. Ежегодно в России официально регистрируется более 500 случаев ОКИ на 100 тыс. взрослого населения [1]. Однако реальная заболеваемость ОКИ в России, по мнению экспертов, в 3–5 раз превышает официально регистрируемую [2]. Это обусловлено значительной долей стертых и легких форм, лечение которых в основном осуществляют в домашних условиях. У большинства больных при ОКИ различной этиологии в разгаре болезни часто возрастают толщина слизистой оболочки толстой кишки и глубина ее кишечных желез, что связано с межжелезистым отеком собственной пластинки вследствие микроциркуляторных расстройств и множественных геморрагий [3]. Токсины шигелл и сальмонелл вызывают трофические изменения в тканях толстой кишки, которые нередко длительно сохраняются. Так, спустя 90–120 дней у 39,1% обследованных реконвалесцентов сальмонеллеза были зарегистрированы признаки остаточного воспаления, а у 13,1% — отмечались признаки затянувшейся репарации слизистой оболочки толстого кишечника в виде усиленной макрофагальной реакции и изменения линейных параметров слизистой оболочки кишки [4]. Решение вопросов диагностики, прогнозирования, а также ранней коррекции дисбиоза в начальном периоде выздоровления после перенесенных ОКИ позволит улучшить качество жизни пациентов, достичь ранней и длительной ремиссии. Продолжение исследований в указанном направлении поможет улучшить понимание патогенеза гастроэнтерологической патологии и ее профилактики.
Несмотря на широкую распространенность ОКИ, многие аспекты их патогенеза у взрослых изучены крайне недостаточно. В частности, лишь единичные исследования посвящены постинфекционному синдрому раздраженного толстого кишечника (ПИСРК) и метаболическому синдрому при нарушенном микробиоценозе. Между тем на развитие ПИСРК оказывает влияние не только микробиота кишечника, но и непосредственно продукты ее метаболизма, и в частности короткоцепочечные жирные кислоты (КЦЖК), необходимые для выполнения всех функций толстого кишечника и поддержания физиологических процессов в организме.
Физиологическая роль КЦЖК
КЦЖК являются одним из продуктов расщепления ферментами микробов белков, жиров и углеводов. Они вырабатываются преимущественно анаэробными микробами, и их можно и нужно рассматривать как биохимические маркеры изменений микроэкологии кишечника. Основными КЦЖК являются пропионовая, уксусная, изомасляная, масляная и изовалериановая [5]. Неразветвленные КЦЖК (уксусная, пропионовая и масляная) образуются в результате анаэробного брожения углеводов, а ферментация белков и продуктов их расщепления приводит к образованию уже разветвленных кислот — изовалериановой, изомасляной. Их определение позволяет проводить скрининговую оценку состояния и деятельности микрофлоры и назначать лечебную коррекцию с использованием пробиотиков и других биологических препаратов [6]. Синтез КЦЖК — один из главных факторов колонизационной устойчивости, обеспечивающий постоянство состава микрофлоры кишечника. Увеличение количества КЦЖК сопровождается понижением осмотического давления в просвете толстого кишечника в результате ферментации полисахаридов [7]. Образование конкретного типа КЦЖК зависит от того, ферментами каких бактерий будет осуществляться расщепление субстрата, и это дает возможность оценить функциональную активность определенных представителей кишечной микробиоты. Так, если рассматривать анаэробные бактерии видов Eubacterium rectale, Eubacterium ramulus, Eubacterium hallii, Roseburia cecicola, Roseburia faecis, Faecalibacterium prausnitzii и Coprococcus, а также фузобактерии и непатогенные виды клостридий, то им принадлежит основная роль в продукции бутирата. А бактерии родов Bifidobacterium, Lactobacillus являются основными в продукции ацетата [8].
КЦЖК — это главный источник ацетилкоэнзима А, а также дыхательного субстрата для колоноцитов слизистой кишечника. КЦЖК участвуют в пролиферации клеток слизистой, в секреции слизи и усилении кровотока в слизистой. Механизм, с помощью которого КЦЖК реализуют свое влияние на пролиферацию клеток, до настоящего времени еще не изучен. Возможно, таким механизмом является влияние их на кровоток в слизистой [9]. КЦЖК поддерживают слабокислую среду. Это позволяет бутиратпродуцирующим грамположительным бактериям конкурировать с грамотрицательными и тем самым сохранять равновесие в микробиоте кишечника. При нормальном уровне содержания КЦЖК замедляется развитие и увеличение количества патогенных энтеробактерий, а они преимущественно питаются белковыми компонентами. Это создает благоприятные условия для подавления процессов гниения и снижает образование аммиака, сульфидов, эндогенных канцерогенов, а также ароматических аминов. Снижение содержания КЦЖК способствует увеличению числа грамотрицательных микробов и, соответственно, содержания липополисахаридов [10]. Самая высокая концентрация в просвете толстой кишки приходится на ацетат (60%), в меньшей степени на пропионат (25%) и бутират (15%) [11]. Сейчас достаточно хорошо изучен противовоспалительный эффект масляной кислоты, осуществляемый преимущественно за счет уменьшения активности гистоновой ацетилазы и подавления активации связанного с ней ядерного фактора (NF-κB) клеток толстой кишки. Бутират ингибирует активность фактора NF-κB, который контролирует экспрессию генов иммунного ответа, отвечает за продукцию цитокинов. В результате происходит уменьшение выработки провоспалительных цитокинов, снижается пролиферация и активность Т-клеток [12]. Бутират продуцируют в основном представители грамположительной группы Firmicutes, например E. rectale, Roseburia spp. и F. prausnitzii [10, 13].
Исследования, проведенные H. Sokol et al., показали, что F. prausnitzii имеют способность ингибировать воспаление в сигнальных системах, а продуцируемый ими бутират блокирует активацию транскрипционного фактора NF-κB [14]. В некоторых исследованиях доказано достоверное снижение уровня провоспалительных цитокинов при повышении потребления пищевых волокон или препаратов, содержащих КЦЖК [14, 15]. Пропионат и бутират активируют кишечный глюконеогенез через нервную цепь «кишечник — мозг» и способствуют метаболическому контролю веса тела и содержания глюкозы [16].
Основная часть (95%) КЦЖК, выделяемых в толстой кишке, подвергается обратному всасыванию. Всасывание КЦЖК осуществляется при помощи активных транспортных систем клеток кишечника [17]. Помимо этого, КЦЖК способствуют всасыванию кальция и магния. На сегодняшний день доказано, что именно масляной кислоте принадлежит основная роль в энергообеспечении колоноцитов, необходимом для улучшения метаболизма, нормального развития клетки и выполнения защитной роли в предотвращении заболеваний толстого кишечника. Показано, что КЦЖК являются также регуляторами апоптоза и обладают антиканцерогенным эффектом. Поступившие в колоноцит уксусная и пропионовая кислоты на уровне толстой кишки участвуют в регуляции ее кровотока, улучшая кровоснабжение в слизистой оболочке, и тем самым проявляют антиишемический эффект. Печень задерживает около половины КЦЖК, поступивших через колоноцит, а еще одну четверть элиминируют периферические ткани. В периферических тканях большая часть ацетата и пропионата используется для синтеза глюкозы и лишь небольшая часть (не более 10%) идет на энергообеспечение [17].
Недавно опубликованные данные M.C. Kim et al. (2017) подтверждают значительную роль метаболитов симбионтной микрофлоры, в т. ч. КЦЖК, в формировании гуморального ответа; они оказывают прямое и косвенное иммуномодулирующее действие на В-лимфоциты не только на местном, но и на системном уровне и, следовательно, усиливают антителообразование [18]. Оказалось, что КЦЖК через воздействие на коэнзим А также могут повышать активность Т-клеток [19]. Как известно, аполипопротеин-I (ApoA-I) является основным белковым компонентом липопротеидов высокой плотности и удаляет избыток холестерола в кровеносных сосудах. J.Z. Tayyeb et al. (2018) установили, что ApoA-I значительно снижается при терапии амоксициллином в связи с развитием кишечного дисбиоза и, соответственно, изменением состава и структуры КЦЖК [20]. Тогда же H. Yu et al. (2018) пришли к выводу, что нарушения количественного и качественного состава КЦЖК в кишечнике могут способствовать накоплению липидов, модулируют экспрессию ферментов метаболизма [21].
Взаимосвязь нарушений микробиоценоза и патологии ЖКТ
Результаты многочисленных зарубежных исследований, проведенных с 1994 по 2003 г., свидетельствуют о наличии связи ПИСРК с перенесенным гастроэнтеритом [22]. У пациентов, перенесших острый гастроэнтерит, наблюдавшихся в периоды от 3 мес. до 6 лет, ПИСРК развивался в 7–31% случаев [23]. По данным И.Н. Ручкиной и А.И. Парфенова (2006), маркеры ОКИ обнаруживаются у 71,1% взрослых с ПИСРК. Доказано, что ОКИ являются существенным фактором развития ПИСРК, поскольку у многих детей (5–20%) после перенесенных ОКИ наблюдается клиническая картина функционального расстройства кишечника.
У больных с ПИСРК определяются дисбиотические нарушения, что способствует формированию воспалительного процесса с изменением нескольких функций толстой кишки: пищеварительной, моторной и всасывательной. А моторные нарушения кишечника способствуют прогрессированию изменений качественного и количественного состава микрофлоры кишечника, что приводит к метаболическим нарушениям [24].
Исследователи продолжают поиск новых методов диагностики для более полной оценки состава кишечной микрофлоры на фоне инфекционной и соматической патологии ЖКТ. Так, одним из перспективных направлений является изучение микроэкологии кишечника методом газожидкостной хроматографии, основанным на определении метаболической активности микрофлоры по составу КЦЖК и определении анаэробного индекса. Определение спектра КЦЖК в копрофильтрах у детей с кишечными инфекциями позволяет выявить нарушения количественного и качественного состава нормальной микрофлоры кишечника.
Уровень КЦЖК зависит от этиологической природы ОКИ (вирусная, бактериальная), а также от уровня поражения ЖКТ [25]. Изучение КЦЖК проводилось в работе В.Ф. Баликина и соавт. (2009) при различной степени тяжести заболевания, при различной этиологии ОКИ, а также в период выздоровления. Полученные результаты показали повышение концентрации уровня КЦЖК у пациентов в сравнении со здоровыми лицами, что отражает гиперколонизацию кишечника анаэробами, включая и условно-патогенную флору. Достоверное увеличение концентрации КЦЖК у пациентов с умеренно выраженной интоксикацией в сравнении с уровнем концентрации КЦЖК у пациентов с легкой степенью интоксикации отражает токсическое действие КЦЖК на системном уровне [26]. Сравнение уровня содержания КЦЖК у пациентов с ОКИ и симптомами обезвоживания выявило достоверное увеличение пропионовой, уксусной и масляной кислот, а у больных без признаков обезвоживания — увеличение только пропионовой и уксусной кислот в сравнении с их концентрацией у доноров [26], что позволяет в будущем учесть эти изменения при назначении патогенетической терапии.
Дисбаланс качественного состава микрофлоры усугубляется также и в результате дисфункции эпителия, повреждения муцинового слоя, повышения моторики и необоснованной терапии антибиотиками. Оптимальная пробиотическая терапия изменений микробиоценоза необходима при всех кишечных инфекциях независимо от этиологии [27].
Накопленные научные данные о влиянии экзометаболитов кишечной микрофлоры на здоровье человека позволили разработать критерии выбора оптимальной пробиотической терапии кишечных инфекций в острой стадии и в период реконвалесценции, способствующей снижению активности патогенных микроорганизмов и их токсинов и более эффективному исходу заболевания у данной группы больных. Благодаря достижениям современной науки пробиотики заняли свое место в лечении ПИСРК в комбинации со средствами, оказывающими благотворное влияние на тонус кишечной трубки. КЦЖК, являющиеся экзометаболитами микроорганизмов, входящих в состав пробиотиков, служат источником питания и энергии кишечного эпителия и усиливают моторную функцию кишечника, сокращение гладкой мускулатуры, препятствуют прикреплению чужеродных бактерий, конкурируют за пищевые ресурсы, участвуют в контроле ферментообразования, влияют на кальциевые каналы в толстой кишке. Таким образом, все перечисленные свойства пробиотиков могут быть чрезвычайно полезными для профилактики постинфекционного расстройства кишечника [28]. На современном этапе развития биотической терапии предполагается все более широкое применение нового класса биотических препаратов — метабиотиков, важнейшей составляющей которых являются клеточные компоненты, метаболиты, сигнальные молекулы пробиотических культур, способные оказывать известный заданный эффект на организм человека и оптимизировать для организма-хозяина специфичные физиологические функции, обусловленные деятельностью его индигенной микрофлоры [29].
Влияние симбионтной микрофлоры на моторную активность кишечника можно объяснить несколькими механизмами:
КЦЖК, являясь субстратом для микрофлоры кишечника, увеличивают ее биомассу; участвуют в микробном метаболизме желчных кислот, поступающих в просвет толстой кишки, вызывают стимуляцию кишечного транзита;
КЦЖК снижают рН и повышают осмотическое давление в просвете кишечника, выделение газа, усиливают транзит;
увеличение содержания некоторых КЦЖК может стимулировать мышечную стенку, активизируя образование холецистокинина;
КЦЖК снижают порог ответа гладкой мускулатуры слепой кишки на химическую стимуляцию [30].
Функции КЦЖК
Таким образом, можно выделить следующие основные функции КЦЖК [31]: активация фагоцитоза, образование нейромедиаторов, антибактериальный и антидиарейный эффект, регулирование моторной активности кишечника, модуляция местного иммунитета, поставка субстратов липогенеза, регуляция пролиферации и дифференцировки эпителия, нейтрализация пищевых канцерогенов, энергообеспечение эпителия и поддержание ионного обмена.
Описанные звенья патогенетического влияния КЦЖК на функциональную активность ЖКТ, центральную нервную систему, бронхолегочную систему, иммунную систему представлены на рисунке 1.
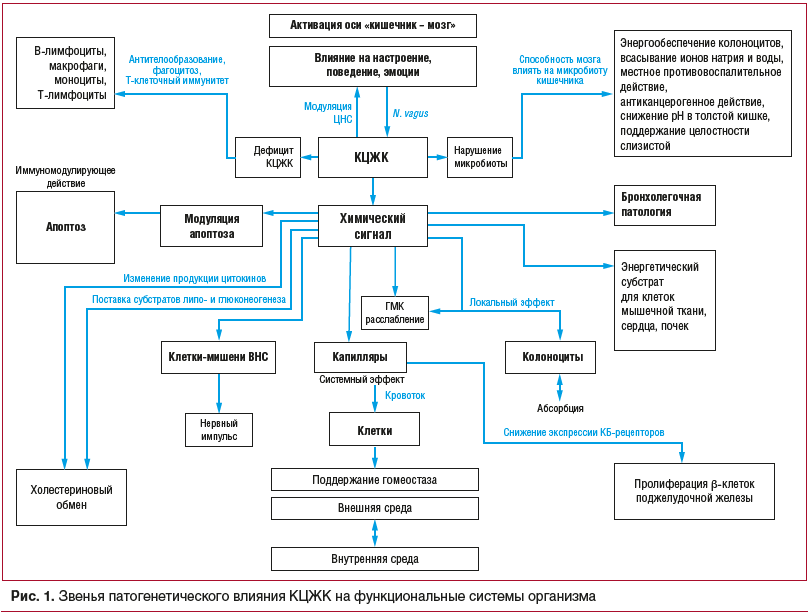
Дисбиоз кишечника после перенесенных кишечных инфекций, а также индукция его антибиотикотерапией являются причиной формирования и обострений ПИСРК, в основе которых лежит двигательная дисфункция. Моторную дисфункцию при данных формах патологии связывают с дефицитом КЦЖК, которые являются продуктом метаболизма молочнокислых бактерий в кишечнике [32].
В результате образуется замкнутый круг: нарушение физиологического состава микрофлоры кишечника, эндотоксинемия — усиление деконъюгации связанных желчных кислот — уменьшение синтеза этих кислот в гепатоцитах — нарушение холестеринового метаболизма — нарушение структуры печени (жировая дистрофия, фиброз) — снижение синтеза желчных кислот и поступления их в кишечник — усиление имеющихся изменений индигенной микрофлоры — нарушение моторики [33]. Такая взаимосвязь перечисленных заболеваний с нарушениями микробиоценоза свидетельствует об общности механизмов патогенеза их возникновения. Карнейро де Мура в 2001 г. выдвинул теорию о нарушении микробного пейзажа в толстом кишечнике как одном из ключевых моментов, необходимых для возникновения нарушений в метаболизме липидов [34]. Доказано, что КЦЖК принимают участие в обмене липидов.
Экзометаболиты бифидо- и лактобактерий, в первую очередь КЦЖК, лактат, водород и др., подавляют размножение многих бактерий. Они могут подавлять рост дизентерийных шигелл, сальмонелл, многих грибов. Вследствие перенесенной кишечной инфекции изменяется количественный и качественный состав данных экзометаболитов микрофлоры толстого кишечника, о чем можно судить по их концентрации в кале [35, 36]. Несмотря на различное соотношение КЦЖК при измерении их в кале, их пропорция всегда стабильна: пропионат:ацетат:бутират 20:60:20 [37]. Следовательно, одна из важных функций микрофлоры кишечника состоит в синтезе необходимого количества указанных органических соединений.
Анализ абсолютных и относительных показателей содержания жирных кислот в кале в совокупности с копрологическим анализом (физические параметры, степень гидролиза поступающих в толстую кишку нутриентов, желчеотделение, всасывательная способность слизистых, скорость транзита и др.) дают обширную информацию о состоянии пищеварительной системы и ее нарушениях [38]. Между тем значение анаэробных микробов и их метаболитов в патологическом процессе, в оценке тяжести и длительности течения острых кишечных инфекций остается недостаточно изученным.
В настоящее время проведены научные исследования, в которых показано, что многие сигнальные функции, биохимические и поведенческие реакции в организме человека прямо или косвенно связаны с активностью представителей микробиоты и их метаболитов. Последние исследования взаимных влияний кишечника, кишечной микробиоты и мозга привели к появлению понятия «кишечно-мозговая ось». Одним из механизмов влияния микробиоты на ось «кишечник — мозг» являются именно низкомолекулярные метаболиты кишечных бактерий. Это те самые КЦЖК, способные стимулировать симпатическую нервную систему и высвобождение серотонина в слизистых оболочках, оказывать влияние на память и процессы обучения [39].
Заключение
Таким образом, убедительно показано, что КЦЖК оказывают широкое мультифакторное влияние на многие физиологические и патофизиологические процессы в организме. Нормальный метаболизм КЦЖК можно рассматривать как одно из главных условий сохранения гомеостаза макроорганизма в целом. КЦЖК могут играть значительную роль в развитии ПИСРК, дисбиоза кишечника, метаболического синдрома, хронических патологий ЖКК, а также оказывать влияние на нервную систему. Еще много патогенетических аспектов предстоит изучить для подтверждения взаимосвязей между ОКИ, ПИСРК, дисбиозом кишечника, метаболическим синдромом, но нет сомнения в том, что необходим персонифицированный подход к терапии пациента, страдающего той или иной патологией. Многие заболевания имеют общие механизмы развития, и их лечение должно быть направлено не просто на купирование симптомов, но и на устранение триггерных факторов, блокирование основных звеньев патогенеза. Так, терапия, направленная на поддержание микробиоты человека в острый период, а также на восстановление кишечной эндоэкологии в период реконвалесценции, будет способствовать снижению риска развития ПИСРК (что клинически проявляется уменьшением болевого синдрома, нарушений моторики кишечника, нарушений стула, проявлений кишечной диспепсии), а также уменьшению проявлений метаболического синдрома. Все эти эффекты неразрывно связаны с количеством и разнообразием КЦЖК в организме.
.
Информация с rmj.ru






