Введение
Цитокины — биологически активные вещества, секретируемые преимущественно лимфоцитами, макрофагами, гранулоцитами, дендритными и другими (эндотелий, фибробластоподобные синовиоциты и пр.) клетками организма человека и представляющие собой небольшие (молекулярная масса не более 30 кДа) белковые молекулы [1]. Они принимают непосредственное участие в регуляции иммунного ответа организма на различные патогены, запуске, реализации и поддержании воспаления при многих иммуновоспалительных (аутоиммунных) заболеваниях [2–4].
Ревматоидный артрит (РА) — хроническое заболевание неизвестной этиологии, проявляющееся хроническим эрозивным артритом, системным поражением внутренних органов, широким спектром коморбидных заболеваний, ранней инвалидизацией и сокращением продолжительности жизни пациентов [5]. Чрезмерная активация иммунной системы в ответ на патогенные или физиологические стимулы, которая рассматривается в качестве ключевого звена патогенеза РА, на различных стадиях заболевания приводит к усилению синтеза провоспалительных цитокинов (интерлейкина (ИЛ) 1β, ИЛ-6, ИЛ-17, фактора некроза опухоли α (ФНО-α), интерферона γ (ИФН-γ) и др.) [4, 6–8]. При этом клинические проявления РА могут иметь в своей основе различные патогенетические механизмы и рассматриваться как гетерогенные эндотипы заболевания [4, 8–10]. На основании выявления IgM ревматоидного фактора (IgM РФ) и антител к циклическому цитруллинированному пептиду (АЦЦП) в сыворотке крови общепринято подразделять РА на 2 субтипа — серопозитивный и серонегативный [11], которые различаются по продукции цитокинов как на ранней, так и на развернутой стадии заболевания [9, 12]. Выделение клинико-иммунологических субтипов заболевания имеет важное значение для совершенствования персонифицированной терапии РА [13].
В последние годы в ревматологии в качестве лабораторных биомаркеров, наряду с рутинными клинико-лабораторными показателями, все шире используют данные мультиплексного анализа, основанного на протеомных, транскриптомных и генетических технологиях с использованием микрочипов (ДНК и белковых) [1, 14]. При этом в Российской Федерации и за рубежом представлены лишь отдельные работы, в которых технология мультиплексного анализа применялась для одновременного определения широкого спектра провоспалительных цитокинов у больных РА [15, 16].
Цель исследования: определить концентрацию основных провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИЛ-17A, ИЛ-17F, ИЛ-23, ИЛ-31, ИЛ-33, ФНО-α и ИФН-γ) у больных РА, оценить их связь с клинико-лабораторными показателями активности воспаления и субтипами заболевания.
Содержание статьи
Материал и методы
В исследование включено 154 пациента (73,4% женщин, средний возраст 56,0 [50,0; 64,0] года) с РА, диагностированным согласно критериям ACR/EULAR (American College of Rheumatology/European League Against Rheumatism, 2010 г.) [17], в развернутой стадии заболевания. Протокол и дизайн исследования одобрены локальным этическим комитетом ФГБОУ ВО ЯГМУ Минздрава России (протокол № 1 от 29.01.2015, протокол № 44 от 13.04.2021). Все пациенты перед началом исследования подписали информированное согласие на обследование и лечение.
Средняя продолжительность заболевания у обследованных пациентов составила 9,4 [3,0; 13,0] года, преобладали II (34,4%) и III (37,0%) рентгенологические стадии заболевания. Активность РА у всех пациентов оценивали как умеренную или высокую, индекс DAS28-СОЭ составил 5,40 [4,65; 6,00]. Среди обследованных у 129 (83,8%) было повышено содержание IgM РФ, у 106 (68,8%) — АЦЦП, а у 91 (59,1%) — одновременно IgM РФ и АЦЦП. У 38 (24,7%) пациентов был повышен уровень только IgM РФ и у 15 (9,7%) — только АЦЦП. Серонегативными по IgM РФ и АЦЦП оказались 10 (6,5%) пациентов.
Для лечения РА 144 (93,5%) пациента применяли базисные противовоспалительные препараты (метотрексат, лефлуномид, сульфасалазин), а также нестероидные противовоспалительные препараты и глюкокортикоиды (ГК) до 10 мг/сут в пересчете на преднизолон.
Проведено клиническое и лабораторное обследование, которое включало в том числе подсчет числа болезненных суставов, числа припухших суставов, общую оценку состояния здоровья больным и врачом по визуальной аналоговой шкале, определение скорости оседания эритроцитов (СОЭ), подсчет индексов Disease Activity Score-28-СОЭ (DAS28-СОЭ), Simple Disease Activity Index (SDAI), Clinical Disease Activity Index (СDAI), Health Assessment Questionnaire-Disability Index (HAQ).
Концентрацию С-реактивного белка (СРБ) в сыворотке крови определяли иммунонефелометрическим методом на анализаторе BN ProSpec (Siemens, Германия), IgM РФ — иммунотурбидиметрическим методом на анализаторе Sapphire 400 (TOKYO BOEKI MEDISYS Inc., Япония), АЦЦП — методом иммуноферментного анализа с помощью коммерческих наборов («ОМНИКС», Россия). Уровень девяти ключевых провоспалительных цитокинов: ИЛ-1β, ИЛ-6, ИЛ-17A, ИЛ-17F, ИЛ-23, ИЛ-31, ИЛ-33, ФНО-α и ИФН-γ в сыворотке крови исследовали с помощью мультиплексной технологии хMАР на анализаторе Bio-Plex® 200 System (BIO-RAD, США).
Основные клинические параметры обследованных пациентов представлены в таблице 1.
В качестве контроля определяли содержание цитокинов в сыворотке крови здоровых доноров. Верхняя граница нормы (M+3σ) при исследовании образцов сыворотки 20 практически здоровых доноров составила: для ИЛ-1β — 2,18 пг/мл, ИЛ-6 — 6,87 пг/мл, ИЛ-17A — 1,78 пг/мл, ИЛ-17F — 9,5 пг/мл, ИЛ-23 — 91,55 пг/мл, ИЛ-31 — 15,08 пг/мл, ИЛ-33 — 3,40 пг/мл, ФНО-α — 20,88 пг/мл и ИФН-γ — 5,33 пг/мл.
Статистическая обработка результатов с использованием пакета программ Stаtistica 10.0 (StatSoft, США) включала общепринятые методы параметрического и непараметрического анализа. Для параметров, распределение которых отличалось от нормального, при сравнении двух групп использовали критерий Манна — Уитни, а при сравнении трех и более групп — критерий Краскела — Уоллиса (для независимых групп). Результаты представлены в виде медианы (Ме) и 1-го и 3-го квартиля [Q1; Q3]. Корреляционный анализ проводили по методу Спирмена. Для сравнения частот качественных признаков в несвязанных группах применяли точный критерий Фишера, критерий χ2. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Уровень ИЛ-6, ИЛ-23, ИЛ-31, ИЛ-33 и ИФН-γ у больных РА был статистически значимо выше, чем у здоровых доноров (табл. 2). Напротив, концентрация ФНО-α была выше в группе здоровых доноров (р<0,05). Не отмечено статистически значимых различий уровня ИЛ-1β, ИЛ-17A, ИЛ-17F в сравниваемых группах (p>0,05).
![Таблица 2. Концентрация цитокинов в сыворотке крови больных РА и здоровых доноров, пг/мл, Me [Q1; Q3] Таблица 2. Концентрация цитокинов в сыворотке крови больных РА и здоровых доноров, пг/мл, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/01/1737579834_350_Provospalitelnye-tsitokiny-pri-revmatoidnom-artrite-svyaz-s-aktivnostyu-i-subtipami.png)
Наиболее часто у больных РА была повышена концентрация ИЛ-33 (у 134 (87,0%) пациентов), ИЛ-6 (у 79 (51,6%)), ИЛ-31 (у 74 (48,1%)), ИЛ-17F (у 71 (46,1%)) и ИЛ-23 (у 66 (42,9%)). Несколько реже наблюдалась гиперпродукция ИФН-γ (у 60 (39,0%)), ИЛ-17А (у 46 (29,9%)), ИЛ-1β (у 41 (26,7%)) и ФНО-α (у 36 (23,5%)).
Значения СОЭ коррелировали с уровнем ФНО-α (r=0,20, p<0,05) и ИФН-γ, (r=0,17, p<0,05), а концентрация СРБ — с содержанием ИЛ-31 (r=0,49, p<0,05) и ИЛ-33 (r=0,40, p<0,05). Индексы DAS28-СОЭ, CDAI и SDAI коррелировали с уровнем ИЛ-6 (r=0,17, r=0,19 и r=0,20 соответственно, p<0,05), а SDAI — с концентрацией ИЛ-17А, ИЛ-33 (r=0,17 и r=0,36 соответственно, p<0,05).
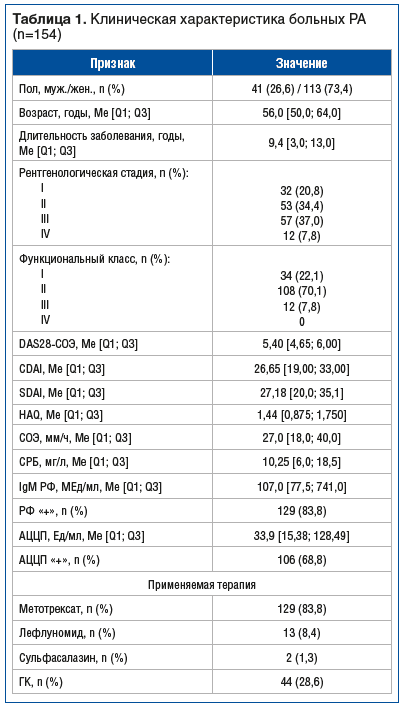
У больных, позитивных по IgM РФ, концентрация ИЛ-31, ИЛ-33, ФНО-α и ИФН-γ была выше, чем в группе пациентов, у которых IgM РФ обнаружен не был, однако эти различия не были статистически значимы (табл. 3). У пациентов, серонегативных по IgM РФ, отмечена тенденция к повышению содержания ИЛ-17А, ИЛ-17F и ИЛ-23 (p>0,05). Содержание ИЛ-1β и ИЛ-6 не различалось между сравниваемыми группами. У АЦЦП-положительных пациентов концентрация ИЛ-17F, ИЛ-23, ИЛ-31 и ИФН-γ была выше, чем у АЦЦП-негативных (р>0,05). Концентрация других цитокинов практически не различалась между этими группами.
![Таблица 3. Концентрация цитокинов в сыворотке крови больных РА в зависимости от наличия или отсутствия IgM РФ и АЦЦП, пг/мл, Me [Q1; Q3] Таблица 3. Концентрация цитокинов в сыворотке крови больных РА в зависимости от наличия или отсутствия IgM РФ и АЦЦП, пг/мл, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/01/1737579834_967_Provospalitelnye-tsitokiny-pri-revmatoidnom-artrite-svyaz-s-aktivnostyu-i-subtipami.png)
Содержание IgM РФ коррелировало с концентрацией ИЛ-17А (r=0,19, p<0,05), ИЛ-31 (r=0,17, p<0,05) и ИФН-γ (r=0,19, p<0,05), а АЦЦП — с уровнем ИЛ-17А (r=0,19, p<0,05).
У пациентов, серопозитивных по IgM РФ, в отличие от серонегативных, достоверно чаще встречалось повышенное содержание ФНО-α (p=0,001) (рис. 1). Кроме того, у пациентов, серопозитивных по IgM РФ, отмечена тенденция к повышению содержания ИЛ-31 (p=0,06), ИЛ-1β (p>0,05) и ИЛ-23 (p>0,05). У пациентов, серонегативных по IgM РФ, незначительно чаще встречались высокие значения ИЛ-17F (p>0,05).
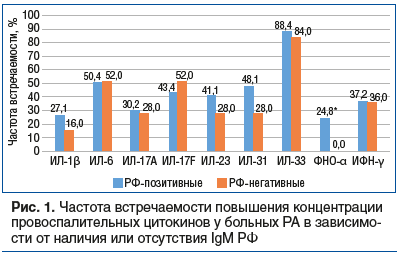
У АЦЦП-позитивных пациентов незначительно преобладали высокие значения ИЛ-17F, ИЛ-23 и ИФН-γ (p>0,05) (рис. 2). Частота повышения уровня других цитокинов была практически одинаковой в сравниваемых группах.
Не выявлено взаимосвязи между наличием у пациентов IgM РФ и/или АЦЦП и высоким уровнем цитокинов. Не обнаружено также различий как в концентрации, так и в частоте повышения уровня провоспалительных цитокинов между группами пациентов, серопозитивных по двум аутоантителам (РФ и АЦЦП) и изолированно негативных по одному из них.
Обсуждение
Полагают, что на разных стадиях течения РА от дисбаланса между отдельными группами цитокинов зависит выраженность воспаления и динамика клинических проявлений болезни [8]. У пациентов с РА, по сравнению со здоровыми донорами, наиболее часто отмечается повышение содержания ИЛ-1β, ИЛ-6, ИЛ-17, ФНО-α и ИФН-γ, уровень которых, как правило, коррелирует с активностью воспаления, тяжестью заболевания и в определенной мере отражает прогноз и эффективность лечения [18–22]. Однако большинство цитокинов на разных этапах развития воспаления могут оказывать как стимулирующее, так и тормозящее влияние на продукцию других цитокинов, формируя сложную сеть взаимодействий друг с другом, способствуя развитию системного воспаления и формированию патогенного воспалительного микроокружения в синовиальной оболочке [4, 8, 10, 18].
В связи с этим считается, что наибольшую информацию дает одномоментное исследование спектра цитокинов с использованием мультиплексных технологий [1, 14, 21, 23–25].
В проведенном нами исследовании девяти провоспалительных цитокинов методом мультиплексного анализа сыворотки больных РА, в сравнении с сывороткой здоровых доноров, отмечено достоверно более высокое содержание ИЛ-6, ИЛ-23, ИЛ-31, ИЛ-33 и ИФН-γ в сыворотке пациентов с РА. Наиболее часто встречалась гиперпродукция ИЛ-33, ИЛ-6, ИЛ-31, ИЛ-17F, ИЛ-23 и реже — ИФН-γ, ИЛ-17А, ИЛ-1β и ФНО-α.
Обнаружена взаимосвязь только отдельных цитокинов с клинико-лабораторными показателями активности РА. Так, индексы DAS28-СОЭ, CDAI и SDAI достоверно коррелировали с концентрацией ИЛ-6. Кроме того, индекс SDAI был значимо связан с уровнем ИЛ-17А и ИЛ-33. Показатели СОЭ коррелировали с содержанием ФНО-α и ИФН-γ, а концентрация СРБ — с содержанием ИЛ-31 и ИЛ-33.
По данным отечественных исследователей [16], у больных РА в развернутой стадии заболевания было показано увеличение в сыворотке крови концентрации ИЛ-1β, ИЛ-6 и ФНО-α. Отмечена корреляция концентрации СРБ с концентрацией ИЛ-1β, ИЛ-6 и ФНО-α, а DAS28 был взаимосвязан с уровнем ИЛ-1β и ИЛ-6 [20].
В другой работе [25] уровень ФНО-α и ИЛ-6 в плазме крови был значительно выше у пациентов с РА по сравнению с больными остеоартритом и группой контроля.
Ранее А.А. Новиков и соавт. [26] провели исследование 36 биомаркеров, в том числе с применением технологии xMAP, для определения 27 цитокинов у 102 больных с ранним РА длительностью 4,0 [2,5; 6,0] мес. умеренной и высокой активности (DAS28-СОЭ 5,4 [4,1; 5,9]), у 616 пациентов с системной красной волчанкой, синдромом Шегрена, анкилозирующим спондилоартритом, остеоартритом, OVERLAP-синдромом, подагрическим, псориатическим и недифференцированным артритами (группа сравнения) и у 297 здоровых доноров. Среди всех биомаркеров авторы выделили 6 наиболее значимых факторов прогнозирования наличия раннего РА: содержание ИЛ-6, СРБ, гранулоцитарно-макрофагального колониестимулирующего фактора, ИФН-γ, ИФН-γ-индуцибельного белка и АЦЦП. Эти биомаркеры стали основой для создания кандидатного лабораторного многопараметрического диагностического индекса раннего РА (МИРРА) [26].
Известно, что РФ и АЦЦП — специфические биомаркеры РА, но вместе с тем они вовлечены в патогенез заболевания, играют важную роль в ускоренном формировании эрозивного процесса в костной ткани, выраженности системных воспалительных реакций и развитии сердечно-сосудистой патологии [8, 10, 27, 28]. В рекомендациях EULAR по ведению больных РА наличие РФ или АЦЦП в сыворотке крови, наряду с эрозиями суставов и высокой воспалительной активностью болезни, трактуется как важный фактор риска неблагоприятного прогноза лечения [29].
По мнению X.M.E. Matthijssen et al. [30], основанному на результатах продольного когортного наблюдения в течение 25 лет за 1285 пациентами с РА в Нидерландах, аутоантителоположительный (РФ+ и/или АЦЦП+) и аутоантителоотрицательный (РФ- и АЦЦП-) РА являются разными подтипами заболевания, каждый со своим патогенезом. Эти различия касаются эффективности (смертность и функциональная инвалидность) длительного лечения заболевания. При этом наилучший эффект от лечения был достигнут при серопозитивном варианте РА.
В нашей работе у больных с развернутой стадией РА, позитивных по IgM РФ, значения ИЛ-31, ИЛ-33, ФНО-α и ИФН-γ были выше, чем в группе IgM РФ-негативных пациентов, не достигая, однако, значимых различий. При этом у пациентов, серонегативных по IgM РФ, отмечена четкая тенденция к повышению концентрации ИЛ-17А, ИЛ-17F и ИЛ-23. Кроме того, у пациентов, позитивных по IgM РФ, достоверно чаще встречалось высокое содержание ФНО-α и прослеживалась тенденция к увеличению частоты гиперпродукции ИЛ-31, ИЛ-1β и ИЛ-23. Мы обнаружили также значимую связь концентрации IgM РФ с уровнем ИЛ-17А, ИЛ-31 и ИФН-γ, а АЦЦП — с уровнем ИЛ-17А. Другие исследователи отметили взаимосвязь концентрации IgM РФ с содержанием ИЛ-1β, ИЛ-6 и ФНО-α, а АЦЦП — с содержанием ИЛ-1β [16].
По нашим данным, группы АЦЦП-положительных и АЦЦП-негативных пациентов значимо не различались по уровню провоспалительных цитокинов. Отмечена только тенденция к повышению концентрации ИЛ-17F, ИЛ-23, ИЛ-31 и ИФН-γ у АЦЦП-позитивных пациентов в сравнении с АЦЦП-негативными. При наличии АЦЦП незначительно преобладали высокие значения ИЛ-23 и ИФН-γ.
Д.А. Дибров и соавт. [13] при обследовании 106 пациентов с РА с помощью мультиплексной технологии хMАР обнаружили достоверное повышение содержания провоспалительных ИЛ-1β, ИЛ-6, ИФН-γ и ФНО-α в группе АЦЦП-позитивных пациентов в сравнении с АЦЦП-негативными, что отличается от наших данных. В определенной мере эти различия могут быть связаны с различиями в клинической характеристике пациентов. Пациенты в нашем исследовании не отличались по полу, возрасту, степени активности и рентгенологической стадии заболевания, однако длительность заболевания в исследовании Д.А. Диброва составила 4,0 [2,0; 8,0] года, в отличие от нашего исследования (9,4 [3,0; 13,0] года). Различия также касались и частоты выявления РФ и АЦЦП. В нашем исследовании значения этих показателей составили соответственно: 83,8 и 68,8%, а в сравниваемой работе — 54,7 и 55,7%. Наша когорта пациентов клинически более сопоставима с группой больных РА с развернутой стадией заболевания, которую эти авторы наблюдали ранее и в которой длительность болезни составила 4,7 [2,0; 8,0] года, а число пациентов, позитивных по IgM РФ, — 81,7%, по АЦЦП — 80,4% [28]. По мнению исследователей, наличие АЦЦП имеет важное значение для диагностики заболевания, но не связано с индексами активности болезни или острофазовыми показателями как при раннем, так и при развернутом РА.
Известно, что РФ и АЦЦП, наряду с СОЭ и СРБ, служат лабораторными признаками, входящими в классификационные критерии РА ACR/EULAR 2010 [17]. В настоящее время активно обсуждается внесение изменений в эти критерии для более корректной интерпретации результатов тестов на РФ и АЦЦП [31, 32]. Полагают, что специфичность классификации РА можно улучшить за счет уточнения серологической характеристики каждого из аутоантител: учета их уровня, наличия двойной серопозитивности по РФ и АЦЦП. Нами не обнаружено различий в концентрации и частоте повышения уровня провоспалительных цитокинов между группами пациентов, серопозитивных по двум аутоантителам (РФ и АЦЦП), изолированно по одному из них или у пациентов, негативных по РФ и АЦЦП.
По-видимому, большое влияние на продукцию цитокинов может оказывать титр аутоантител, а также наличие отдельных изотипов РФ, определение которых не входит в классификационные критерии РА.
Результаты систематического метаанализа, посвященного оценке изотипов РФ в диагностике и прогнозе РА [33], свидетельствуют о том, что обнаружение любого изотипа РФ имеет самую высокую чувствительность, а выявление изотипа IgA обладает наибольшей специфичностью и положительным коэффициентом правдоподобия для диагностики РА. Наличие в сыворотке крови больных РА изотипа IgM РФ имеет наивысшее диагностическое отношение шансов (21,7, 95% доверительный интервал 16,1–29,3). Установлено, что при раннем РА концентрация цитокинов связана с уровнем аутоантител. Так, W. Hueber et al. [23], исследовавшие у 56 пациентов с ранним РА показатели цитокинового профиля, включая ИЛ-1β, ИЛ6, ИФН-γ и ФНО-α, установили, что у пациентов с гиперпродукцией цитокинов наблюдаются более высокие значения IgM РФ и АЦЦП по сравнению с пациентами, у которых их уровень оказался низким. По данным А.С. Авдеевой и соавт. [15], у больных РА, высокопозитивных по IgM РФ, по сравнению с пациентами, негативными или низкопозитивными по IgM РФ, ФНО-α был достоверно выше, так же как и ИЛ-1β, ИЛ-6 и ИФН-γ. По данным систематического обзора и метаанализа, IgM РФ в 60% исследований был связан с более высокой активностью заболевания [33]. В нашей работе мы определяли только IgM-изотип РФ, а анализ результатов проводили без подразделения пациентов на группы в зависимости от низко- или высокопозитивных значений РФ или АЦЦП.
Заключение
В проведенном нами исследовании отмечено достоверно более высокое содержание ИЛ-6, ИЛ-23, ИЛ-31, ИЛ-33 и ИФН-γ у пациентов с развернутой стадией РА. Наиболее часто у больных РА встречалась гиперпродукция ИЛ-33, ИЛ-6, ИЛ-31, ИЛ-17F, ИЛ-23 и реже — ИФН-γ, ИЛ-17А, ИЛ-1β и ФНО-α.
В целом результаты настоящего исследования свидетельствуют о тесной взаимосвязи отдельных провоспалительных цитокинов с клиническими и лабораторными показателями активности заболевания и продукцией аутоантител при развернутом РА, а это позволяет предположить, что уровень цитокинов в сыворотке можно использовать в качестве биомаркера активности заболевания и терапевтического ответа. Дальнейшее изучение роли цитокинов в иммунопатогенезе клинико-иммунологических субтипов РА создает предпосылки для расширения возможностей персонифицированной терапии этого заболевания.
Информация с rmj.ru


