Содержание статьи
Оценка курсовой терапии инфликсимабом на сывороточную концентрацию некоторых цитокиновых и гормональных биомаркеров у пациентов с ревматоидным артритом
С. П. Оранский, кандидат медицинских наук
Л. Н. Елисеева, доктор медицинских наук, профессор
ГБОУ ВПО КубГМУ МЗ РФ, Краснодар
Ревматоидный артрит (РА) — одно из наиболее часто встречающихся аутоиммунных заболеваний в мире [1], распространенность которого в России по эпидемиологическим данным достигает 0,6% популяции и постоянно растет [2]. Суть патологического процесса при РА составляет генерализованное аутоиммунное воспаление, приводящее к развитию широкого спектра внесуставных (системных) органных проявлений и катаболических нарушений. В последнее время возрос интерес исследователей к иммуноэндокринным взаимоотношениям при РА. Известно, что почти все известные гормоны и нейротрансмиттеры влияют на специфические ответы иммунной системы с помощью реципрокных взаимодействий, участвуя в поддержании гомеостаза и в ответе на триггеры аутоиммунных реакций [3]. Некоторыми исследователями устанавливалось угнетение выработки гипоталамо-гипофизарных гормонов при РА, в частности, кортизола и адренокортикотропного гормона (АКТГ) на фоне провоспалительной цитокиновой активации [4], в то время как по данным других авторов значимого изменения уровня указанных гормонов у больных РА не регистрировалось [5].
Применение различных групп базисных препаратов в терапии РА позволяет уменьшить активность аутоиммунного процесса, в то же время до сих пор недостаточно данных о влиянии различных групп таких средств на иммуноэндокринный статус пациентов. Терапия генно-инженерными биологическими агентами в настоящее время является стандартом лечения РА и рекомендована ведущими мировыми профессиональными ассоциациями [6, 7], хотя до сих пор остаются недостаточно изученными многие аспекты действия этих препаратов. Так, противоречивыми остаются сведения о реакции цитокинового и гормонального звеньев при проведении терапии генно-инженерными биологическими агентами при РА, в частности, возможной динамики тех или иных цитокинов или гормонов, сроков формирования ответа на терапию. Некоторыми авторами неоднозначно оценивается возможность использования иммуноэндокринных биомаркеров в качестве возможного ориентира при выборе схемы биологической терапии РА, в то время как в других работах, напротив, такая возможность признается перспективной [8].
Целью данного исследования явилась оценка возможной динамики некоторых наиболее патогенетически значимых для развития РА цитокинов и гипофизарно-надпочечниковых гормонов на фоне курса лечения генно-инженерным биологическим препаратом инфликсимабом.
Материалы и методы исследования
Данная работа выполнялась в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (2008 г.). В исследование включено 40 (8 мужчин, 32 женщины, средний возраст 46,7 ± 9,3 года) пациентов с серопозитивным РА средней и высокой степени активности. Диагноз РА устанавливался в соответствии с классификационными критериями Американской коллегии ревматологиив (American College of Rheumatology, ACR) 1987 г. [9] и Американской коллегии ревматологии/Европейской противоревматической лиги (ACR/EULAR, European League Against Rheumatism) 2010 г. [10]. Все пациенты получали инфликсимаб в дозе 3 мг/кг внутривенно капельно по официально рекомендованной схеме: исходно, через 6, 14 и 22 недели после первого введения. В качестве фоновой базисной терапии использовался метотрексат в средней дозировке 12,5 ± 7,3 мг/нед. Полный 22-недельный курс лечения инфликсимабом проведен 36 пациентам (1 пациент выбыл из исследования по техническим причинам, у 1 в процессе терапии был выявлен туберкулез, у 2 — терапия была прервана в связи с развитием герпесвирусной инфекции). Из исследования исключались пациенты с сопутствующими хроническими инфекциями, опухолевыми заболеваниями, хронической почечной, сердечной недостаточностью, а также принимающие кортикостероиды.
Выраженность болевого синдрома оценивалась по визуальной аналоговой шкале (ВАШ), индексу активности заболевания DAS28. Показатели гемограммы определялись с помощью анализатора Bayer Advia 120, сывороточные концентрации С-реактивного белка (СРБ), ревматоидного фактора (РФ) определялись с помощью биохимического анализатора Siemens Advia 1800. Сывороточную концентрацию исследуемых цитокинов и гормонов определяли с помощью иммуноферментного анализатора Statfax 2100 с использованием готовых наборов реактивов следующих производителей: для фактора некроза опухоли альфа (ФНО-альфа) — «Протеиновый контур» (Россия), для интерлейкина-6 (ИЛ-6) — «Вектор-Бест» (Россия), для кортизола — «Алкор-Био» (Россия), для АКТГ — «Biomerica» (США).
Все изучаемые показатели оценивались в исходном состоянии, а также через 6, 14 и 22 недели после терапии. Статистическая обработка данных осуществлялась с помощью программы Statistica 6.0 с использованием непараметрических методов. Данные представлены в виде медианы и 25-го, 75-го процентилей, различия между группами оценивали с использованием критериев Манна–Уитни и Вилкоксона.
Результаты и их обсуждение
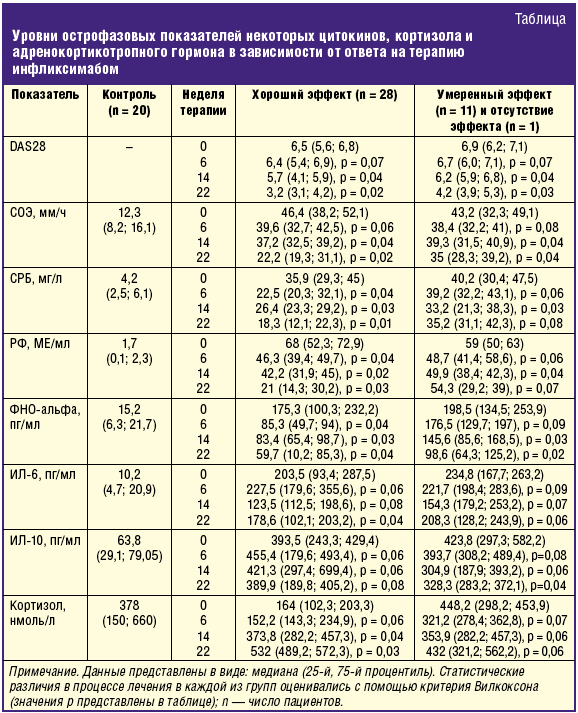
Нами произведена оценка влияния инфликсимаба на изучаемые цитокиновые и гормональные показатели в зависимости от ответа на препарат, определявшийся по рекомендуемым EULAR критериям. Среди пациентов, включенных в данное исследование, хороший клинический эффект зафиксирован у 28 пациентов (70%), умеренный — у 11 (27,5%) и отсутствие эффекта — у 1 пациента (2,5%). Динамика исследуемых параметров у больных РА при терапии инфликсимабом в зависимости от ответа на данный препарат представлена в таблице и на рисунке.
Нами установлено, что до применения инфликсимаба медиана и межквартильный размах исследуемых показателей в группе пациентов с хорошим эффектом статистически значимо не отличались от таковых в группе с умеренным/отсутствующим эффектом. Вне зависимости от ответа на терапию у пациентов обеих групп индекс DAS 28 и показатель скорости оседания эритроцитов (СОЭ) прогрессивно снижались начиная с 14-й недели с сохранением эффекта на весь период лечения (табл.). Концентрация СРБ и РФ устойчиво снижалась с 6-й недели терапии в группе с хорошим ответом на терапию, в группе же с умеренным эффектом после статистически значимого снижения к 14-й неделе терапии концентрация данных маркеров вновь не отличалась от исходных значений к 22-й неделе (табл.).
Уровень продукции ФНО-альфа в группе пациентов с хорошим ответом снижался начиная с 6-й недели терапии с усилением и сохранением эффекта к 22-й неделе (снижение почти в три раза по сравнению с исходным показателем) (рис., А). В группе с умеренным эффектом значимое снижение зафиксировано только с 14-й недели (27%), а к окончанию периода терапии составило 66% (рис., А).
Сывороточная продукция интерлейкина-6 незначительно снизилась только к 22-й неделе терапии инфликсимабом — на 12% в группе с хорошим ответом, в группе же с умеренным эффектом статистически значимого снижения уровня ИЛ-6 не зафиксировано ни на одном из этапов терапии (рис., Б). Продукция противовоспалительного ИЛ-10 статистически значимо не изменилась в группе с хорошим ответом и уменьшилась к 22-й неделе терапии в группе с умеренным эффектом (табл.).
Нами установлена гетерогенность сывороточной концентрации гипофизарно-надпочечниковых гормонов в зависимости от варианта ответа на инфликсимаб. Так, сывороточная продукция кортизола и АКТГ в группе пациентов с хорошим ответом на терапию снижалась, в то время как в группе с умеренным эффектом не отличалась от контрольных показателей (рис., В, Г). На фоне применения инфликсимаба при хорошем ответе на препарат нами определено увеличение сывороточной концентрации АКТГ и кортизола, продукция которых к 14-й и 22-й неделе терапии достигала показателей у здоровых лиц (рис., В, Г). В группе же пациентов с РА с умеренным эффектом от терапии или его отсутствием нами не зафиксировано статистически значимых различий концентрации АКТГ с контрольной группой.

Различия с контрольной группой оценивались с помощью критерия Манна–Уитни и Вилкоксона и представлены на рис. 1.
Мы предполагаем, что наблюдавшиеся различия в ответе на терапию инфликсимабом, вероятно, ассоциированы с разными типами иммуноэндокринной реактивности, природа которой пока остается невыясненной, хотя имеются гипотезы о ее возможной связи с генетическим полиморфизмом продукции цитокинов и исследованных нами гормонов гипофиза и надпочечников [11–13]. По полученным нами данным хороший эффект от терапии исследуемым препаратом наблюдался в группе пациентов с исходно сниженной продукцией кортизола и АКТГ. Важно также отметить, что наши результаты согласуются с данными некоторых других авторов, полученными в последнее время [8]. Механизм установленного нами улучшения функционального состояния гипофизарно-надпочечниковой оси на фоне терапии инфликсимабом до настоящего времени остается до конца невыясненным, хотя имеются некоторые фундаментальные данные, свидетельствующие о том, что ФНО-альфа может угнетать конвертазы стероидных гормонов в клетках надпочечников [14–15], в связи с чем возможно, что терапия анти-ФНО-альфа препаратами способна приводить к увеличению синтеза эндогенных стероидов.
Таким образом, установленный нами факт гетерогенности иммуноэндокринного ответа на терапию инфликсимабом может быть использован для выработки индивидуального плана лечения, когда целевой группой для их применения могут стать пациенты с исходно умеренно сниженной продукцией адренокортикотропина и кортизола. Важным прикладным аспектом полученных нами данных может стать также отсутствие необходимости назначения экзогенных кортикостероидов при применении генно-инженерных антицитокиновых препаратов, хотя данное предположение нуждается в проверке в более масштабных клинических исследованиях.
Литература
- Pedersen J. K., Kjaer N. K., Svendsen A. J. et al. Incidence of rheumatoid arthritis from 1995 to 2001: impact of ascertainment from multiple sources // Rheumatol. Int. 2009; 29: p. 411–415.
- Фоломеева О. М., Насонов Е. Л., Андрианова И. А. Ревматоидный артрит в ревматологической практике России: тяжесть заболевания в российской популяции больных. Одномоментное (поперечное) эпидемиологическое исследование (Raiser) // Научно-практическая ревматология. 2010; 1, c. 50–60.
- Bijlsma J. W., Straub R. H., Masi A. T. et al. Neuroendocrine immune mechanisms in rheumatic diseases // Trends Immunol. 2002; 23: p. 59–61.
- Eijsbouts A. M., van den Hoogen F.., Laan R. F. et al. Hypothalamic-pituitary adrenal axis activity in patients with rheumatoid arthritis // Clin. Exp. Rheumatol. 2005; 23 (5): p. 658–664.
- Cutolo M., Foppiani L., Prete C. et al. Hypothalamic-pituitary adrenocortical axis function in premenopausal women with rheumatoid arthritis not treated with glucocorticoids // J. Rheumatol. 1999; 26, p. 282–288.
- Saag K. G. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis // Arthritis Rheum. 2008; 59: p. 762–784.
- Smolen J. S., Landewe R., Breedveld F. C. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs // Ann. Rheum. Dis. 2010; 69 (6): p. 964–975.
- Straub R. H., Pongratz G., Cutolo M. Increased Cortisol Relative to Adrenocorticotropic Hormone Predicts Improvement During Anti–Tumor Necrosis Factor Therapy in Rheumatoid Arthritis // Arthritis Rheum. 2008; 58 (4): p. 976–984.
- Arnett F. C., Edworthy S. M., Bloch D. A. et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis // Arthritis Rheum. 1988. 31: p. 315–324.
- Aletaha D., Neogi T., Silman A. J. et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative // Arthritis Rheum. 2010; 69: p. 2569–2581.
- Lee Y. H., Ji J. D., Bae S. C. et al. Associations between tumor necrosis factor-alpha (TNF-alpha) –308 and –238 G/A polymorphisms and shared epitope status and responsiveness to TNF-alpha blockers in rheumatoid arthritis: a metaanalysis update // J. Rheumatol. 2010; 37 (4), p. 740–746.
- Maxwell J. R., Potter C., Hyrich K. L. Association of the tumour necrosis factor-308 variant with differential response to anti-TNF agents in the treatment of rheumatoid arthritis // Hum. Mol. Genet. 2008. 15; 17 (22): p. 3532–3538.
- Quax R. A., de Man Y. A., Koper J. W. et al. Glucocorticoid receptor gene polymorphisms and disease activity during pregnancy and the postpartum period in rheumatoid arthritis // Arthritis Res. Ther. 2012; 14 (4): p. R183.
- Jaattela M., Ilvesmaki V., Voutilainen R. et al. Tumor necrosis factor as a potent inhibitor of adrenocorticotropin-induced cortisol production and steroidogenic P450 enzyme gene expression in cultured human fetal adrenal cells // Endocrinology. 1991; 128: p. 623–629.
- Ehrhart-Bornstein M., Hinson J. P., Bornstein S. R. et al. Intraadrenal interactions in the regulation of adrenocortical steroidogenesis // Endocr. Rev. 1998; 19: p. 101–143.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






