Статья посвящена проблеме остеоартрита и коморбидных заболеваний, рассмотрены вопросы терапии остеоартрита.
Содержание статьи
Введение
Бремя костно-мышечных заболеваний значительно возросло в период с 2000 по 2015 г., став второй причиной в мире по показателю «количество лет, прожитых населением в нетрудоспособности (years lived with disability, YLDs)» [1]. Между 5-й и 9-й декадами жизни остеоартрит (ОА) и боль в спине являются основными костно-мышечными заболеваниями. По прогнозам экспертов, ОА станет самой распространенной причиной инвалидности к 2030 г. [2]. ОА рассматривается как гетерогенная группа заболеваний со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение хряща, субхондральной кости, синовия, связок, капсулы сустава с вовлечением околосуставных мышц. На современном этапе к основным механизмам развития ОА относят нарушения репаративных процессов, механический стресс и хроническое низкоинтенсивное воспаление в суставе. Нарушения репаративных процессов обусловлены замедлением пролиферации и дифференцировки хондроцитов, снижением синтеза протеогликанов и формирования гиалуроната, нарушением минерализации и ремоделирования субхондральной кости.
Факторами, определяющими механический стресс, являются избыточная масса тела, чрезмерная нагрузка на сустав, мышечная слабость, деформации сустава, перенесенные травмы и заболевания сустава, гипермобильность суставов. К развитию хронического низкоинтенсивного воспаления в суставе приводит наличие системной воспалительной активности (метаболический синдром, сахарный диабет 2 типа), наследственные или приобретенные нарушения регуляции воспалительного процесса. Последнее выступает также в роли важнейшего фактора прогрессирования ОА.
ОА и коморбидные состояния
Все большую актуальность приобретают проблемы тактики ведения пациентов с наличием 2 и более заболеваний, которые в отечественной научной литературе называют «сопутствующими», «сочетанными», «ассоциированными», тогда как в зарубежных источниках используются термины «коморбидные заболевания» или «коморбидные состояния» (comorbid diseases, comorbid conditions), «коморбидность» (comorbidity), «мультиморбидность» (multimorbidity). Коморбидность — это проявление дополнительного клинического состояния, которое существует или возникает на фоне текущего заболевания. Заболевания могут иметь общие патогенетические механизмы, совпадать по времени возникновения вне зависимости от активности или являться осложнениями основного заболевания или терапии [3] (рис. 1).
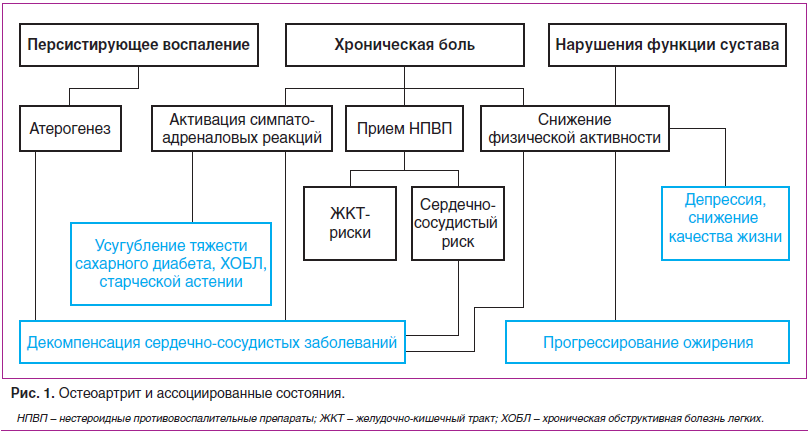
В XIX в. C.J. Bouchard отметил феномен сочетанной патологии и роль наследственности в ее формировании. У пациентов с артропатиями и их родственников часто встречались сахарный диабет, ожирение, камни желчных и мочевых путей, ранний атеросклероз, мигрень, бронхиальная астма и экзема. Это явление было названо артритизмом. Понятие «коморбидность» (comorbidity) ввел в практику Feinstein в 1970 г. Он продемонстрировал коморбидность на примере ухудшения прогноза больных острой ревматической лихорадкой, страдающих одновременно несколькими заболеваниями.
В настоящее время сформулированы основные постулаты коморбидности, излагаем их с собственными дополнениями [3].
Коморбидность чаще всего характеризует пожилых пациентов.
Неслучайный характер взаимосвязи заболеваний может быть обусловлен общими этиологическими и патогенетическими факторами, а также общими факторами риска.
У пациентов с коморбидностью увеличивается тяжесть состояния и ухудшается прогноз.
Сочетанные заболевания могут характеризоваться схожими клиническими субъективными и объективными симптомами.
Лечебная тактика в отношении коморбидных болезней должна быть пациентоориентированной; лечебные мероприятия проводятся параллельно или последовательно.
При лечении нескольких заболеваний одновременно обязательно должны учитываться фармакокинетические и фармакодинамические лекарственные взаимодействия.
Чем больше количество применяемых лекарственных препаратов, тем выше риск развития побочных эффектов.
Коморбидные заболевания снижают приверженность лечению.
Наличие дополнительного клинического состояния, существующего или возникающего на фоне текущего заболевания, подразумевает оценку коморбидного статуса (с использованием оценочных шкал, например индекса Чарлсона (Charlson Index) и др.).
Результаты систематического обзора по изучению ассоциированной патологии у пациентов с ОА (42 исследования из 16 стран) свидетельствуют о том, что при ОА в 1,2 раза чаще встречается сопутствующая патология, в 2,5 раза чаще имеется сочетание 3 заболеваний. При ОА повышается риск развития инсульта, пептической язвы и метаболического синдрома. Наличие ОА повышает в 1,5 раза риск общей и в 1,7 раза — кардиоваскулярной смертности начиная с 35-летнего возраста, что обусловлено снижением уровня физической активности, наличием сопутствующих заболеваний, неблагоприятными эффектами препаратов, используемых в лечении ОА [4]. Пятилетний анализ данных когорты KHOALA выявил значительную ассоциацию между сердечно-сосудистыми заболеваниями (ССЗ) и структурным прогрессированием гонартроза у пациентов без ожирения (ИМТ <30 кг/м2). Другие сопутствующие заболевания не влияли на структурный прогноз ОА. При коксартрозе отсутствие связи между структурными изменениями и коморбидностью подтверждает наличие двух разных определяющих факторов фенотипа заболевания [5].
Неожиданные данные получены при изучении связи ОА (без ограничения двигательной активности) и ССЗ. Установлено, что OA суставов кистей ассоциируется с субклиническим атеросклерозом, ССЗ и смертностью [4, 6–8]. В одном из наиболее цитируемых в медицинской литературе исследований (Фремингемское исследование) выявлена связь симптоматического ОА суставов кистей с двукратным повышением частоты возникновения ИБС по сравнению с данным показателем у больных без ОА [9]. Худший клинический исход генерализованного ОА с симтоматическим ОА кистей ассоциируется с ИБС (n=307 ≥50 лет, рентгенологическая стадия по Келлгрену — Лоуренсу ≥2, период наблюдения 2,6 года) [10].
Терапия ОА у коморбидного пациента: фокус на безопасность
Результаты первого исследования по оценке посреднической роли нестероидных противовоспалительных препаратов (НПВП) во взаимоотношениях между ОА и ССЗ (n=7743) продемонстрированы исследователями из Канады [11]. Авторы показали, что 41% от общего влияния ОА на повышение риска ССЗ опосредовано через прием НПВП. Доля вторичных исходов составила 23% для хронической сердечной недостаточности (ХСН), 56% для ИБС и 64% для острого нарушения мозгового кровообращения (ОНМК). В публикации 2019 г., посвященной безопасности пероральных неселективных НПВП при ОА, обобщены основные принципы применения этой группы лекарственных средств [12]. Показано, что частота осложнений со стороны верхних отделов желудочно-кишечного тракта (ЖКТ) (язвы и кровотечения) повышается при применении всех НПВП. Токсичность неселективных НПВП в отношении ЖКТ может быть снижена при одновременном применении ингибиторов протонной помпы до уровня, аналогичного таковому при применении ЦОГ-2-селективных НПВП.
В результате проведенного метаанализа (n=446 763) оценки риска развития инфаркта миокарда при использовании НПВП в терапии ОА получены данные о повышении риска острого сосудистого события при использовании любой дозы НПВП. Риск инфаркта повышается на 15% при приеме целекоксиба (200 мг), на 25% — при использовании напроксена (500 мг), на 35, 40 и 55% — при приеме диклофенака (100 мг), ибупрофена (1200 мг) и рофекоксиба (25 мг) соответственно. Риск развития инфаркта миокарда при использовании целекоксиба зависел от постоянного применения препарата в течение 30 дней и более, тогда как для ибупрофена, рофекоксиба, диклофенака и напроксена повышенный риск наблюдался в течение первых 7 дней использования. Абсолютный риск инфаркта миокарда, связанного с применением НПВП, оценивался примерно в 0,5–1,0% в год [13].
Отмечен более высокий риск развития ХСН при использовании любых НПВП, вероятно, в результате задержки натрия и воды в процессе ингибирования синтеза простагландинов, управляемых ЦОГ. Повышенный риск геморрагического ОНМК ассоциируется с приемом некоторых НПВП (диклофенак, мелоксикам). Риск острого повреждения почек повышается при использовании неселективных НПВП у пациентов с ОА в сочетании с артериальной гипертензией, ХСН, сахарным диабетом [12].
На современном этапе в условиях реальной клинической практики существуют лекарственные препараты с благоприятным профилем безопасности, применение которых позволяет достигать терапевтических мишеней у пациентов с ОА и сопутствующими заболеваниями. Препараты Симптоматические препараты замедленного действия (symptomatic slow acting drugs for osteoarthritis, SYSADOAs) обладают собственным анальгетическим эффектом, участвуют в подавлении катаболического воспаления, лежащего в основе прогрессирования ОА [11]. Согласно обновленному алгоритму рекомендаций по ведению пациентов с ОА коленного сустава Европейского общества по клиническим и экономическим аспектам остеопороза, остеоартрита и мышечно-скелетных заболеваний (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, ESCEO) 2019 г. лечебная тактика включает обязательное сочетание нефармакологических и фармакологических методов. SYSADOA являются обязательным компонентом лечения ОА. Препаратами первой линии служат рецептурный кристаллический глюкозамин сульфат (1500 мг/сут) или хондроитин сульфат (800 мг/сут). Неомыляемые соединения авокадо и сои, диацереин назначаются в качестве альтернативы базовой терапии. Рекомендуется использовать пероральные НПВП в качестве терапии 2-го этапа эпизодически, при более длительном приеме использование оральных НПВП должно основываться на профиле риска пациента. Использование гиалуроновой кислоты внутрисуставно рекомендуется у пациентов, у которых есть противопоказания к приему НПВП или сохраняются симптомы заболевания на фоне противовоспалительной терапии [14].
В России широко применяется многокомпонентный препарат замедленного симптоматического действия — оригинальный препарат Алфлутоп®, стандартизированный раствор для инъекций на основе биоактивного концентрата из мелкой морской рыбы. В состав препарата входят сульфатированные гликозаминогликаны, аналогичные матриксу гиалинового хряща: хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, глюкуроновая кислота, свободные аминокислоты, макро- и микроэлементы (Na, K, Ca, Mg, Fe, Cu, Zn) [15]. Алфлутоп® является референтным (оригинальным) препаратом и на сегодняшний день не имеет аналогов.
Действие препарата хорошо изучено в доклинических исследованиях in vivo на различных животных моделях и in vitro. Согласно результатам этих исследований Алфлутоп® демонстрирует интегрированное влияние на патологические процессы, специфичные для ОА [15]:
замедление деградации хрящевой ткани (ингибирование экспрессии протеаз и гиалуронидазы);
интенсификация анаболических процессов (увеличение синтеза аггрекана и гиалуроновой кислоты);
противовоспалительный эффект (угнетение высвобождения ИЛ-6, ИЛ-8, сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF), подавление экспрессии ЦОГ-2, регуляция экспрессии генов провоспалительных цитокинов);
антиоксидантное действие;
влияние на фосфорно-кальциевый обмен (уменьшение резорбции кости и снижение потери ионов кальция).
Получены данные о наличии у препарата Алфлутоп® гастропротективного эффекта на модели язвы желудка у крыс, вызванной приемом диклофенака. В контрольной группе животные 20 дней получали перорально диклофенак и плацебо препарата Алфлутоп®, что привело к снижению уровней простагландинов E2 (ПГE2) и F2α (ПГF2α) в слизистой оболочке желудка, которое сохранялось в течение 20 дней после отмены диклофенака. В экспериментальной группе крыс, получающих диклофенак в сочетании с препаратом Алфлутоп®, зафиксировано восстановление сниженных уровней ПГE2 и ПГF2α в слизистой оболочке желудка спустя 20 дней после прекращения введения диклофенака. Полученные результаты демонстрируют наличие гастропротективного эффекта у препарата Алфлутоп®, реализующегося, вероятнее всего, через модуляцию активности ферментов, вовлеченных в каскад арахидоновой кислоты [16].
С момента своего создания Алфлутоп® накопил солидную доказательную базу по результатам доклинических (in vivo и in vitro) и рандомизированных клинических исследований, его стабильные эффективность и безопасность подтверждены многолетним опытом применения. В то же время продолжаются научные исследования препарата, расширяются возможности его применения. Алфлутоп® хорошо зарекомендовал себя у пациентов с ОА и коморбидными заболеваниями, что позволило экспертам включить его в соответствующие рекомендации Российского научного медицинского общества терапевтов (РНМОТ). Алфлутоп® будет способствовать повышению приверженности пациентов с ОА лечению и, как следствие, улучшению результатов терапии [17].
В 2019 г. завершено многоцентровое проспективное рандомизированное исследование эффективности и безопасности применения альтернирующего режима введения препарата Алфлутоп® по сравнению со стандартной схемой терапии данным препаратом. Пациенты (n=130) с первичным ОА коленных суставов II–III стадии по Келлгрену — Лоуренсу, с интенсивностью боли при ходьбе не менее 40 мм по визуальной аналоговой шкале, потребностью в приеме НПВП не менее 30 дней за предшествующие 3 мес. были рандомизированы на 2 группы. В первой группе пациенты получали Алфлутоп® в альтернирующем режиме: по 2 мл внутримышечно через день (всего 10 инъекций). Во второй группе пациентам вводили препарат по 1,0 мл в/м ежедневно в течение 20 дней (традиционная схема). Длительность участия пациента в исследовании составила 14 нед. У пациентов обеих групп уже к 20–21-му дню лечения отмечали статистически значимое (p<0,001) уменьшение боли в коленных суставах при ходьбе и всех показателей WOMAC (боль, скованность, функциональная недостаточность) по сравнению с исходными. Дальнейшее уменьшение боли и показателей WOMAC наблюдали на протяжении 1 мес. и более после завершения терапии (p<0,001). На фоне проводимой терапии у пациентов обеих групп отмечали повышение качества жизни по опроснику по здоровью EQ-5D (р<0,001) по сравнению с исходным. Полученным данным соответствовала и оценка по критерию OMERACT-OARSI. К моменту завершения лечения на терапию ответили 84,6 и 81,5% пациентов в первой и второй группах соответственно. Авторами показана сопоставимая эффективность применения препарата Алфлутоп® как при стандартном, так и при альтернирующем режиме терапии [18].
Заключение
ОА является одной из самых распространенных причин болевого синдрома в структуре костно-мышечной патологии и остается социально значимой проблемой здравоохранения ввиду повышения продолжительности жизни населения. Заболевания сердечно-сосудистой системы (артериальная гипертензия, дислипидемии) и ЖКТ возглавляют перечень сопутствующих ОА патологий [19]. Ввиду высокой частоты встречаемости ассоциированных заболеваний у пациентов с ОА актуальным является поиск высокоэффективного лекарственного препарата с благоприятным профилем кардио- и гастробезопасности. Клинические и экспериментальные данные демонстрируют симптом- и структурно-модифицирующий эффекты препарата Алфлутоп® при ОА, что в сочетании с хорошей переносимостью, оптимальной степенью безопасности (в т. ч. гастропротективным эффектом) позволяет широко использовать его в терапии ОА при наличии коморбидных состояний в реальной клинической практике.
Информация с rmj.ru



