Оптимизация диагностики герпес-вирусной инфекции 8 типа
Содержание статьи
Введение
Вирус герпеса 8 типа (ВГ-8) — этиологический агент ряда заболеваний, в число которых входит саркома Капоши
(СК) [1–4]. Наиболее часто СК встречается в странах Африки, южнее Сахары, где герпес-вирусная инфекция 8 типа (ГВИ-8) является эндемичной и распространена более чем у 90% населения. У детей восточной и центральной Африки частота встречаемости ГВИ-8 — 25–60% [5].
Геном ВГ-8 обнаруживается во всех элементах СК при всех стадиях заболевания независимо от клинического варианта [4]. Чаще всего постановка диагноза СК, подтвержденного гистологическими исследованиями биоптата, не вызывает затруднений. Однако в ряде случаев, например на ранних этапах формирования СК, когда гистологическая картина нечеткая, и при иных сосудистых опухолях, этиологически не связанных с ВГ-8, но симулирующих очаги СК, бывает необходимо применение дополнительных диагностических процедур, позволяющих провести дифференциальный диагноз.
С этой целью зарубежные исследователи проводят диагностику маркеров ВГ-8 в крови пациента и в очаге СК. Применяются различные методы диагностики: иммуноферментный анализ (ИФА), полимеразная цепная реакция (ПЦР), гнездовая ПЦР (Нестед-ПЦР), гибридизация in situ, иммуногистохимический анализ [1, 6, 7].
Применение только ИФА недостаточно для высокоэффективной диагностики маркеров ВГ-8, поэтому часто сочетают применение разных тест-систем к различным вирусным белкам, а также применяют дополнительно другие методы. Неудовлетворительная чувствительность ИФА может объясняться, например, недостаточной иммуногенностью различных вирусных белков у части обследуемых или отсутствием литической активации, когда в тест-системе выявляются белки капсида или вирусной оболочки. При применении рекомбинантных белков в наборах ИФА необходимо помнить, что рекомбинантный белок не является точной копией нативного белка и часто представляет собой его усеченный вариант.
Применение ПЦР тоже не всегда эффективно. При латентной ГВИ-8 концентрация вирусной ДНК в крови пациента невелика и может не определяться из-за недостаточной чувствительности тест-системы. Следовательно, метод ПЦР также не является вполне надежным для диагностики инфекции, вызванной ВГ-8.
Мы предлагаем использовать комплексную диагоностику: ИФА для определения иммуноглобулинов класса G (IgG) к малому капсидному протеину ВГ-8 в сыворотке крови человека, ПЦР для определения ДНК ВГ-8 в мононуклеарах периферической крови человека (МПК) и в биоптате из очага СК, а также определение продукции интерферона α (ИФН-α), интерлейкина 1β (ИЛ-1β), рецепторного антагониста к ИЛ-1 (РА-ИЛ-1), ИЛ-6 и ИЛ-8 [1, 8]. Это позволяет повышать диагностическую эффективность исследования и выявлять активацию литического цикла вируса. Выявление прогностических факторов усиления вирусной инфекции позволит реагировать на возможные обострения комплексом профилактических мер, своевременно корректируя нарушения в иммунной системе.
Материал и методы
В комплексном исследовании участвовали 22 пациента с СК. Проведение ПЦР и ИФА соответствовало производственным протоколам выполнения процедур.
Техника постановки тестов ПЦР. Гепаринизированную кровь наслаивают на 2,0 мл раствора фиколла в центрифужной пробирке, затем центрифугируют при 2000 об./мин 30 мин. Отбирают взвесь мононуклеаров в отдельную пробирку, отмывают дважды 0,9% NaCl. Затем в МПК добавляют 200 мкл лизирующего буфера с протеиназой К, ставят в твердотельный термостат на 55 °С на 1 ч, каждые 15 мин встряхивая на вортексе. Затем пробу выдерживают 15 мин при 90 °С.
Аналогично размельченный в ступке биоптат помещают в пробирку, добавляют 200 мкл лизирующего буфера с протеиназой К, ставят в твердотельный термостат на 55 °С на 2 ч, каждые 15 мин встряхивая на вортексе. Затем пробу выдерживают 15 мин при 90 °С. Приготовленные образцы хранят при температуре -20 °С.
Вирусную ДНК определяют с помощью наборов ПЦР согласно протоколу производителя. Амплификацию осуществляют на аппарате «Терцик». Электрофорез к ДНК проводится в 1% агарозном геле с бромистым этидием (0,5 мкг/мл) в трис-ацетатном буфере, содержащем 0,2 мкл ЭДТА. Электрофорез проводится в горизонтальных камерах Bio-Rad (США) 35 мин.
Фотографируют результаты на цифровую камеру Gel Imager-2 (Россия) под мягким ультрафиолетовым освещением 360 нм.
Техника постановки тестов ИФА. Для определения IgG к малому капсидному протеину ВГ-8, ИФН-α и РА-ИЛ-1 применяют специальные тест-системы (Россия). В качестве аналита используют сыворотку крови пациентов. Процедуру проводят согласно протоколу фирмы-производителя. Для считывания используют планшетный ридер «Пикон» (Россия).
Статистическая обработка результатов исследования проводилась в программах Statistica 6 и Statistica 9.
Результаты и обсуждение
Обнаружение маркеров ВГ-8 хотя бы одним из описанных методов облегчает постановку дифференциального диагноза в случае сомнительной гистологической картины исследуемой гемангиомы. В частности, использование одного метода ИФА, либо одного метода ПЦР с определением ДНК в МПК позволяет определять антитела к малому капсидному протеину ВГ-8 в 45% случаев. Сочетанное использование этих двух методов выявляет маркеры ВГ-8 в 77% случаев, а определение при этом ДНК ВГ-8 в биоптате из очага СК повышает диагностическую чувствительность до 100% [1].
Анализ взаимосвязи ряда иммунологических показателей с маркерами ВГ-8 обнаружил корреляцию между выявлением антител IgG к МКП ВГ-8 и пониженным содержанием ИФН-α, а также между выявлением ДНК ВГ-8 и повышенным содержанием РА-ИЛ-1.
Определение содержания ИФН-α у пациентов с СК позволяет оценивать риски возможной литической активации ВГ-8, т. к. уровень ИФН-α в сыворотке крови коррелирует с антителами к малому капсидному протеину ВГ-8, а самое высокое содержание ИФН-α у пациентов с СК отмечается при отсутствии антител к ВГ-8. Это дает возможность своевременно проводить профилактический курс лечения, предотвращать появление новых очагов СК, останавливать рост уже имеющихся очагов и улучшать общее состояние пациента.
Зависимость распределения значений ИФН-α, определяемых в сыворотке крови больных СК, от выявления IgG к ВГ-8 графически представлена на рисунке 1.
Медиана в подгруппе пациентов без IgG составила 0,0 пг/мл, в подгруппе пациентов с СК с выявленными антителами к ВГ-8 — 12,38 пг/мл (р=0,01).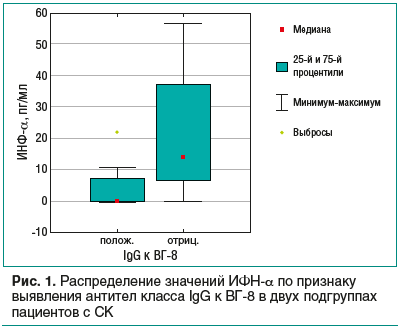
Для выяснения степени падения иммунитета в момент литической активации мы разбили группу СК (n=22) на подгруппы в зависимости от титра антител IgG к МКП ВГ-8. На основании величины оптической плотности мы выделили подгруппы: «-», где антитела не выявлялись, «±» — где оптическая плотность не превышала 0,5, «+» — с оптической плотностью 0,5–1,0, «++» — с оптической плотностью 1,0–2,0, «+++» — с оптической плотностью 2,0–3,0 и «++++» — с оптической плотностью >3,0 (рис. 2). В подгруппу «±» вошел только 1 больной. В подгруппах «++» и «+++» не оказалось ни одного больного. В итоге мы получили 2 подгруппы: 1-я подгруппа (-) — пациенты с отсутствием антител класса IgG к МКП ВГ-8 и 2-я подгруппа (+) — пациенты с наличием антител класса IgG к МКП ВГ-8. На основании анализа данных мы получили статистически достоверное отличие между этими двумя подгруппами (р=0,02).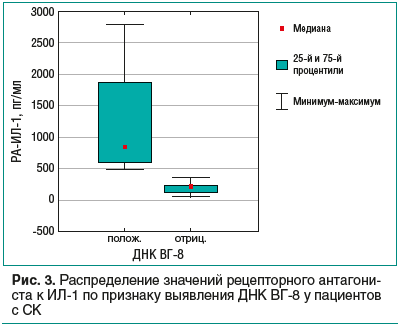
Как видно из данных, представленных на рисунках 1 и 2, наибольшие значения ИФН-α наблюдаются в сыворотке пациентов без антител IgG к ВГ-8. Однако при наличии антител по мере роста оптической плотности наблюдается увеличение значений ИФН-α. Несомненно, процесс подавления репликации вируса сопровождается усилением барьера для вирусной инфекции, увеличением выработки ИФН-α, что полностью укладывается в полученную нами картину распределения.
Другой закономерностью, выявленной в результате статистического анализа, оказалось повышение уровня
РА-ИЛ-1 у больных СК с выявленной ДНК ВГ-8, результат представлен на рис. 3.
Медиана в подгруппе с выявленной ДНК ВГ-8 составила 838 пг/мл, а в подгруппе с невыявленной ДНК — 187,5 пг/мл (р=0,0015).
Повышенное содержание РА-ИЛ-1 и снижение уровня самого ИЛ-1 уточняет момент снижения воспалительной активности через некоторое время после активации инфекции. Наши исследования показали, что уровень РА-ИЛ-1 повышен в случае выявления ДНК в МПК пациентов с СК (см. рис. 3), содержание ИЛ-1, напротив, снижено. Усиление синтеза РА-ИЛ-1 можно рассматривать как реакцию на поглощение макрофагами вирусной ДНК либо как компенсаторную реакцию иммунитета, ограничивающую эскалацию воспалительных процессов, поскольку для группы СК показано повышение уровня провоспалительного ИЛ-1β в сыворотке крови (р=0,0016) (рис. 4). Анализ содержания ИЛ-1 и РА-ИЛ-1 в сыворотке крови помогает контролировать активность воспалительного процесса с тем, чтобы корректировать терапию.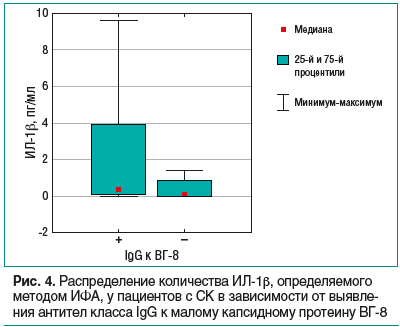
Определение содержания ИЛ-6 (рис. 5) показано у пациентов с СК для установления активности воспаления и давности активации вирусной инфекции, вызванной ВГ-8. Для ИЛ-6 физиологическим стимулятором является ИЛ-1, и повышение уровня ИЛ-6 происходит после выработки ИЛ-1. Поэтому уровень ИЛ-6 зависит от степени воспалительной активности и уровня ИЛ-1. ИФН-α также способен стимулировать выработку ИЛ-6. Показано, что при обнаружении ДНК ВГ-8 в МПК выявляются более высокие значения ИЛ-6 в сыворотке крови — это означает, что усиление вирусной репликации до величин, доступных для детекции методом ПЦР, по времени совпадает с повышением уровня ИЛ-6.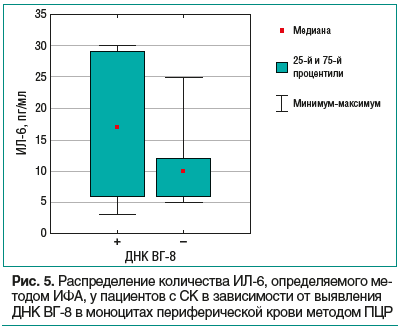
В проведенных нами исследованиях наименьшие значения ИЛ-8 в сыворотке крови отмечались в случае обнаружения у пациентов с СК антител к МКП ВГ-8 (рис. 6), т. е. падение выработки ИЛ-8 по времени совпадает с активацией литического цикла ВГ-8. Содержание ИЛ-8, который является хемоаттрактантом, в сыворотке крови пациентов с СК косвенно указывает на миграцию различных иммунных клеток в очаг воспаления, что дает потенциальную возможность своевременно купировать активацию инфекции, вызванной ВГ-8.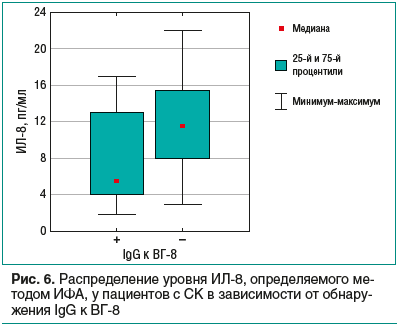
Обобщенные данные об ассоциации цитокинов с уровнем маркеров ГВИ-8 представлены в таблице 1.
Анализ полученных результатов исследования позволяет выделить 4 лабораторных варианта течения СК по состоянию вирусной репродукции и иммунитета человека (табл. 2).
Вариант I: отсутствие маркеров ВГ-8 совместно с высоким уровнем ИФН-α и сниженным количеством РА-ИЛ-1 говорит об отсутствии обострения.
Вариант II: наличие IgG к ВГ-8 и отсутствие ДНК ВГ-8 в крови, а также снижение ИФН-α и повышенные уровни РА-ИЛ-1 в сыворотке крови больных СК. Это закономерно при начинающемся процессе литической активации размножения вируса на фоне снижения клеточного иммунитета, причем о давности активации можно судить по нарастанию титра антител IgG к ВГ-8.
Вариант III: наличие ДНК ВГ-8 в МПК, выявление IgG к ВГ-8 и высоких уровней РА-ИЛ-1 в сыворотке крови больных СК. Вероятно, этот вариант характеризует ограничение воспалительных реакций.
Вариант IV: стадия ремиссии на фоне возросшего антивирусного иммунитета, определяемого по повышенным значениям ИФН-α и умеренным уровням РА-ИЛ-1.
Заключение
Таким образом, для комплексной диагностики ГВИ-8 и перспектив нейтрализации ее активности у пациентов с СК в период роста опухоли и отсева новых очагов, а также при ухудшении общего состояния пациента показано определять содержание в сыворотке крови ИФН-α, ИЛ-1, РА-ИЛ-1, ИЛ-6 и ИЛ-8. Совокупность этих параметров в комплексе с маркерами ВГ-8 позволит также оценить, на каком этапе находится активация инфекции, вызванной ВГ-8.
Сочетанное использование методов ИФА и ПЦР с определением ДНК в МПК позволяет повысить диагностическую чувствительность выявления ГВИ-8 у пациентов с СК. Исследование содержания ИФН-α у пациентов с СК позволяет оценивать риски возможной литической активации ВГ-8. Анализ содержания ИЛ-1 и РА-ИЛ-1 в сыворотке крови помогает осуществлять мониторинг активности воспалительного процесса с тем, чтобы корректировать терапию. Определение содержания ИЛ-6 показано у пациентов с СК для оценки активации вирусной инфекции, вызванной ВГ-8, т. к. усиление вирусной репликации до величин, доступных для детекции методом ПЦР, по времени совпадает с повышением уровня ИЛ-6. Мониторинг ИЛ-8 показано проводить для оценки потенциальной возможности и сроков достижения ремиссии при СК.
Таким образом, начало литической активации ВГ-8, сопровождаемой ростом титра антител к МКП ВГ-8, постепенным увеличением уровня ИФН-α, высоким содержанием ИЛ-1 и невысоким уровнем ИЛ-6, постепенно сменяется ситуацией, когда на фоне повышенной частоты обнаружения ДНК ВГ-8 отмечаются повышенные уровни ИЛ-6, рецепторного антагониста к ИЛ-1 и падение уровня самого ИЛ-1.
Комплексная диагностика дает возможность проводить своевременный профилактический курс лечения, предотвращать появление новых очагов СК, останавливать рост уже имеющихся очагов и улучшать общее состояние пациента.
Информация с rmj.ru


