Содержание статьи
Введение
Подагра является самой распространенной формой воспалительного артрита, вызванной отложением кристаллов моноурата натрия (МУН), образующихся в результате длительной гиперурикемии [1]. Подагра сопровождается периодическими изнурительно болезненными приступами артрита (вспышки подагры) и, если ее не лечить, может стать причиной формирования тофусов и развития деструктивной артропатии. Заболевание обычно связано с почечными, метаболическими и кардиоваскулярными сопутствующими патологиями, ухудшающими прогноз подагры [2].
Перелом в изучении подагры наступил в последние два десятилетия, в течение которых национальные и международные ревматологические сообщества разработали тактику диагностики, лечения и профилактики заболевания [3–8]. В 2020 г. были изменены и дополнены рекомендации Американской коллегии ревматологов (ACR), в которых обсуждаются новые стратегии ведения больных подагрой [9].
На сегодняшний день основное патогенетически обоснованное лечение подагры остается прежним — уратснижающая терапия (УСТ). Однако только половина больных добиваются снижения уровня мочевой кислоты в сыворотке крови (сМК) до целевых значений. Это происходит потому, что назначаемая УСТ не всегда адекватна, а в иных случаях сопровождается серьезными ошибками из-за незнания показаний и противопоказаний к подобной терапии, неверного подбора отдельных препаратов, схем лечения, неточной оценки эффективности. Особенно важно вовремя начать терапию, правильно ее корректировать во избежание формирования новых отложений МУН и с целью разжижения уже сформировавшихся при тофусной форме подагры.
Цель настоящей публикации: донести до врачей, принимающих решения по терапии подагры, алгоритм ведения и необходимость достижения целевых значений сМК для предотвращения вспышек и осложнений заболевания.
В результате консенсуса, основанного на данных текущей литературы и предпочтениях пациентов, ACR сформировала 42 рекомендации, включая 16 положений ранга «настоятельно рекомендуется». Рассмотрим данные рекомендации [9].
Уратснижающая терапия при подагре
Напомним, что больному тофусной формой подагры с рентгенологическими признаками повреждения суставов, двумя и более обострениями в год должна быть назначена УСТ. Кроме того, УСТ показана пациентам с сопутствующей хронической болезнью почек (ХБП) выше III стадии, сМК >9 мг/дл (535 мкмоль/л) или мочекаменной болезнью [9]. Благодаря правильному подбору УСТ снижается число вспышек артрита, уменьшаются размеры и число тофусных отложений вплоть до их полного исчезновения, а значит, улучшается качество жизни больных подагрой [10]. Особо отметим, что УСТ не назначается: 1) при первом приступе (есть исключения); 2) при выявлении бессимптомной гиперурикемии; 3) пациентам без тофусной формы заболевания или при редких (менее двух) вспышках подагры [9].
Хорошо известно, что аллопуринол является препаратом первой линии для всех пациентов, включая пациентов с ХБП выше III стадии. Аллопуринол — это ингибитор ксантиноксидазы (КО), представляющий собой пиразолопиримидин, аналог гипоксантина. Напомним, что фермент КО катализирует две стадии пуринового обмена: окисление гипоксантина до ксантина, а затем окисление ксантина до мочевой кислоты. Уратснижающий эффект ингибиторов КО реализуется путем замедления данных процессов окисления. Начинают УСТ с 50–100 мг/сут аллопуринола — так снижается риск обострений и предотвращаются серьезные нежелательные кожные реакции (СНКР) на начальном этапе терапии. В действительности 300 мг/сут — наиболее часто встречающаяся доза аллопуринола, хотя на ней не всегда возможно добиться значений сМК ≤6 мг/дл (360 мкмоль/л), что требует наращивания дозировок до достижения целевого уровня.
В 2014 г. завершилось сравнительное клиническое исследование препарата Аллопуринол АО «Органика» с препаратом Аллопуринол-Эгис у здоровых добровольцев, продемонстрировавшее биоэквивалентность этих препаратов. Наличие на российском рынке препарата Аллопуринол АО «Органика», выпускаемого в двух дозировках (100 мг и 300 мг), делает процесс подбора дозы удобным для врача и пациента, обеспечивая доступность эффективной и качественной лекарственной составляющей УСТ.
Отметим, что аллопуринол в дозе 600–800 мг/сут позволяет достичь нужной концентрации сМК в 75–80% случаев, но лечащие врачи не всегда назначают такие дозировки. Обращаем внимание на то, что запоздалое начало УСТ приводит к ускоренному отложению и тяжелому растворению кристаллов МУН, в дальнейшем к перманентной гиперурик-емии, что негативно сказывается на состоянии внутренних органов [9, 11]. Напомним, что подбор дозы аллопуринола осуществляется с учетом клиренса креатинина. Все врачи остерегаются СНКР на фоне приема аллопуринола у больных с ХБП, а именно кожной сыпи, сопровождающейся эозинофилией и системными проявлениями синдрома Стивенса — Джонсона и токсического эпидермального некролиза. Кроме того, выявлено, что аллель HLA-B*5801 связан с повышенным риском развития СНКР [12, 13]. Распространенность HLA-B*5801 высока среди представителей народа хань китайского, корейского и тайского происхождения (7,4%), ниже среди афроамериканцев (3,8%) и еще ниже среди белых и латиноамериканцев (каждые 0,7%) [13]. Азиатские и афроамериканские пациенты, принимающие аллопуринол, имеют в 3 раза более высокий риск СНКР по сравнению с белыми пациентами [14]. Тестирование на аллель HLA-B*5801 до старта терапии аллопуринолом условно рекомендуется для пациентов юго-восточного азиатского происхождения и для афроамериканцев. Случаи СНКР встречаются не часто (0,7/1000 пациенто-лет в США), в то же время смертность достигает 30% [11].
Хорошо известным препаратом второй линии УСТ, назначаемым при непереносимости или невозможности достижения целевых значений сМК на максимально переносимых дозах аллопуринола, является фебуксостат, селективный непуриновый ингибитор КО, производное 2-арилтиазола. Напомним, что в результате селективного ингибирования фебуксостатом окисленной и восстановленной форм КО происходит снижение концентрации сМК, не образуются активные формы кислорода, поэтому уменьшается воспаление, которому способствует оксидативный стресс. Терапевтические концентрации фебуксостата не ингибируют другие ферменты, участвующие в метаболизме пуринов или пиримидинов. Доказано, что суточная доза препарата 80 мг или 120 мг приводит к более эффективному снижению и поддержанию концентрации сМК по сравнению с аллопуринолом 300 мг/сут [9]. Фебуксостат метаболизируется в печени. В связи с тем что почки не являются основным путем выведения фебуксостата, его можно использовать при разных стадиях ХБП. В настоящее время в России завершены клинические исследования препарата Фебуксостат Органика (АО «Органика», Россия) в форме таблеток, покрытых пленочной оболочкой, в дозировках 80 мг и 120 мг.
Опорные исследования не показали реакционной способности этих двух препаратов, вопреки сведениям о развитии СНКР на фоне приема фебуксостата. Аллергические реакции на аллопуринол в анамнезе не являются противопоказанием к назначению фебуксостата. В то же время до тех пор, пока не будет представлено достаточного количества доказательств, опровергающих негативное влияние фебуксостата на сердечно-сосудистую систему, будут действовать прежние рекомендации по замене фебуксостата на аллопуринол у пациентов с серьезной коморбидной патологией сердечно-сосудистой системы (ишемической болезнью сердца или сердечной недостаточностью) или новым событием, связанным с сердечно-сосудистым заболеванием. Пациенты с ХБП выше III стадии начинают прием фебуксостата с доз ≤40 мг/сут с последующим титрованием доз [15, 16]. При назначении фебуксостата врач должен продолжать придерживаться цели достижения и поддержания уровня сМК <6 мг/дл (360 мкмоль/л) для всех пациентов, получающих УСТ.
В новые рекомендации внесен пункт о прекращении УСТ или снижении дозы препарата, если пациент находится в клинической ремиссии (нет вспышек подагры больше 1 года и отсутствуют тофусы) [9].
Напомним, что изменения в стратегии УСТ происходят в случае неэффективности или невозможности использования стандартной терапии. Альтернативой выступают урикозурические препараты. В текущих рекомендациях назначение урикозуриков предлагается отдельно от урикостатиков или в комбинации с аллопуринолом/фебуксостатом в ситуациях, когда надлежащий уровень сМК не достигнут, несмотря на максимальные дозы лекарств, когда обострения подагры развиваются чаще 2 раз в год и когда у больных наблюдаются неразрешающиеся тофусы. Например, пробенецид назначается по 500 мг 1–2 р/сут, далее доза титруется, одновременно пациентам нужно обеспечить защелачивание мочи. При коморбидной ХБП выше III стадии врач должен склоняться в сторону использования в качестве УСТ аллопуринола или фебуксостата вместо пробенецида [9].
Следует рассмотреть вновь в качестве терапии первой линии пеглотиказу или перейти на рекомбинантную уриказу при неэффективном предшествующем лечении (если уровень сМК не достиг нормы) со вспышками подагры чаще 2 раз в год или с неразрешающимися подкожными тофусами [9].
Нам бы хотелось еще раз остановиться на спорных моментах актуальных рекомендаций разных сообществ ревматологов, касающихся назначения УСТ (табл. 1). Напоминаем, что назначать УСТ необходимо сразу при установлении диагноза, т. е. фактически с первого приступа подагры. Аллопуринол — препарат выбора для всех пациентов, коррекция доз проводится с учетом скорости клубочковой фильтрации (СКФ). Фебуксостат — препарат второй линии, назначаемый при неэффективности или непереносимости аллопуринола, он более эффективен у пациентов с ХБП, чем аллопуринол, в дозах, подобранных в соответствии с клиренсом креатинина [3, 4, 7–9].
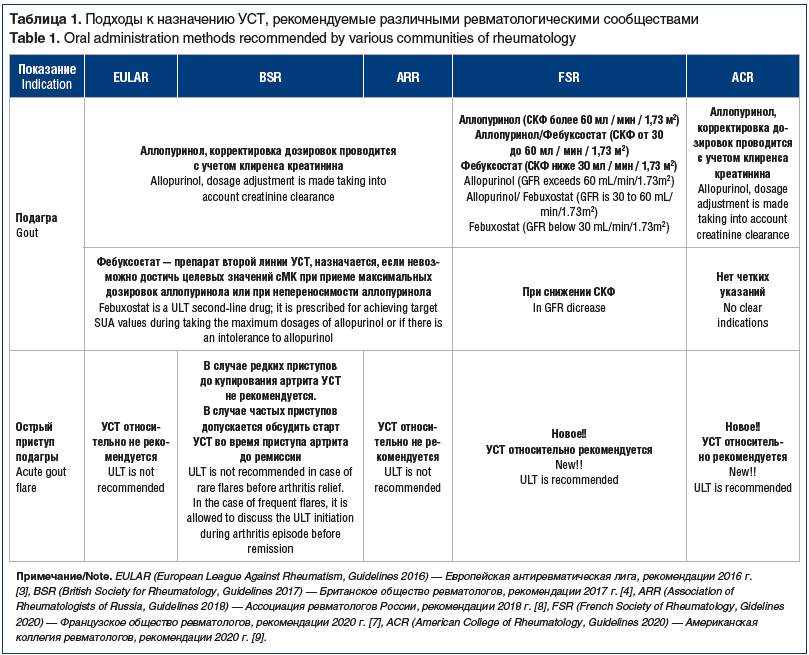
Выбор терапии при остром приступе подагры
По-прежнему для купирования острого приступа подагры показаны колхицин, нестероидные противовоспалительные препараты (НПВП) и кортикостероиды (пер-
орально, внутрисуставно или внутримышечно). В качестве вспомогательных мер предлагается локально использовать холод [9].
До сих пор препаратом первой линии для лечения артрита остается колхицин. Он должен быть назначен в течение 12 ч с момента развития острого подагрического приступа. Результатами исследования AGREE доказано, что если пациент сам примет низкую дозу колхицина (l,8 мг) в течение первых 12 ч с момента начала приступа артрита, то по эффективности она будет равна высокой дозе (4,8 мг), а по безопасности будет сравнима с плацебо. Схема купирования обострения: в первые часы приступа артрита рекомендуется принять 1,2 мг колхицина, затем через час — половину предыдущей дозы; со второго дня нужно продолжить противовоспалительную терапию (0,6 мг/сут колхицина) вплоть до ремиссии. Одновременное назначение циклоспорина, кларитромицина, верапамила и кетоконазола повышает концентрацию колхицина в плазме крови, что способствует увеличению риска развития нежелательных явлений. Если больной страдает тяжелой ХБП, данный препарат применять не рекомендуется [17].
Как и прежде, НПВП относятся к препаратам первой линии для купирования вспышек заболевания, но у 90% пациентов имеется как минимум одно противопоказание к их назначению. Особое место в лечении хронического суставного синдрома отводится мелоксикаму — селективному блокатору ЦОГ-2, имеющему полную линейку лекарственных форм. Его выгодное отличие от других НПВП — высокая обезболивающая и противовоспалительная активность и, одновременно, относительно удовлетворительный профиль безопасности и переносимости [18–22].
Разумеется, погасить острый приступ подагры можно преднизолоном (доза для перорального приема 30–35 мг/сут в течение 5 дней) либо внутримышечными, внутривенными или внутрисуставными инъекциями глюкокортикостероидов с благоприятным профилем безопасности, особенно в случае моноартрита или когда невозможен прием пероральных препаратов [9].
Комбинированная терапия с использованием всех вышеперечисленных групп препаратов показана при вовлечении в воспалительный процесс сразу нескольких суставов.
В случае частых приступов артрита, либо при противопоказаниях, неэффективности или плохой переносимости колхицина/НПВП/глюкокортикостероидов, либо при невозможности приема пероральных форм препаратов, для купирования обострения настоятельно рекомендуется применение блокаторов интерлейкина-1 или адренокортикотропного гормона [9]. Кроме того, назначаются препараты: канакинумаб — моноклональное антитело к интерлейкину-1β, — который купирует болевой синдром более эффективно, чем триамцинолона ацетонид, у пациентов со вспышкой подагры и противопоказаниями, плохой переносимостью колхицина/НПВП/глюкокортикостероидов; анакинра — модификация белка-антагониста к рецептору интерлейкина-1 человека, — которая эффективно снижает интенсивность болей у пациентов с острым приступом. Прием данных препаратов противопоказан при инфекционном процессе в связи с риском развития сепсиса у пациентов, принимающих блокаторы интерлейкина-1, перед назначением предполагается скрининг на скрытые инфекции [23].
Профилактическая терапия обострений подагры
Считается, что меры предосторожности с целью профилактики вспышек подагры должны применяться от 3 до 6 мес. при инициации УСТ с использованием маленьких дозировок колхицина, или НПВП, или преднизона/преднизолона [3, 9].
На кафедре факультетской терапии ФГАОУ ВО РНИМУ им. Н.И. Пирогова было проведено когортное проспективное исследование по оценке эффективности 12-недельного курса сочетанной УСТ аллопуринолом с увеличением дозы до 300 мг/сут на фоне противовоспалительного лечения мелоксикамом 7,5 мг/сут. По результатам исследования был сделан вывод: профилактическая терапия может предотвратить приступы подагрического артрита и улучшить качество жизни больных подагрой [24].
Сохраняются рекомендации по коррекции сопутствующей терапии. При вспышке артрита желательно провести смену мочегонного у пациентов, находящихся на терапии гидрохлортиазидом. Пациентам с артериальной гипертензией в анамнезе рекомендован прием лозартана, больным с гиперлипидемией — прием фенофибрата. Рекомендуется прекратить прием низкой дозы аспирина, назначенного по соответствующим показаниям, независимо от активности заболевания.
Принципиально новыми являются рекомендации по изменению образа жизни у пациентов с подагрой.
Ограничить или воздержаться от употребления алкогольных напитков, включая пиво. По данным исследований, уровни сМК у пациентов, которые смогли ограничить или отказаться от употребления алкоголя, были на 1,6 мг/дл ниже, чем у пациентов, излишне употреблявших алкоголь [25, 26]. Кроме того, небольшое когортное исследование [25] продемонстрировало, что, несмотря на проведение УСТ, у пьющих пациентов (≥30 единиц алкоголя в неделю) с большей вероятностью, чем у непьющих, будут продолжаться вспышки подагры. Под влиянием алкоголя реализуется несколько механизмов развития гиперурикемии. При чрезмерном употреблении алкоголя он превращается в молочную кислоту, которая уменьшает почечную экскрецию мочевой кислоты, конкурентно ингибируя секрецию мочевой кислоты проксимальными канальцами. При хроническом потреблении алкоголя увеличивается производство пуринов и мочевой кислоты, ускоряя разложение аденозинтрифосфата до аденозинмонофосфата — предшественника уратов. Более выраженный гиперурик-
емический эффект пива по сравнению с другими алкогольными напитками объясняется высоким содержанием пурина, преимущественно гуанозина. Так, один бокал пива повышает концентрацию сМК на 0,16 мг/дл [27].
Уменьшить потребление пуринов. К продуктам, богатым пуринами, относятся все виды мяса и субпродукты, вся рыба и морепродукты, некоторые овощи: шпинат, спаржа, грибы, а также дрожжевые экстракты. Повышенный риск, связанный с употреблением мяса и рыбы, имеет многофакторный характер. С одной стороны, было продемонстрировано влияние избытка экзогенных пуринов животного происхождения на увеличение уровня мочевой кислоты. С другой стороны, красное мясо является основным источником насыщенных жиров, которые снижают почечную экскрецию уратов. Но некоторые сырые овощи, такие как шпинат, имеют еще более высокую концентрацию пуринов, чем сырое мясное филе (70 мг на 100 г против 58 мг на 100 г соответственно) [27].
Увеличить потребление растительных белков, овощей (кроме вышеупомянутых), бобовых и фруктов. Отмечено, что потребление овощей и бобовых, богатых пуринами, не увеличивает риск гиперурикемии и подагры. Флавоноидные гликозиды, присутствующие в бобовых и овощах, обладают ингибирующим действием на КО [28, 29].
Избегать сладких безалкогольных напитков (лимонада, соков, энергетиков) [30]. Фрукты, богатые фруктозой, увеличивают риск развития гипер-
урикемии и подагры. Прием внутрь 1 г фруктозы на 1 кг массы тела увеличивает концентрацию сМК на 1–2 мг/дл в течение 2 ч после приема пищи. Тем не менее полезные эффекты от употребления фруктов для общего здоровья, по-видимому, превосходят этот риск, но рекомендуется ограничить прием фруктовых соков и богатого фруктозой кукурузного сиропа [31].
Снизить вес. Нормализацию массы тела следует проводить медленно, так как увеличение уровня кетоновых тел, связанное со строгим голоданием, вызывает гиперурикемию [32].
Добавить в ежедневный рацион 200–300 мг витамина С. Он ингибирует КО и может быть эффективен при лечении и профилактике подагры [33].
Употреблять в день за один прием 10–12 ягод вишни, или экстракт вишни, или стакан кислого вишневого сока. Показано, что вишня уменьшает концентрацию сМК благодаря содержащимся в ней антоцианинам, которые придают ей цвет и обладают естественными противовоспалительными свойствами. Антоцианины также содержатся в чернике, но убедительных доказательств полезного влияния черники на подагру не получено. Комбинация вишни и аллопуринола снижает риск приступов подагры на 75%. Тем не менее важно есть все в меру, и вишня — не исключение. Большое количество вишни или вишневого сока может вызвать диарею [34, 35].
К сожалению, уровень доказательности рекомендаций по питанию все еще остается умеренным/низким или очень низким (класс C или B).
Заключение
Важно иметь в виду, что международные и национальные сообщества постоянно пересматривают и обновляют информацию по тактике ведения пациентов в свете развития медицинских знаний и технологий. Рекомендации ACR содержат описание алгоритмов лечения с учетом индивидуальных особенностей каждого больного для применения в общей клинической практике. Они созданы для обес-
печения получения желаемых оптимальных результатов, но не гарантируют определенных исходов, так как не могут отразить все неопределенности и нюансы ухода за пациентом. При этом остается неизменным требование обязательной информированности пациентов о наличии эффективных методов лечения заболевания, принципах терапии острого приступа подагры и элиминации кристаллов уратов путем пожизненного снижения уровня сМК ниже целевых значений. Важны рекомендации по коррекции образа жизни для достижения максимального лечебного эффекта.
Благодарность
Редакция благодарит АО «Органика» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgment
Editorial Board is grateful to JSC «Organica» for the assistance in technical edition of this publication.
Сведения об авторах:
Громова Маргарита Александровна — к.м.н., ассистент кафедры факультетской терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-3757-058X.
Цурко Владимир Викторович — д.м.н., профессор кафедры общей врачебной практики ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; профессор кафедры факультетской терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва,
ул. Островитянова, д. 1; ORCID iD 0000-0001-8040-3704.
Контактная информация: Громова Маргарита Александровна, e-mail: margarita-gromov@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 27.01.2021, поступила после рецензирования 19.02.2021, принята в печать 19.03.2021.
About the authors:
Margarita A. Gromova — Cand. of Sci. (Med.), Assistant Professor of the Department of Faculty Therapy of the Institute of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-3757-058X.
Vladimir V. Tsurko — Dr. of Sci. (Med.), Professor of the Department of General Practice, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; Professor of the Department of Faculty Therapy of the Institute of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-8040-3704.
Contact information: Margarita A. Gromova, e-mail: margarita-gromov@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 27.01.2021, revised 19.02.2021, accepted 19.03.2021.
.
Информация с rmj.ru






