Новая коронавирусная инфекция
COVID-19: экстрапульмональные проявления
И.В. Маев, А.В.
Шпектор, Е.Ю. Васильева, В.Н. Манчуров, Д.Н.
Андреев
ФГБОУ ВО «Московский государственный
медико-стоматологический университет им. А.И.
Евдокимова» Минздрава России, Москва, Россия.
Аннотация
Новая коронавирусная инфекция COVID-19 в
превалирующем большинстве случаев манифестирует
респираторными симптомами и лихорадкой, однако у
некоторых пациентов могут отмечаться
сердечно-сосудистые и гастроэнтерологические
проявления. Особенностью клинического синдрома
COVID-19 является развитие выраженных
иммунопатологических реакций и нарушений
гемостаза, ведущее к широкому спектру
сердечно-сосудистых осложнений. Течение COVID-19
может осложниться развитием острого инфаркта
миокарда, венозных и артериальных тромбозов и
тромбоэмболий в различных сосудистых бассейнах,
острого повреждения миокарда и миокардита. Среди
гастроэнтерологических проявлений наиболее часто
выявляются диарея, тошнота или рвота, а также
абдоминальная боль. Эти симптомы могут
предшествовать появлению респираторных признаков
заболевания, а в некоторых случаях выходить на
первый план в клинической картине заболевания.
Помимо этого, у части больных наблюдаются
лабораторные признаки поражения печени (повышение
сывороточных трансаминаз). Точный патогенез
описанных нарушений продолжает изучаться.
Ключевые слова: COVID-19, SARS-CoV-2,
острый инфаркт миокарда, повреждение миокарда,
коагулопатия, тромбоз, острый коронарный синдром,
диарея, рвота, абдоминальная боль, потеря
аппетита.
Для цитирования: Маев И.В., Шпектор А.В.,
Васильева Е.Ю. и др. Новая коронавирусная инфекция
COVID-19: экстрапульмональные проявления.
Терапевтический архив. 2020; 92 (8): 4–11. DOI:
10.26442/00403660.2020.08.000767
АПФ 2 – ангиотензинпревращающий фермент 2
ВРЗ – верхнее референсное значение
ДИ – доверительный интервал
ЖКТ – желудочно-кишечный тракт
ИМ – инфаркт миокарда
ОКС – острый коронарный синдром
ОПМ – острое повреждение миокарда
ОРДС – острый респираторный дистресс-синдром
ТГВ – тромбоз глубоких вен
ТЭЛА – тромбоэмболия легочной артерии
ЧКВ – чрескожное коронарное вмешательство
ЭКГ – электрокардиограмма
ЭхоКГ – эхокардиограмма, эхокардиография
Введение
В начале декабря 2019 г. в 11-миллионном городе
Ухань (Китайская Народная Республика) произошла
вспышка новой коронавирусной инфекции COVID-19,
вызванной одноцепочечным (+)РНК-вирусом –
SARS-CoV-2 (Severe acute respiratory
syndrome-related coronavirus 2) [1, 2]. Этот
патоген способен передаваться от человека к
человеку воздушно-капельным (при кашле, чихании,
разговоре, поцелуях), воздушно-пылевым и
контактным путем [3]. Согласно крупным выборкам,
медиана инкубационного периода заболевания
составляет 4–5 дней [4, 5]. Большинство случаев
инфицирования являются асимптомными и легкими,
однако в 5% новая коронавирусная инфекция COVID-19
приводит к развитию жизнеугрожающих состояний и
осложнений [6].
11 марта 2020 г. Всемирная организация
здравоохранения охарактеризовала принявшее мировой
масштаб распространение новой коронавирусной
инфекции COVID-19 как пандемию [7]. По состоянию
на 19 мая 2020 г. во всем мире зарегистрировано
более 4,8 млн случаев данного инфекционного
заболевания (рис. 1); более 318 тыс. человек
погибли от его осложнений; более 1,5 млн –
выздоровели [8]. В Российской Федерации число
инфицированных превышает 300 тыс. случаев, а
ассоциированных смертей более 2800 [8].
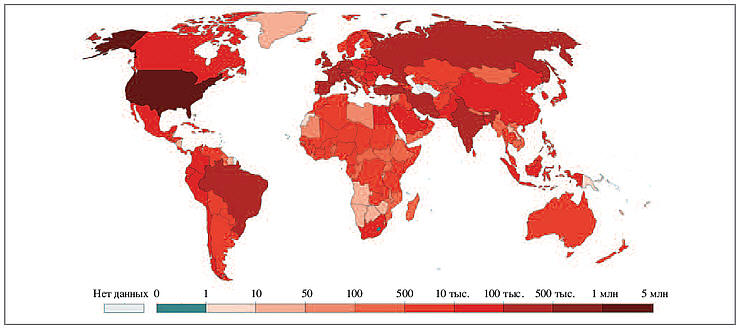
Рис. 1. Суммарное число лиц,
инфицированных SARS-CoV-2 (данные Европейского
центра профилактики и контроля заболеваний,
19.05.2020) [8].
В случае клинической манифестации инфекции,
вызванной вирусом SARS-CoV-2, клинические
проявления носят преимущественно респираторный
характер, вызывая в наиболее тяжелых случаях
интерстициальную пневмонию, которая может
осложниться развитием острого респираторного
дистресс-синдрома (ОРДС) и/или полиорганной
дисфункции [9]. Тем не менее необычной чертой
клинического синдрома COVID-19 является выраженная
системность процесса, характеризующаяся
способностью поражать не только респираторный
тракт, но и другие органы и системы и вызывать
иммунопатологические реакции и нарушения
гемостаза, ведущие к вторичным осложнениям [10].
Так на сегодняшний день многочисленными
сообщениями показано, что у ряда пациентов с
COVID-19 могут наблюдаться сердечно-сосудистые и
гастроэнтерологические проявления.
Поражения сердечно-сосудистой системы при
COVID-19
По мере роста числа заболевших накапливается
все больше данных о сердечно-сосудистых
осложнениях COVID-19, среди которых описаны острые
инфаркты миокарда (ИМ), венозные и артериальные
тромбозы и тромбоэмболии в различных сосудистых
бассейнах, развитие острого повреждения миокарда (ОПМ),
миокардиты, нарушения ритма сердца [11–15].
Развитие такого широкого спектра
сердечно-сосудистых проявлений при COVID-19 может
быть обусловлено наличием взаимосвязанных узловых
звеньев патогенеза, таких как гипервоспаление,
эндотелиальная дисфункция, коагулопатия и гипоксия
[13, 15–17]. Условно можно разделить
сердечно-сосудистые события при COVID-19 по
клиническому фенотипу на
тромботические/тромбоэмболические осложнения,
возникающие в результате коагулопатии, и
повреждение миокарда, не связанное с тромбозом.
Расстройства гемостаза при COVID-19
характеризуются развитием коагулопатии,
проявляющейся тромбозами в различных сосудистых
бассейнах. Более того, показано, что у части
пациентов развивается синдром диссеминированного
внутрисосудистого свертывания [18]. Развитие
тромбозов и тромбоэмболий более характерно для
пациентов с тяжелым течением COVID-19 [15, 19, 20]
и вносит существенный вклад в структуру
летальности [14]. Клинические проявления зависят
от сосудистого бассейна, в котором разворачиваются
основные события, и могут включать в себя острый
коронарный синдром (ОКС), ишемический инсульт,
острую мезентериальную ишемию, артериальные
тромбозы других бассейнов, тромбозы глубоких вен (ТГВ)
таза и конечностей, системы портальной вены,
тромбоэмболию легочной артерии (ТЭЛА) [15, 21–24].
Ниже мы подробно остановимся на ключевых
клинических фенотипах тромботических осложнений.
ОКС при COVID-19. Тромбоз коронарных
артерий при COVID-19 может развиваться по двум
основным механизмам: во-первых, как проявление
коагулопатии, характерной для данного заболевания
[17, 19, 25, 26]; во-вторых, вследствие
дестабилизации коронарного атеросклероза в ответ
на вирусную инфекцию и системное воспаление
[27–30]. По имеющимся данным, ОКС имеет
определенный вес в структуре смертности среди
госпитализированных пациентов с COVID-19. Так,
анализ серии летальных исходов у
госпитализированных пациентов с COVID-19,
проведенный Y. Du и соавт. (2020 г.), показал, что
ОКС стал непосредственной причиной смерти у 4
(4,9%) из 81 пациента [31]. Диагностику ОКС у
пациентов с COVID-19 может осложнять то, что
неишемическое повреждение миокарда нередко
мимикрирует под острую ишемию миокарда [32]. Так,
S. Bangalore и соавт. (2020 г.) опубликовали
данные многоцентрового регистра, цель которого –
изучение причин элевации сегмента ST у пациентов с
COVID-19, госпитализированных в г. Нью-Йорке.
Анализ данных этого регистра показал, что среди
пациентов, у которых на электрокардиограмме (ЭКГ)
регистрировалась элевация сегмента ST, лишь 44%
пациентов имели признаки обструктивного
коронарного атеросклероза/тромбоза и локальные
зоны дискинезии по данным эхокардиографии (ЭхоКГ).
Большинству пациентов в этой группе выполнено
экстренное чрескожное коронарное вмешательство (ЧКВ)
[26]. Частота ОКС среди пациентов с подтвержденным
COVID-19 в настоящее время не поддается корректной
оценке в виду крайне скудного набора данных [32].
Тем не менее с увеличением числа заболевших растет
озабоченность проблемой безопасного лечения
пациентов с ОКС в условиях пандемии COVID-19. В
опубликованных работах, посвященных данной
проблеме, обозначились существенные противоречия.
Так, Z. Jing и соавт. (2020 г.) предлагали
использовать внутривенный тромболизис как метод
выбора для экстренной госпитальной реперфузии при
ОКС с подъемом сегмента ST у пациентов с
подтвержденным или подозреваемым COVID-19 для
уменьшения числа контактирующего с пациентом
медперсонала и возможностью ранней строгой
изоляции [33]. Апологетами сохранения существующей
парадигмы реперфузии, основанной на первичном ЧКВ,
выступают E. Mahmud и соавт. (2020 г.) [32],
противопоставляя предложенному подходу несколько
положений. Во-первых, у пациентов с COVID-19 можно
встретить мимикрию
клинико-электрокардиографической картины
повреждения миокарда, ассоциированного тяжелым
течением COVID-19, под ОКС с подъемом сегмента ST
[26, 34, 35]. Очевидно, что выполнение
тромболизиса в таком случае не оправдано и может
нести дополнительные риски [26, 32]. Во-вторых,
тромболизис эффективен лишь в 50–60% случаев и
пациентам после неэффективного тромболизиса все
равно придется выполнять спасительное ЧКВ, лишь
увеличивая таким образом число контактных
медицинских работников. В-третьих, работа в
рентгеноперационных возможна с соблюдением
необходимых противоэпидемических мер и с
минимальным числом задействованного персонала
[26]. Данная позиция поддерживается и
рекомендациями Европейского общества кардиологов
по диагностике и лечению сердечно-сосудистых
заболеваний в условиях пандемии COVID-19 [36].
Таким образом, в настоящее время нет причин
отходить от существующего алгоритма реперфузии,
основанного на первичном ЧКВ. Однако, принимая во
внимание возможный патогенез тромбоза коронарных
артерий вследствие коагулопатии без разрыва
атеросклеротической бляшки, открытым остается
вопрос о режиме использования антитромботических
препаратов и методик проведения ЧКВ в данной
группе пациентов. Здесь же отдельно следует
упомянуть о возможном развитии острого ИМ 2-го
типа, не связанного с тромбозом коронарных
артерий, у пациентов с тяжелым течением COVID-19.
Причиной данного состояния может послужить
дисбаланс между потребностью миокарда в кислороде
и его доставкой на фоне тяжелых респираторных и
гемодинамических нарушений, спонтанных диссекций
коронарных артерий [13, 37].
ТГВ и ТЭЛА. Грозными проявлениями
коагулопатии, часто развивающейся при COVID-19,
являются ТГВ и ТЭЛА [17, 19, 22]. Частота ТЭЛА у
госпитализированных пациентов с COVID-19
достаточно высока и может достигать 25–27% [14,
15]. При этом смертность среди пациентов, у
которых ТЭЛА осложнила течение
COVID-19-ассоциированной пневмонии, в одной из
опубликованных работ составила 40% [38]. В этой
связи бесспорную актуальность приобрел вопрос
эффективной профилактики тромботических
осложнений. Первые важные результаты в этом
направлении получены в работе N. Tang и соавт.
(2020 г.), в которой тромбопрофилактика с
использованием гепаринов (главным образом,
низкомолекулярных) достоверно снизила летальность
у пациентов с COVID-19-ассоциированной
коагулопатией в сравнении с пациентами, которым
тромбопрофилактика не проводилась (40,0% против
64,2% соответственно, p=0,029) [20]. Учитывая
накопленные данные, несколькими международными
научными обществами рекомендована
тромбопрофилактика с использованием
низкомолекулярных гепаринов или фондапаринукса у
всех госпитализированных пациентов с COVID-19 при
отсутствии противопоказаний и повышенного риска
кровотечений [25, 39]. В случае если
антикоагулянты противопоказаны, Американское
общество гематологов рекомендует механическую
тромбопрофилактику (например, устройства
пневматической компрессии) [14]. Если в лечении
пациента используется экстракорпоральная
мембранная оксигенация, то препаратом выбора
является нефракционированный гепарин [25].
Повреждение миокарда, не связанное с тромбозом.
Еще одной особенностью COVID-19 является возможное
непосредственное вовлечение сердца в
патологический процесс. ОПМ является одним из
наиболее часто выявляемых сердечно-сосудистых
осложнений COVID-19. Так, согласно данным,
полученным в ходе вспышки COVID-19 в Китае,
лабораторные признаки (повышение уровня маркеров
повреждения миокарда) ОПМ отмечались у 20–30%
госпитализированных пациентов (табл. 1) [16]. В
соответствии с текущим универсальным определением
ИМ, под повреждением миокарда принято понимать
повышение уровня сердечного тропонина по крайней
мере на одно значение выше 99-го перцентиля
верхнего референсного значения (ВРЗ). В случае
если отмечается повышение и/или снижение уровня
тропонина в динамике, то повреждение миокарда
рассматривают как острое [40].
Таблица 1. Обобщенные данные о частоте ОМП
у госпитализированных пациентов с COVID-19

Примечание. Tn I – тропонин I, ВЧ-Tn I –
высокочувствительный тропонин I.
Патогенетические механизмы, лежащие в основе ОПМ,
могут быть различными. К повышению уровня
кардиоспецифических маркеров при COVID-19 могут
приводить миокардит, стресс-кардиомиопатия,
микроваскулярная дисфункция, гипервоспаление и «цитокиновый
шторм», гипоксемия вследствие ОРДС [16, 18].
Повреждение миокарда чаще выявляется у пациентов с
тяжелым течением COVID-19, госпитализированных в
отделения интенсивной терапии [11, 44, 45]. По
имеющимся данным, развитие ОПМ у пациентов с
COVID-19 ухудшает прогноз и является независимым
предиктором летального исхода [11, 13, 44, 46].
При этом в группе наибольшего риска оказываются
пациенты с богатым сердечно-сосудистым анамнезом.
Так, в работе T. Guo и соавт. (2020 г.) показано,
что среди пациентов с COVID-19, у которых ОПМ
развилось на фоне сопутствующих
сердечно-сосудистых заболеваний, отмечается
наиболее высокая смертность, достигающая 69,4%
[11]. Важным клиническим аспектом ОПМ при COVID-19
является высокая частота развития систолической
дисфункции желудочков c развитием в наиболее
тяжелых случаях кардиогенного или смешанного шока,
особенно среди пациентов с яркой клинической
картиной миокардита [46–50]. Для стабилизации
гемодинамики у пациентов с тяжелым
COVID-19-ассоциированным поражением миокарда в
ряде случаев применялись методы механической
циркуляторной поддержки, такие как
внутриаортальная баллонная контрпульсация и
экстракорпоральная мембранная оксигенация [48,
50].
Патогенез поражения сердечно-сосудистой
системы при COVID-19
Точный механизм развития столь широкого спектра
осложнений с вовлечением миокарда и различных
сосудистых территорий в настоящее время не изучен.
По всей видимости, универсальными
патогенетическими звеньями, играющими роль в
большинстве описанных механизмов, ведущих к
развитию сердечно-сосудистых осложнений, могут
выступать поражение возбудителем клеток,
экспрессирующих ангиотензинпревращающий фермент 2
(АПФ 2), и дисфункция эндотелия [16, 17, 22, 51].
Известно, что вирус SARS-CoV-2 инфицирует клетки
посредством связывания с АПФ 2-мембранной
карбоксипепдидазой, широко экспрессированной в
легких, сердце и клетках эндотелия [16]. Показано,
что вирус SARS-CoV-2 может АПФ 2-опосредованно
проникать и напрямую поражать клетки сосудистого
эндотелия в различных сосудистых бассейнах,
вызывая эндотелиит и гибель эндотелиоцитов [52].
Сосудистый эндотелий – это активный паракринный,
эндокринный и аутокринный орган, играющий
важнейшую роль в регуляции сосудистого гомеостаза
и гемостаза [51]. Повреждение эндотелия и
системное воспаление могут приводить к развитию
эндотелиальной дисфункции. В свою очередь,
нарушение функции эндотелия запускает каскад
реакций, в результате которых равновесие
сосудистого гомеостаза смещается в сторону
вазоконстрикции и гиперкоагуляции [17, 20, 51].
Таким образом, эндотелиальная дисфункция и
гипервоспаление, вероятно, могут быть
взаимосвязанными триггерами коагулопатии,
характерной для COVID-19 и приводящей в конечном
итоге к тромботическим осложнениям [17, 19, 20].
Кроме того, гипоксия, характерная для тяжелого
течения COVID-19, также может усугублять
коагулопатию за счет увеличения вязкости крови и
посредством стимуляции тромбообразования через
сигнальный путь гипоксией индуцированного фактора
транскрипции [20, 53]. Механизм развития ОПМ у
пациентов с COVID-19 также не вполне понятен. В
частности, является ли ОПМ следствием прямого
вирусного поражения миокарда или лишь отражает
тяжесть состояния пациента с COVID-19, часто
имеющего такие тяжелые расстройства, как ОРДС и «цитокиновый
шторм»? С одной стороны, T. Guo и соавт. (2020 г.)
показали, что уровень тропонина Т у
госпитализированных пациентов с COVID-19
достоверно коррелирует с уровнем
высокочувствительного С-реактивного белка, что
может говорить в пользу вторичности повышения
уровня кардиоспецифических маркеров, связанного с
нарастанием магнитуды системного воспалительного
ответа [11]. С другой стороны, из ранее
опубликованных работ известно, что у 35% пациентов
с инфекцией, вызванной вирусом SARS-CoV, геном
вируса обнаружен в сердце. Учитывая высокую
степень геномной гомологии между вирусами SARS-CoV
и SARS-CoV-2 и схожий патогенез с участием
молекулы АПФ 2 в качестве функционального
рецептора, обоснованной выглядит гипотеза, что
вирус SARS-CoV-2 также может напрямую поражать
миокард [1, 11, 54]. В пользу такого предположения
может свидетельствовать увеличивающееся число
сообщений о миокардитах с фульмитантным течением у
пациентов с подтвержденным COVID-19, в том числе у
афебрильных пациентов без выраженных респираторных
симптомов [13, 47, 48, 55]. Однако к текущему
моменту нет данных об обнаружении вируса
SARS-CoV-2 в миокарде [16]. При этом результаты
аутопсий пациентов, умерших от COVID-19,
демонстрируют наличие в миокарде воспалительных
инфильтратов, состоящих из макрофагов и в меньшей
степени CD4+ T-клеток [56]. Согласно критериям
Dallas, наличие подобных инфильтратов,
ассоциированных с некрозом кардиомиоцитов,
соответствует миокардиту [17, 57]. Вероятно, в
патогенезе миокардита при COVID-19 может играть
роль поражение миокардиальных перицитов, которые
обильно экспрессируют АПФ 2, являющийся
функциональным рецептором для вируса SARS-CoV-2.
Перициты участвуют в регуляции функции эндотелия в
миокарде и их повреждение приводит к
эндотелиальной дисфункции, нарушению коронарной
микроциркуляции с вторичной ишемией миокарда и
некрозом кардиомиоцитов. Однако данная гипотеза не
отвечает на вопрос, какой патологический процесс в
миокарде первичен – прямое вирусное повреждение
или вторичное воспаление как часть системного
воспалительного ответа [26]. Таким образом,
патогенез поражения сердечно-сосудистой системы
при COVID-19 включает множество взаимосвязанных
звеньев (рис. 2) и в настоящее время до конца не
изучен. Это диктует необходимость дальнейших
исследований для точного понимания патогенеза и
выработки оптимальной терапевтической стратегии.
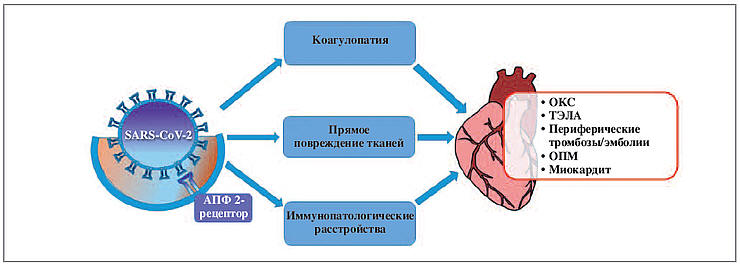
Рис. 2. Ключевые звенья патогенеза
поражения сердечно-сосудистой системы при COVID-19
(пояснения в тексте).
Гастроэнтерологические проявления при
COVID-19
Актуализация изучения гастроэнтерологических
проявлений новой коронавирусной инфекции COVID-19
произошла после детекции РНК SARS-CoV-2 методом
полимеразной цепной реакции в кале у 35-летнего
пациента c этим заболеванием в США [58]. Важно
отметить, что у данного пациента отмечались
симптомы со стороны желудочно-кишечного тракта –
ЖКТ (тошнота, рвота и диарея) [58]. Во время
вспышки тяжелого острого респираторного синдрома (атипичная
пневмония) в 2002–2003 гг. приблизительно у 16–73%
пациентов, инфицированных вирусом SARS-CoV-1,
регистрировалась диарея [59]. Анализируя текущие
многочисленные данные о частоте различных
клинических проявлений COVID-19, можно сделать
заключение, что у ряда больных отмечаются
гастроэнтерологические симптомы, включая диарею,
тошноту/рвоту, а также абдоминальную боль [60].
Помимо этого, у части больных наблюдаются
лабораторные признаки поражения печени (повышение
сывороточных трансаминаз) [60].
Поражение ЖКТ. В крупном исследовании,
проведенном в Китае, которое обобщило клинические
данные о проявлениях новой коронавирусной инфекции
COVID-19 из 552 лечебных учреждений (более 1 тыс.
пациентов), показано, что тошнота и рвота
наблюдались у 5% пациентов, а диарея – у 3,8% [4].
В когорте из 140 пациентов с COVID-19, проживающих
в Ухане, где произошла вспышка инфекции,
переросшая в пандемию, симптомы со стороны ЖКТ
зарегистрированы у 39,6% лиц, включая тошноту
(17,3%), диарею (12,9%) и рвоту (5,0%) [61]. В
других когортах продемонстрировано, что частота
диареи у пациентов с новой коронавирусной
инфекцией COVID-19 варьирует от 2,0 до 10,1%, а
тошноты и рвоты – от 1,0 до 10,1% (табл. 2) [4,
41–43, 45, 61–67]. В педиатрической популяции
больных диарея и рвота наблюдаются в 8,8 и 6,4%
случаев соответственно [64].
Таблица 2. Частота гастроэнтерологических
проявлений COVID-19 в крупных когортах
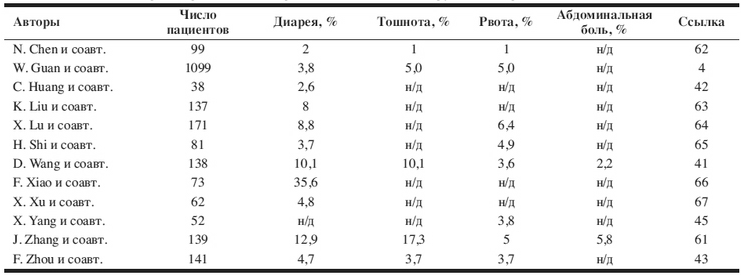
Примечание: н/д – нет данных.
Таким образом, в целом диарея является наиболее
распространенным гастроэнтерологическим
проявлением новой коронавирусной инфекции COVID-19
как у взрослых, так и у детей. Средняя
продолжительность диареи у лиц, инфицированных
SARS-CoV-2, составляет 4,1±2,5 дня. Рвота
несколько чаще наблюдается у детей [68].
Абдоминальная боль и/или дискомфорт реже
описываются в опубликованных работах как
гастроэнтерологические проявления новой
коронавирусной инфекции COVID-19, однако в двух
когортах частота выявления этих жалоб составила
2,2–5,8% [41, 61].
Метаанализ, обобщивший результаты 10 исследований
(1994 пациента), показал, что диарея выявляется у
4,8% инфицированных лиц, тогда как тошнота и рвота
– у 3,9% [69]. В более позднем метаанализе,
обобщившем результаты 29 исследований (более 6
тыс. пациентов), общая частота
гастроэнтерологических жалоб у инфицированных
SARS-CoV-2 лиц составила 15% (95% доверительный
интервал – ДИ 10–21%) [70]. Однако стоит отметить,
что в этой работе помимо тошноты/рвоты, диареи и
абдоминальной боли в качестве жалоб учитывалась
потеря аппетита. Так, частота диареи составила 9%
(95% ДИ 6–12%), тошноты/рвоты – 7% (95% ДИ 5–9%),
потери аппетита – 21% (95% ДИ 9–44%), а
абдоминальной боли – 3% (95% ДИ 2–5%) [70]. У 10%
(95% ДИ 4–19%) пациентов инфекция COVID-19
манифестировала исключительно
гастроэнтерологической симптоматикой без
клинических признаков вовлечения легких [70].
Поражение печени. Помимо описанных
классических гастроэнтерологических симптомов у
ряда пациентов, инфицированных SARS-CoV-2,
наблюдаются лабораторные признаки поражения печени
[71]. Стоит отметить, что повреждение печени
являлось типичным проявлением у пациентов,
инфицированных двумя другими высокопатогенными
коронавирусами – SARS-CoV-1 и MERS-CoV [72]. При
новой коронавирусной инфекции COVID-19
преимущественно поражение печени проявляется
повышением уровня ферментов печени в сыворотке
крови [71]. Так, у 14,8–53,1% в течение
заболевания отмечается повышение
аланинаминотрансферазы, аспартатаминотрансферазы и
общего билирубина [60]. В некоторых выборках у
пациентов с COVID-19 также регистрировались
повышение маркеров холестаза (γ-глютамилтранспептидазы
и
щелочной фосфатазы) и снижение общего
альбумина [71]. Как правило повреждение печени в
легких случаях COVID-19 часто является
транзиентным и регрессирует без какого-либо
специфического лечения. При этом отмечена
корреляция между общей тяжестью состояния пациента
и частотой выявления лабораторных признаков
повреждения печени [72]. В крупнейшем метаанализе
показано, что обобщенная распространенность
нарушений функции печени у пациентов с COVID-19
составила 19% (95% ДИ 9–32%) [70]. Так, повышение
уровня аланинаминотрансферазы наблюдалось у 18%
(95% ДИ 13–25%) пациентов,
аспартатаминотрансферазы – у 21% (95% ДИ 14–29%),
а билирубина – у 6% (95% ДИ 3–13%) [70].
Поражение поджелудочной железы. В одной из
когорт 52 пациентов с COVID-19-ассоциированной
пневмонией у 17% больных отмечались повышенные
сывороточные уровни амилазы и липазы, что
расценено авторами как невыраженное субклиническое
поражение поджелудочной железы [73]. У данных лиц
средний уровень амилазы составил 115±25 Ед/л
(верхний предел нормы – 90 Ед/л), а липазы – 71±34
Ед/л (верхний предел нормы – 70 Ед/л) [73]. Скорее
всего эти находки не релевантны для связи инфекции
COVID-19 с поражением поджелудочной железы,
учитывая, что повышение уровня ферментов этого
органа может наблюдаться при ацидозе, почечной
недостаточности, а также являться следствием
лекарственной терапии (например, при применении
нестероидных противовоспалительных препаратов)
[74]. Вместе с тем в литературе существует еще
одно наблюдение о 3 случаях развития тяжелого
острого панкреатита в одной семье, инфицированной
SARS-CoV-2, при этом другие этиологические причины
острого панкреатита у данных пациентов исключены,
включая употребление алкоголя, билиарную
обструкцию, гипертриглицеридемию, гиперкальциемию
и гипотензию [75].
Прогноз при наличии гастроэнтерологических
проявлений. Релевантность раннего выявления
гастроэнтерологической симптоматики инфекции
COVID-19 подчеркивается сообщениями, что у лиц с
данными проявлениями отмечается худший прогноз
заболевания [76, 77]. В одном из исследований
показано, что частота тяжелых и критических
осложнений инфекции значительно выше у пациентов с
гастроэнтерологическими проявлениями заболевания
[77]. Так, у лиц с такими симптомами отмечается
повышенный риск жизнеугрожающих осложнений [77].
Эти данные подтверждаются результатами метаанализа,
показавшего, что у пациентов с
гастроэнтерологическими проявлениями частота
развития ОРДС значительно увеличена (отношение
шансов 2,96; 95% ДИ 1,17–7,48) [70].
Патогенез поражения ЖКТ и печени при
COVID-19
Результаты исследований вирулентности и
патогенеза коронавирусов – SARS-CoV-1 и MERS-CoV
показали, что они обладают определенным тропизмом
к ЖКТ [78, 79]. В частности, SARS-CoV-1
обнаруживается в образцах кала пациентов, а
электронная микроскопия образцов биопсии
продемонстрировала активную репликацию вируса в
различных отделах кишечника [80]. Данный тропизм
объясняет высокую частоту диареи при инфекционных
заболеваниях, вызванных упомянутыми вирусными
агентами [60]. На сегодняшний день известно, что
геномная последовательность SARS-CoV-2,
вызывающего инфекцию COVID-19, на 82% обладает
сход- ством с SARS-CoV-1 и на 50% – с MERS-CoV
[71].
По всей видимости, как и в случае легочных и
сердечно-сосудистых проявлений COVID-19,
универсальным патогенетическим элементом инфекции,
индуцирующим развитие гастроэнтерологических
проявлений, является способность SARS-CoV-2
взаимодействовать с клетками, экспрессирующими АПФ
2, для последующей инвазии [60, 81, 82]. Этот
механизм вовлечения ЖКТ в патологический процесс
описан на моделях SARS-CoV-1 [60]. Важно отметить,
что существуют данные, что аффинность SARS-CoV-2 к
АПФ 2 в 10–20 раз выше, чем у SARS-CoV-1 [83].
Таким образом, SARS-CoV-2 при взаимодействии с АПФ
2 попадает в цитоплазму клеток макроорганизма,
после чего происходят трансляция полипротеинов и
процессинг репликативного комплекса с последующей
репликацией и транскрипцией вируса [84]. АПФ 2
редко экспрессируется в эпителии слизистой
оболочки пищевода, но широко представлен в
эпителии желудка и различных отделов кишечника
[66, 85]. Более того, нуклеокапсидный белок
SARS-CoV-2 обнаружен методом иммунофлуоресцентной
окраски в цитоплазме эпителиальных клеток желудка,
двенадцатиперстной и прямой кишки [66, 85]. В
целом эти данные могут свидетельствовать о
потенциальном вкладе фекально-орального пути
трансмиссии инфекции COVID-19 [86].
Точный механизм повреждения печени в рамках
инфекции COVID-19 остается неизвестным. Данный
феномен может быть индуцирован прямым вирусным
действием на гепатоциты и холангиоциты,
иммуноопосредованным воспалением («цитокиновый
шторм»), а также гипоксией на фоне тяжелой
пневмонии или полиорганной недостаточности [71,
72]. X. Chai и соавт. (2020 г.)
продемонстрировали, что гепатоциты и холангиоциты
экспрессируют АПФ 2, который вирус SARS-CoV-2
использует в качестве входных ворот в клетку
макроорганизма [87]. Вместе с тем экспрессия АПФ 2
в клетках желчных протоков намного выше, чем у
клеток печени [87]. На сегодняшний день известно,
что эпителиальные клетки желчных протоков играют
важную роль в регенерации печеночной ткани и
иммунном ответе [88]. Эти результаты позволяют
предположить, что повреждение печени у пациентов с
COVID-19 может быть в первую очередь связано с
альтерацией клеток желчных протоков вследствие
прямой вирусной инвазии [72]. Помимо этого, в
генезе повреждения печени при COVID-19 нельзя
исключать факт гепатотоксичности применяемых для
лечения данной инфекции препаратов
(антибактериальные и антивирусные средства,
глюкокортикостероиды и пр.) [71, 89]. Существуют
патоморфологические данные, полученные при анализе
биоптатов печени у лиц, умерших от COVID-19,
свидетельствующие, что у пациентов отмечался
микровезикулярный стеатоз с признаками
невыраженного лобулярного воспаления, характерными
для лекарственно-индуцированного поражения печени
[56].
Механизмы, связанные с поражением поджелудочной
железы, не совсем ясны. Более того, учитывая лишь
ограниченное количество клинических наблюдений,
остается неясным, существует ли такой паттерн
поражения вообще [74, 90]. Вместе с тем
продемонстрировано, что клетки поджелудочной
железы экспрессируют АПФ 2, необходимый для
инвазии вируса SARS-CoV-2 [91]. В настоящий момент
большинство авторов считают, что поражение
поджелудочной железы в рамках инфекции COVID-19
является вторичным и не связано с прямым
цитопатическим действием вируса [74, 90, 92].
Заключение
Новая коронавирусная инфекция COVID-19 в
превалирующем большинстве случаев манифестирует
респираторными симптомами и лихорадкой, однако у
некоторых пациентов могут отмечаться
сердечно-сосудистые и гастроэнтерологические
проявления. Особенностью клинического синдрома
COVID-19 является развитие выраженных
иммунопатологических реакций и нарушений
гемостаза, ведущих к развитию широкого спектра
сердечно-сосудистых осложнений. Течение COVID-19
может осложниться развитием острого ИМ, венозных и
артериальных тромбозов и тромбоэмболий в различных
сосудистых бассейнах, развитием острого
повреждения миокарда и миокардита. Среди
гастроэнтерологических проявлений наиболее часто
выявляются диарея, тошнота или рвота, а также
абдоминальная боль. Точный патогенез описанных
нарушений продолжает изучаться.
Авторы заявляют об отсутствии конфликта
интересов.
Литература / References
1. Zhu N, Zhang D, Wang W, et al.; China Novel
Coronavirus Investigating and Research Team. A
Novel Coronavirus from Patients with Pneumonia in
China, 2019. N Engl J Med. 2020 Feb
20;382(8):727-33. doi: 10.1056/NEJMoa2001017
2. Wu YC, Chen CS, Chan YJ. The outbreak of
COVID-19: An overview. J Chin Med Assoc. 2020
Mar;83(3):217-20. doi:
10.1097/JCMA.0000000000000270
3. Rothan HA, Byrareddy SN. The epidemiology and
pathogenesis of coronavirus disease (COVID-19)
outbreak. J Autoimmun. 2020 May;109:102433. doi:
10.1016/j.jaut.2020.102433
4. Guan WJ, Ni ZY, Hu Y, et al.; China Medical
Treatment Expert Group for Covid-19. Clinical
Characteristics of Coronavirus Disease 2019 in
China. N Engl J Med. 2020 Apr 30;382(18):1708-20.
doi: 10.1056/NEJMoa2002032
5. Lauer SA, Grantz KH, Bi Q, et al. The
Incubation Period of Coronavirus Disease 2019
(COVID-19) From Publicly Reported Confirmed Cases:
Estimation and Application. Ann Intern Med. 2020
May 5;172(9):577-82. doi: 10.7326/M20-0504. PMID:
32150748
6. Wu Z, McGoogan JM. Characteristics of and
Important Lessons From the Coronavirus Disease
2019 (COVID-19) Outbreak in China: Summary of a
Report of 72 314 Cases From the Chinese Center for
Disease Control and Prevention. JAMA. 2020 Feb 24.
doi: 10.1001/jama.2020.2648. PMID: 32091533.
7. Вступительное слово Генерального директора на
пресс-брифинге по COVID-19 11 марта 2020 г. [Opening
address by the Director-General at a COVID-19
press briefing on March 11, 2020. Published online
at WHO.int. (In Russ.)]. ht tps://w ww.who.int/ru/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020
8. Roser M, Ritchie H, Ortiz-Ospina E, Hasell J.
Coronavirus Pandemic (COVID-19). Published online
at OurWorldInData.org. ht tps://ourworldindata.org/coronavirus
9. Rodriguez-Morales AJ, Cardona-Ospina JA,
Gutiérrez-Ocampo E, et al. Clinical, laboratory
and imaging features of COVID-19: A systematic
review and meta-analysis. Travel Med Infect Dis.
2020 Mar-Apr;34:101623. doi:
10.1016/j.tmaid.2020.101623
10. Tay MZ, Poh CM, Rénia L, et al. The trinity of
COVID-19: immunity, inflammation and intervention.
Nat Rev Immunol. 2020 Apr 28:1-12. doi:
10.1038/s41577-020-0311-8
11. Guo T, Fan Y, Chen M, et al. Cardiovascular
Implications of Fatal Outcomes of Patients With
Coronavirus Disease 2019 (COVID-19). JAMA Cardiol.
2020;e201017. doi: 10.1001/jamacardio.2020.1017
12. Bikdeli B, Madhavan M, Jimenez D, et al.
COVID-19 and Thrombotic or Thromboembolic Disease:
Implications for Prevention, Antithrombotic
Therapy, and Follow-up. J Am Coll Cardiol. 2020
Apr 17. doi: 10.1016/j.jacc.2020.04.031
13. Kochi AN, Tagliari AP, Forleo GB, et al.
Cardiac and arrhythmic complications in patients
with COVID-19. J Cardiovasc Electrophysiol.
2020;10.1111/jce.14479. doi: 10.1111/jce.14479
14. Kollias A, Kyriakoulis KG, Dimakakos E, et al.
Thromboembolic Risk and Anticoagulant Therapy in
COVID-19 Patients: Emerging Evidence and Call for
Action. Br J Haematol. 2020 Apr 18. doi:
10.1111/bjh.16727
15. Klok FA, Kruip MJHA, van der Meer NJM, et al.
Incidence of Thrombotic Complications in
Critically Ill ICU Patients With COVID-19. Thromb
Res. 2020 Apr 10;S0049-3848(20)30120-1. doi:
10.1016/j.thromres.2020.04.013
16. Akhmerov A, Marban E. COVID-19 and the Heart.
Circ Res. 2020;10.1161/CIRCRESAHA.120.317055. doi:
10.1161/CIRCRESAHA.120.317055
17. Chapman AR, Bularga A, Mills NL.
High-Sensitivity Cardiac Troponin Can Be An Ally
in the Fight Against COVID-19. Circulation.
2020;10.1161/CIRCULATIONAHA.120.047008. doi:
10.1161/CIRCULATIONAHA.120.047008
18. Panigada M, Bottino N, Tagliabue P, et al.
Hypercoagulability of COVID-19 patients in
Intensive Care Unit. A Report of
Thromboelastography Findings and other Parameters
of Hemostasis. J Thromb Haemost. 2020 Apr 17. doi:
10.1111/jth.14850
19. Zhai Z, Li C, Chen Y, et al. Prevention and
Treatment of Venous Thromboembolism Associated
With Coronavirus Disease 2019 Infection: A
Consensus Statement Before Guidelines. Thromb
Haemost. 2020 Apr 21. doi: 10.1055/s-0040-1710019
20. Tang N, Bai H, Chen X, et al. Anticoagulant
Treatment Is Associated With Decreased Mortality
in Severe Coronavirus Disease 2019 Patients With
Coagulopathy. J Thromb Haemost. 2020
May;18(5):1094-9. doi: 10.1111/jth.14817
21. Marone EM, Rinaldi LF. Upsurge of Deep Venous
Thrombosis in Patients Affected by COVID-19:
Preliminary Data and Possible Explanations. J Vasc
Surg Venous Lymphat Disord. 2020 Apr
17;S2213-333X(20)30214-6. doi:
10.1016/j.jvsv.2020.04.004
22. Lodigiani C, Iapichino G, Carenzo L, et al.;
Humanitas COVID-19 Task Force. Venous and Arterial
Thromboembolic Complications in COVID-19 Patients
Admitted to an Academic Hospital in Milan, Italy.
Thromb Res. 2020 Apr 23;191:9-14. doi:
10.1016/j.thromres.2020.04.024
23. Vulliamy P, Jacob S, Davenport RA. Acute
Aorto-Iliac and Mesenteric Arterial Thromboses as
Presenting Features of COVID-19. Br J Haematol.
2020 Apr 30. doi: 10.1111/bjh.16760
24. Le Berre A, Marteau V, Emmerich J, Zins M.
Concomitant Acute Aortic Thrombosis and Pulmonary
Embolism Complicating COVID-19 Pneumonia. Diagn
Interv Imaging. 2020 Apr 16;101(5):321-2. doi:
10.1016/j.diii.2020.04.003
25. Casini A, Alberio L, Angelillo-Scherrer A, et
al. Thromboprophylaxis and Laboratory Monitoring
for In-Hospital Patients With COVID-19 – A Swiss
Consensus Statement by the Working Party
Hemostasis. Swiss Med Wkly. 2020 Apr
11;150:w20247. doi: 10.4414/smw.2020.20247
26. Bangalore S, Sharma A, Slotwiner A, et al.
ST-Segment Elevation in Patients with Covid-19 – A
Case Series. N Engl J Med. 2020 Apr 17:
NEJMc2009020. doi: 10.1056/NEJMc2009020
27. Никитская Е.А., Марюхнич Е.В., Саввинова П.П.
и др. Вирусы герпеса человека и атеросклероз.
Современный взгляд. Креативная кардиология.
2015;9(2):54-62 [Nikitskaya EA, Maryukhnich EV,
Savvinova PP, et al. Human herpes viruses and
atherosclerosis. Modern look. Creative cardiology.
2015;9(2):54-62 (In Russ.)]. doi:
10.15275/kreatkard.2015.02.05
28. Nikitskaya EA, Grivel JC, Maryukhnich EV, et
al. Cytomegalovirus in Plasma of Acute Coronary
Syndrome Patients. Acta Naturae. 2016
Apr-Jun;8(2):102-7.
29. Nikitskaya E, Lebedeva A, Ivanova O, et al.
Cytomegalovirus-Productive Infection Is Associated
With Acute Coronary Syndrome. J Am Heart Assoc.
2016 Aug 20;5(8):e003759. doi:
10.1161/JAHA.116.003759
30. Воробьева И.И., Рыжкова Е.В., Васильева Е.Ю.,
Шпектор А.В. Влияние системного воспаления на
эффект антиагрегантной терапии у больных с острым
коронарным синдромом. Креативная кардиология,
2012;1:5-14 [Vorobyeva II, Ryzhkova EV, Vasilieva
EYu, Spector AV. The effect of systemic
inflammation on the effect of antiplatelet therapy
in patients with acute coronary syndrome. Creative
Cardiology. 2012;1:5-14 (In Russ.)].
31. Du Y, Tu L, Zhu P, et al. Clinical Features of
85 Fatal Cases of COVID-19 from Wuhan: A
Retrospective Observational Study. Am J Respir
Crit Care Med. 2020;10.1164/rccm.202003-0543OC.
doi: 10.1164/rccm.202003-0543OC
32. Mahmud E, Dauerman HL, Welt FG, et al.
Management of Acute Myocardial Infarction During
the COVID-19 Pandemic. Catheter Cardiovasc Interv.
2020 Apr 20.
33. Jing ZC, Zhu HD, Yan XW, et al.; on behalf of
the COVID-19 & AMI committee of Peking Union
Medical College Hospital, Recommendations from the
Peking Union Medical College Hospital for the
management of acute myocardial infarction during
the COVID-19 outbreak. Eur Heat J. doi: 10.1093/eurheartj/ehaa258
34. Doyen D, Moceri P, Ducreux D, Dellamonica J.
Myocarditis in a patient with COVID-19: a cause of
raised troponin and ECG changes. Lancet. 2020 Apr
23. doi: 10.1016/S0140-6736(20)30912-0
35. Zeng JH, Liu YX, Yuan J, et al. First Case of
COVID-19 Complicated With Fulminant Myocarditis: A
Case Report and Insights. Infection. 2020 Apr 10.
doi: 10.1007/s15010-020-01424-5
36. ESC Guidance for the Diagnosis and Management
of CV Disease during the COVID-19 Pandemic. Last
updated on 21 April 2020. Accessed May 10, 2020.
ht tps://w ww.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance
37. Courand P-Y, Harbaoui B, Bonnet M, Lantelme P.
Spontaneous Coronary Artery Dissection in a
Patient with COVID-19. JACC: Cardiovascular
Interventions. 2020. doi:
10.1016/j.jcin.2020.04.006
38. Cui S, Chen S, Li X, et al. Prevalence of
venous thromboembolism in patients with severe
novel coronavirus pneumonia. J Thromb Haemost.
2020. doi: 10.1111/jth.14830
39. Thachil J, Tang N, Gando S, et al. ISTH
Interim Guidance on Recognition and Management of
Coagulopathy in COVID-19. J Thromb Haemost. 2020
May;18(5):1023-26. doi: 10.1111/jth.14810
40. Thygesen K, Alpert JS, Jaffe AS, et al.;
Executive Group on behalf of the Joint European
Society of Cardiology (ESC)/American College of
Cardiology (ACC)/American Heart Association (AHA)/World
Heart Federation (WHF) Task Force for the
Universal Definition of Myocardial Infarction.
Fourth universal definition of myocardial
infarction (2018). J Am Coll Cardiol. 2018 Oct
30;72(18):2231-64. doi:
10.1016/j.jacc.2018.08.1038
41. Wang D, Hu B, Hu C, et al. Clinical
Characteristics of 138 Hospitalized Patients With
2019 Novel Coronavirus-Infected Pneumonia in Wuhan,
China. JAMA. 2020;e201585. doi:
10.1001/jama.2020.1585
42. Huang C, Wang Y, Li X, et al. Clinical
features of patients infected with 2019 novel
coronavirus in Wuhan, China. Lancet.
2020;395(10223):497-506. doi:
10.1016/S0140-6736(20)30183-5
43. Zhou F, Yu T, Du R, et al. Clinical course and
risk factors for mortality of adult inpatients
with COVID-19 in Wuhan, China: a retrospective
cohort study. Lancet. 2020;395(10229):1054-62. doi:
10.1016/S0140-6736(20)30566-3
44. Shi S, Qin M, Shen B, et al. Association of
Cardiac Injury With Mortality in Hospitalized
Patients With COVID-19 in Wuhan, China. JAMA
Cardiol. 2020;e200950. doi:
10.1001/jamacardio.2020.0950
45. Yang X, Yu Y, Xu J, et al. Clinical course and
outcomes of critically ill patients with
SARS-CoV-2 pneumonia in Wuhan, China: a
single-centered, retrospective, observational.
Lancet Respir Med. 2020. doi:
10.1016/S2213-2600(20)30079-5
46. Ruan Q, Yang K, Wang W, et al. Clinical
predictors of mortality due to COVID-19 based on
an analysis of data of 150 patients from Wuhan,
China. Intensive Care Med. 2020;1-3. doi:
10.1007/s00134-020-05991-x
47. Hu H, Ma F, Wei X, Fang Y. Coronavirus
fulminant myocarditis saved with glucocorticoid
and human immunoglobulin. Eur Heart J.
2020;ehaa190. doi: 10.1093/eurheartj/ehaa190
48. Fried JA, Ramasubbu K, Bhatt R, et al. The
Variety of Cardiovascular Presentations of
COVID-19. Circulation. 2020 Apr 3. doi:
10.1161/CIRCULATIONAHA.120.047164
49. Kim IC, Kim JY, Kim HA, Han S.
COVID-19-related Myocarditis in a 21-year-old
Female Patient. Eur Heart J. 2020 Apr 13; ehaa288.
doi: 10.1093/eurheartj/ehaa288
50. Irabien-Ortiz A. Fulminant myocarditis due to
COVID-19. Rev Esp Cardiol. 2020 Apr 10. doi:
10.1016/j.recesp.2020.04.001
51. Varga Z, Flammer AJ, Steiger P, et al.
Endothelial Cell Infection and Endotheliitis in
COVID-19. Lancet. 2020 Apr 20;395(10234):1417-8.
doi: 10.1016/S0140-6736(20)30937-5
52. Escher R, Breakey N, Lämmle B. Severe COVID-19
Infection Associated With Endothelial Activation.
Thromb Res. 2020 Apr 15;190:62. doi:
10.1016/j.thromres.2020.04.014
53. Gupta N, Zhao YY, Evans CE. The stimulation of
thrombosis by hypoxia. Thromb Res. 2019;181:77-83.
doi: 10.1016/j.thromres.2019.07.013
54. Oudit GY, Kassiri Z, Jiang C, et al.
SARS-coronavirus Modulation of Myocardial ACE2
Expression and Inflammation in Patients With SARS.
Eur J Clin Invest. 2009 Jul;39(7):618-25. doi:
10.1111/j.1365-2362.2009.02153.x
55. Inciardi RM, Lupi L, Zaccone G, et al. Cardiac
Involvement in a Patient With Coronavirus Disease
2019 (COVID-19). JAMA Cardiol.
2020;10.1001/jamacardio.2020.1096. doi:
10.1001/jamacardio.2020.1096
56. Xu Z, Shi L, Wang Y, et al. Pathological
findings of COVID-19 associated with acute
respiratory distress syndrome. Lancet Respir Med.
2020 Apr;8(4):420-2. doi:
10.1016/S2213-2600(20)30076-X
57. Fung G, Luo H, Qiu Y, et al. Myocarditis.
Circulation Research. 2016;118:496-514. doi:
10.1161/CIRCRESAHA.115.306573
58. Holshue ML, DeBolt C, Lindquist S, et al.;
Washington State 2019-nCoV Case Investigation Team.
First Case of 2019 Novel Coronavirus in the United
States. N Engl J Med. 2020 Mar 5;382(10):929-36.
doi: 10.1056/NEJMoa2001191
59. WHO issues consensus document on the
epidemiology of SARS. Wkly Epidemiol Rec. 2003 Oct
24;78(43):373-5.
60. Wong SH, Lui RN, Sung JJ. Covid-19 and the
digestive system. J Gastroenterol Hepatol. 2020
May;35(5):744-8. doi: 10.1111/jgh.15047
61. Zhang JJ, Dong X, Cao YY, et al. Clinical
characteristics of 140 patients infected with
SARS-CoV-2 in Wuhan, China. Allergy. 2020 Feb 19.
doi: 10.1111/all.14238. PMID: 32077115.
62. Chen N, Zhou M, Dong X, et al. Epidemiological
and clinical characteristics of 99 cases of 2019
novel coronavirus pneumonia in Wuhan, China: a
descriptive study. Lancet. 2020 Feb
15;395(10223):507-13. doi:
10.1016/S0140-6736(20)30211-7
63. Liu K, Fang YY, Deng Y, et al. Clinical
characteristics of novel coronavirus cases in
tertiary hospitals in Hubei Province. Chin Med J (Engl).
2020 May 5;133(9):1025-31. doi:
10.1097/CM9.0000000000000744
64. Lu X, Zhang L, Du H, et al.; Chinese Pediatric
Novel Coronavirus Study Team. SARS-CoV-2 Infection
in Children. N Engl J Med. 2020 Apr
23;382(17):1663-5. doi: 10.1056/NEJMc2005073
65. Shi H, Han X, Jiang N, et al. Radiological
findings from 81 patients with COVID-19 pneumonia
in Wuhan, China: a descriptive study. Lancet
Infect Dis. 2020 Apr;20(4):425-34. doi:
10.1016/S1473-3099(20)30086-4
66. Xiao F, Tang M, Zheng X, et al. Evidence for
Gastrointestinal Infection of SARS-CoV-2.
Gastroenterology. 2020 May;158(6):1831-3.e3. doi:
10.1053/j.gastro.2020.02.055
67. Xu XW, Wu XX, Jiang XG, et al. Clinical
findings in a group of patients infected with the
2019 novel coronavirus (SARS-Cov-2) outside of
Wuhan, China: retrospective case series. BMJ. 2020
Feb 19;368:m606. doi: 10.1136/bmj.m606
68. Tian Y, Rong L, Nian W, He Y. Review article:
gastrointestinal features in COVID-19 and the
possibility of faecal transmission. Aliment
Pharmacol Ther. 2020 May;51(9):843-51. doi:
10.1111/apt.15731
69. Li LQ, Huang T, Wang YQ, et al. COVID-19
patients’ clinical characteristics, discharge rate,
and fatality rate of meta-analysis. J Med Virol.
2020;10.1002/jmv.25757. doi: 10.1002/jmv.25757
70. Mao R, Qiu Y, He JS, et al. Manifestations and
prognosis of gastrointestinal and liver
involvement in patients with COVID-19: a
systematic review and meta-analysis. Lancet
Gastroenterol Hepatol. 2020 May 12. doi:
10.1016/S2468-1253(20)30126-6
71. Zhang C, Shi L, Wang FS. Liver injury in
COVID-19: management and challenges. Lancet
Gastroenterol Hepatol. 2020;5(5):428-30. doi:
10.1016/S2468-1253(20)30057-1
72. Xu L, Liu J, Lu M, et al. Liver injury during
highly pathogenic human coronavirus infections.
Liver Int. 2020 May;40(5):998-1004. doi:
10.1111/liv.14435
73. Wang F, Wang H, Fan J, et al. Pancreatic
injury patterns in patients with COVID-19
pneumonia. Gastroenterology. 2020 Apr 1. doi:
10.1053/j.gastro.2020.03.055
74. de-Madaria E, Siau K, Cárdenas-Jaén K.
Increased amylase and lipase in patients with
COVID-19 pneumonia: don´t blame the pancreas just
yet! Gastroenterology. 2020 Apr
21:S0016-5085(20)30561-8. doi:
10.1053/j.gastro.2020.04.044
75. Hadi A, Werge M, Kristiansen KT, et al.
Coronavirus Disease-19 (COVID-19) associated with
severe acute pancreatitis: Case report on three
family members. Pancreatology. 2020 May
5:S1424-3903(20)30147-2. doi:
10.1016/j.pan.2020.04.021. PMID: 32387082.
76. Jin X, Lian JS, Hu JH, et al. Epidemiological,
clinical and virological characteristics of 74
cases of coronavirus-infected disease 2019
(COVID-19) with gastrointestinal symptoms. Gut.
2020 Jun;69(6):1002-9. doi:
10.1136/gutjnl-2020-320926
77. Pan L, Mu M, Yang P, et al. Clinical
Characteristics of COVID-19 Patients With
Digestive Symptoms in Hubei, China: A Descriptive,
Cross-Sectional, Multicenter Study. Am J
Gastroenterol. 2020 May;115(5):766-73. doi:
10.14309/ajg.0000000000000620
78. Hung IF, Cheng VC, Wu AK, et al. Viral loads
in clinical specimens and SARS manifestations.
Emerg Infect Dis. 2004 Sep;10(9):1550-7. doi:
10.3201/eid1009.040058
79. Zhou J, Li C, Zhao G, et al. Human intestinal
tract serves as an alternative infection route for
Middle East respiratory syndrome coronavirus. Sci
Adv. 2017 Nov 15;3(11):eaao4966. doi:
10.1126/sciadv.aao4966
80. Leung WK, To KF, Chan PK, et al. Enteric
involvement of severe acute respiratory
syndrome-associated coronavirus infection.
Gastroenterology. 2003 Oct;125(4):1011-7. doi:
10.1016/s0016-5085(03)01215-0
81. Yan R, Zhang Y, Li Y, et al. Structural basis
for the recognition of SARS-CoV-2 by full-length
human ACE2. Science. 2020 Mar 27;367(6485):1444-8.
doi: 10.1126/science.abb2762
82. Hoffmann M, Kleine-Weber H, Schroeder S, et al.
SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2
and Is Blocked by a Clinically Proven Protease
Inhibitor. Cell. 2020 Apr 16;181(2):271-80.e8. doi:
10.1016/j.cell.2020.02.052
83. Wrapp D, Wang N, Corbett KS, et al. Cryo-EM
structure of the 2019-nCoV spike in the prefusion
conformation. Science. 2020 Mar
13;367(6483):1260-3. doi: 10.1126/science.abb2507
84. Malik YA. Properties of Coronavirus and
SARS-CoV-2. Malays J Pathol. 2020;42(1):3-11.
85. Lee IC, Huo TI, Huang YH. Gastrointestinal and
Liver Manifestations in Patients with COVID-19. J
Chin Med Assoc. 2020. doi:
10.1097/JCMA.0000000000000319
86. Gu J, Han B, Wang J. COVID-19:
Gastrointestinal Manifestations and Potential
Fecal-Oral Transmission. Gastroenterology. 2020
May;158(6):1518-9. doi:
10.1053/j.gastro.2020.02.054
87. Chai X, Hu L, Zhang Y, et al. Specific ACE2
Expression in Cholangiocytes May Cause Liver
Damage After 2019-nCoV Infection. doi:
10.1101/2020.02.03.931766
88. Banales JM, Huebert RC, Karlsen T, et al.
Cholangiocyte pathobiology. Nat Rev Gastroenterol
Hepatol. 2019 May;16(5):269-81. doi:
10.1038/s41575-019-0125-y
89. Feng G, Zheng KI, Yan QQ, et al. COVID-19 and
Liver Dysfunction: Current Insights and Emergent
Therapeutic Strategies. J Clin Transl Hepatol.
2020 Mar 28;8(1):18-24. doi:
10.14218/JCTH.2020.00018
90. Mukherjee R, Smith A, Sutton R.
Covid-19-related pancreatic injury. Br J Surg.
2020 Apr 30. doi: 10.1002/bjs.11645. PMID:
32352160.
91. Liu F, Long X, Zhang B, et al. ACE2 Expression
in Pancreas May Cause Pancreatic Damage After
SARS-CoV-2 Infection. Clin Gastroenterol Hepatol.
2020 Apr 22:S1542-3565(20)30537-1.
92. Patel KP, Patel PA, Vunnam RR, et al.
Gastrointestinal, hepatobiliary, and pancreatic
manifestations of COVID-19. J Clin Virol. 2020 Apr
29;128:104386. doi: 10.1016/j.jcv.2020.104386
Статья опубликована на сайте
http://www.gastroscan.ru
материал MedLinks.ru







