Морфофункциональные особенности и микробиоценоз эзофагогастродуоденальной зоны у больных с постхолецистэктомическим синдромом
Джулай Г.С., Баженов Д.В., Червинец В.М., Михайлова Е.С., Львова М.А.
ГОУ ВПО Тверская государственная медицинская академия Министерства здравоохранения и социального развития России
Резюме
У 80 женщин с ПХЭС в сроки, превышающие один год после ХЭ, изучены эндоскопические и гистологические особенности ЭГДЗ, параметры рН-метрии и ЭГЭГ, качественные и количественные характеристики микробиценоза. При наличии ДГР наиболее закономерно сочетание дистального эзофагита, антрального атрофического гастрита и дуоденита, снижение желудочного кислотообразования, желудочный гипокинез и дуоденальный дискинез, дисбактериоз мукозной микрофлоры с увеличением ее количественного состава, появлением нетипичных для данного биотопа бактерий с выраженными признаками патогенности. Полученные данные необходимы при определении тактики пред- и послеоперационного ведения больных ЖКБ.
Ключевые слова: постхолецистэктомический синдром; эзофагогастродуоденальная зона; морфофункциональные особенности; характеристики микробиоценоза.
Введение
Совершенствование технологий оперативного лечения желчнокаменной болезни (ЖКБ) способствовало расширению показаний к хирургическим вмешательствам и соответственно абсолютному увеличению числа выполняемых холецистэктомий (ХЭ) [5; 46]. Однако, избавляя пациента от осложнений симптомной ЖКБ, ХЭ в любом ее варианте порождает целый каскад иных проблем, обусловленных перестройкой деятельности пищеварительного тракта в новой анатомической реальности.
При этом детально не изучены морфологические, функциональные и клинические характеристики заболеваний и состояний органов пищеварения в отдаленные сроки после оперативных вмешательств, когда включаются механизмы компенсации и адаптации на системном и органном уровне [8].
Различные варианты постхолецистэктомического синдрома (ПХЭС) формируются более чем в половине случаев проведенных ХЭ и имеют преимущественно функциональный характер [3]. Их клиническое своеобразие во многом определяется наличием дуоденогастрального (ДГР) либо дуоденогастроэзофагеального рефлюкса (ДГЭР) и ассоциированных с ним воспалительно-дистрофических изменений эзофагогастродуоденальной зоны (ЭГДЗ) [10; 12; 14], в развитии которых особое значение имеют микробные биоценозы верхних отделов пищеварительного тракта [1; 11; 13].
Целью исследования явилось изучение морфо-функциональных характеристик верхних отделов пищеварительного тракта, а также качественных и количественных параметров микробиоценозов ЭГДЗ у больных с ПХЭС.
Материалы и методы исследования
Обследовано 80 женщин с ПХЭС в возрасте 18–83 лет, перенесших ХЭ по поводу ЖКБ более года назад. У 5% из них диагностирован асимптомный вариант ПХЭС, у 25% — болевой и у 70% — билиарно-диспепсический [3; 4].
Критерием включения в исследование являлось наличие у пациентов клинически и инструментально подтвержденного ПХЭС (ультразвуковое сканирование, магнитно-резонансная томография брюшной полости, при необходимости — ЭРХПГ). Послеоперационный период составил от 1 до 33 лет.
Критерии исключения: язвенная болезнь желудка и состояния после операций на желудке, злокачественные новообразования любой локализации, заболевания, протекающие со стойким снижением трудоспособности (жизнедеятельности) и качества жизни, в частности, сердечно-сосудистой и нервной систем, сахарный диабет тяжелого течения, длительный (более 1 месяца) прием нестероидных противовоспалительных препаратов.
У всех больных комплексно исследованы особенности морфофункционального статуса ЭГДЗ с изучением ее эндоскопических характеристик, микроскопической картины гастробиоптатов, параметров кислотообразования по данным экспресс-рН-метрии на аппарате АГМ-03 (НПП «Исток-Система», г. Фрязино). Моторика желудка и двенадцатиперстной кишки изучалась методом периферической электрогастроэнтерографии (ЭГЭГ) на аппарате «Гастроскан-ГЭМ» с последующей компьютерной обработкой результатов с помощью пакета прикладных программ (НПП «Исток-Система», г. Фрязино).
Микробный пейзаж ЭГДЗ изучался в 111 биоптатах из визуально неизмененных участков слизистой оболочки нижней трети пищевода, антрального отдела желудка и двенадцатиперстной кишки 37 больных с ПХЭС. Стерилизация эндоскопической аппаратуры осуществлялась по методике, рекомендованной фирмой Olympus и исключающей дополнительную контаминацию биоптатов. Контроль на стерильность показал ее абсолютную надежность. Микрофлора выделялась с использованием классических бактериологических методик. Проводилось изучение признаков, ассоциированных с патогенностью: лецитиназной, желатиназной, каталазной (по В.М. Никитину, 1986), казеинолитической (по В.М. Червинцу и соавт., 2004), гемолитической (по В.О. Агаповой, 1999), антилизоцимной (по О.В. Бухарину и соавт., 1984), уреазной (Urease Test Broth BBLÒ, США) активностью микроорганизмов. Цитотоксичность микроорганизмов определяли путем внесения стерильных ультразвуковых фильтратов тестируемых штаммов микробов в объеме 0,2 мл в пробирку с 2-суточной культурой клеток HЕp-2 и инкубации в термостате при 37° С в течение 2–5 суток по методике, применяемой в вирусологии для определения цитопатического действия вирусов на клетки культуры ткани. Степень выраженности цитопатического действия учитывали по изменению характера монослоя в виде отслоения клеток, изменения их морфологии, наличию деструкции.
Для систематизации и анализа полученных результатов была создана электронная база данных. Статистическая обработка проводилась с помощью пакета программ Microsof Office Excel и «Биостатистика» (версия 4.03). Использован однофакторный дисперсионный анализ, критерий χ2. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты исследования и их обсуждение
Исследованиями установлено, что независимо от давности выполненной ХЭ и типа оперативного вмешательства (открытая или лапароскопическая ХЭ) у всех больных в отдаленные сроки после него выявлялись признаки эндоскопически различимых воспалительных изменений в слизистых оболочках пищевода, желудка и двенадцатиперстной кишки. Явления катарального дистального эзофагита на фоне недостаточности кардии отмечены в 27,8% наблюдений, реже (2,5% случаев) имелись единичные линейные эрозии на складках слизистой пищевода. У всех обследованных пациенток имела место картина хронического гастрита. Неатрофический его вариант отмечен в 76,3% наблюдений, причем преобладало одновременное поражение тела и антрального отдела желудка (78,7% наблюдений), изолированное поражение антрального отдела имело место в 21,3% случаев. Атрофические изменения в слизистой оболочке желудка разной степени выраженности зарегистрированы у 47,5% больных, преобладало поражение антрального отдела (60,5%). При эндоскопическом исследовании у 15% пациенток обнаружены единичные (числом 1–5) и множественные (более 5) подслизистые геморрагии в разных отделах желудка, которые в 83,3% случаев не превышали в диаметре 5 мм. В 47,5% наблюдений у больных с ПХЭС имелись эрозии слизистой оболочки желудка, локализовавшиеся главным образом в антруме (65,8% случаев), реже — одновременно в антруме и теле желудка (26,3%). Преобладали «полные» эрозии (31,3%) сравнительно с «неполными» (16,3%), единичные (1–5) имели место в 76,0% случаев, множественные (более 5) — в 24,0%.
Визуально различимый при проведении эндоскопии ДГР или наличие следов желчи в желудке натощак выявлены в 61,3% случаев. Зияние привратника отмечено в половине проведенных эндоскопий.
У 37,5% больных отмечена картина бульбита или дуоденита, в том числе у 20% из них с наличием эрозий и признаков лимфоидной гиперплазии слизистой оболочки. Воспалительный процесс в зоне большого дуоденального сосочка зарегистрирован у 15,0% из них, а его деформация — в 5,0% случаев.
Расчеты индексов качественно-количественной оценки состояния слизистой оболочки желудка [9] у обследованных пациенток продемонстрировали преобладание в общем индексе желудка (22,58 ± 8,01 балла) доли изменений в антральном отделе (11,46 ± 5,50 балла) сравнительно с телом органа (9,90 ± 4,89 балла).
Гистологическое исследование гастробиоптатов из антрального отдела желудка обнаружило преимущественно явления лимфоплазмоцитарной инфильтрации собственной пластинки и эпителия слизистой (88,0%), тогда как инфильтрация нейтрофилами отмечена достаточно редко (3,6% наблюдений). Активность хронического гастрита в 23,8% случаев соответствовала легкой степени, в 76,2% — умеренной. В 50,9% случаев имели место венозное полнокровие и периваскулярный отек в зоне сосудистых образований. В пилорических железах отмечены дистрофические (20,0%) и атрофические (76,9%) изменения. Фовеолярная гиперплазия обнаружена в 30,8% случаев, явления мукоидизации эпителия желез — в 34,5%.
Частота нарушений кислотообразующей функции желудка у обследованных больных представлена в табл. 1 и характеризуется во всех случаях отчетливым снижением кислотной продукции со слабой или отчетливой реакцией железистого аппарата на стимуляцию раствором эуфилина.
Таблица 1. Частота нарушений желудочного кислотообразования у больных с ПХЭС
| Значения рН в теле желудка | Натощак | После стимуляции | ||
| абс. | % | абс. | % | |
| Свыше 5 | 12 | 26,7 | 14 | 31,1 |
| 2,1-5,0 | 22 | 48,9 | 12* | 26,7 |
| 1,2-2,0 | 9 | 20,0 | 15 | 33,3 |
| Ниже 1,2 | 2 | 4,4 | 4 | 8,9 |
Примечание: * — статистически достоверные различия показателей до и после стимуляции по критерию c2 (df = 1).
В 37,8% наблюдений при изучении моторной активности желудка отмечались явления желудочного гипокинеза, в 53,3% — нормокинетическая и в 8,9% — гиперкинетическая активность. При этом у лиц с наличием ДГР выявлено сочетание явлений гастростаза и дуоденального дискинеза с дискоординацией антродуоденальной и дуоденоеюнальной пропульсии (табл. 2).
Таблица 2. Показатели периферической электрогастроэнтерографии у больных с ПХЭС
| Показатели ЭГЭГ | Отделы ЖКТ | Средние значения показателей ЭГЭГ, X ± s | |
| условная норма | больные ПХЭС (n=20) | ||
| Амплитуда А(i)/AS, % | Желудок | — | 26,7 ± 4,01 |
| ДПК | — | 10,1 ± 6,36 | |
| Отношение мощностей P(i)/PS, % | Желудок | 22,4 ± 11,2 | 31,2 ± 1,68 |
| ДПК | 2,1 ± 1,2 | 2,1 ± 0,63 | |
| Коэффициент сравнения P(i)/P(i + 1) | Желудок/ДПК | 10,4 ± 5,7 | 32,3 ± 9,35* |
| ДПК/Тощая | 0,6 ± 0,3 | 0,4 ± 0,12 | |
| Коэффициент ритмичности Kritm | Желудок | 4,85 ± 2,1 | 19,7 ± 5,27* |
| ДПК | 0,9 ± 0,5 | 4,0 ± 1,36* | |
| Среднее число циклов в минуту | Желудок | 2-4 | 2,2 ± 0,1 |
| ДПК | 9-12 | 11,5 ± 0,18 | |
Примечание: использован однофакторный дисперсионный анализ, * — статистически достоверная значимость различий с условной нормой (по данным В.А. Ступина и соавт., 2005).
При микробиологическом исследовании биоптатов было установлено, что микрофлора слизистой оболочки ЭГДЗ здоровых людей немногочисленна как в качественном, так и в количественном отношении. Наиболее часто выделялись стафилококки, стрептококки, лактобациллы, несколько реже — бактероиды, стоматококки, энтеробактерии, коринебактерии, нейссерии, вейлонеллы, H. pylori, находившиеся в составе ассоциаций из 3-8 культур (рис. 1). Количество микроорганизмов, как правило, не превышало 4 lg КОЕ/г и колебалось в пределах 3,46-3,64 lg КОЕ/г. Выделенные из слизистой оболочки ЭГДЗ здоровых людей микроорганизмы имели узкий спектр ферментативной активности (уреаза, гемолизин), а частота ее выявления была невысокой. Цитотоксичности эти бактерии не проявляли.
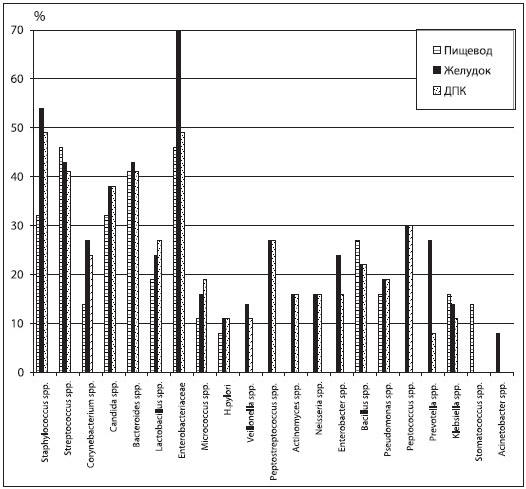
Рис. 1. Спектр и частота встречаемости микроорганизмов слизистых оболочек пищевода, желудка и 12-перстной кишки здоровых людей
У пациентов, перенесших ХЭ, в биоптатах из слизистой оболочки пищевода определялось 13 родов микроорганизмов в виде ассоциаций из 2-8 культур с преобладанием бактерий семейства Enterobacteriaceae и рода Streptococcus (46%), бактероидов (41%), стафилококков и грибов рода Candida (32%) в количестве 2,9-5,4 lg КОЕ/г. H. pylori обнаружен в 8% случаев (рис. 2).
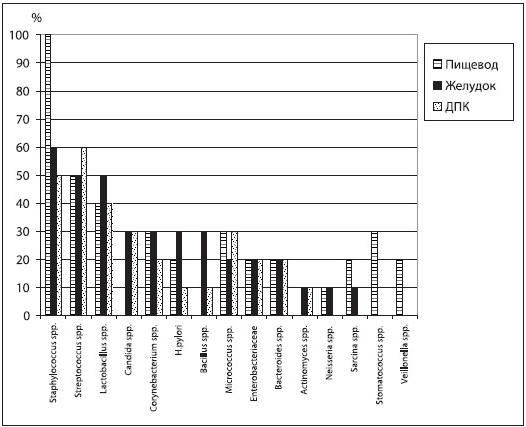
Рис. 2. Спектр и частота выделения микроорганизмов из слизистой оболочки пищевода, желудка и ДПК больных с ПХЭС
В гастробиоптатах больных с ПХЭС количество микроорганизмов колебалось от 3,2 до 5,5 lg КОЕ/г, микробные ассоциации в биоптатах включали 4-6 культур; в 70% наблюдений преобладали грамотрицательные палочки семейства энтеробактерий, в 43% — стрептококки, в 38% — бактероиды и грибы. Н. pylori изолировали у 11% больных с ПХЭС.
В биоптатах из слизистой оболочки двенадцатиперстной кишки у лиц, перенесших ХЭ, микробные ассоциации из 2-7 культур чаще были представлены стафилококками и энтеробактериями (49%), стрептококками и бактероидами (41%), кандидами (38%) в количестве 3,5-5,3 lg КОЕ/г. Рост H. pylori выявляли в 11% наблюдений.
Изучение биохимических свойств выделенной микрофлоры из пораженных участков слизистой оболочки ЭГДЗ выявило высокие показатели признаков, ассоциированных с патогенностью. Так, по сравнению с бактериями, выделенными из слизистой оболочки здоровых людей, в большем числе случаев обнаруживаются гемолитические стафилококки и стрептококки. Обнаружены штаммы бактерий с гемолитической активностью — представители родов: Neisseria, Enterobacter, Pseudomonas, Veillonella, Bacillus, Citrobacter, Serratia, Peptococcus, E.coli, которые у здоровых лиц не определялись, а также бактерии, обладающие лецитиназной активностью (стафилококки, стрептококки, бациллы, коринебактерии, псевдомонады и энтеробактерии), РНК-азной активностью (псевдомонады, стафилококки, стрептококки, энтеробактерии и даже лактобациллы). Казеинолитическая активность отмечалась у псевдомонад, стрептококков, стафилококков и бактероидов. Помимо Н. pylori уреазной активностью обладали пептококки, микрококки, стрептококки, стафилококки, псевдомонады и грибы рода Candida.
Цитотоксические свойства отмечались у большинства микроорганизмов, выделенных из слизистых оболочек ЭГДЗ больных с ПХЭС — H. pylori, стафилококков, стрептококков, пептококков, микрококков, лактобактерий, актиномицетов, псевдомонад, энтеробактерий (цитробактеров, энтеробактеров, серраций, ацинетобактеров, кишечной палочки) и грибов рода Candida. Грамположительная кокковая микрофлора, выделенная из СО пищевода, желудка и 12-перстной кишки у больных с ПХЭС в 85-95% случаев, не обладала антилизоцимной активностью (АЛА).
Адгезивные свойства выявлялись практически у всех исследуемых бактерий. Наибольшие значения среднего показателя адгезии (СПА) — 3-5 бактерий на клетке обнаружены у представителей родов Serratia, Enterobacter, Escherichia, Acinetobacter, Pseudomonas, Staphylococcus. У H. pylori СПА в среднем составлял 1,65.
Вероятно, выпадение резервуарной функции желчного пузыря и соответственно высокая частота ДГР и ДГЭР при зиянии привратника и кардии у больных с ПХЭС в отдаленные сроки после проведенного оперативного вмешательства определяют морфофункциональные особенности ЭГДЗ, а именно высокую частоту воспалительных и дистрофических изменений в слизистых оболочках пищевода, желудка и двенадцатиперстной кишки. Этому могут способствовать сохраняющиеся литогенные свойства желчи и внешнесекреторные нарушения печени [3], а также явления билиарной недостаточности [7].
У больных с ПХЭС при наличии ДГР и ДГЭР наиболее закономерна комбинация явлений дистального эзофагита, атрофического гастрита преимущественно антральной локализации и дуоденита. В функциональном отношении типичны снижение уровня желудочного кислотообразования как натощак, так и после стимуляции, явления желудочного гипокинеза и дуоденального дискинеза с дискоординацией антродуоденальной и дуоденоеюнальной пропульсии.
Гистологическая картина ХГ при ПХЭР имеет ряд особенностей: она отличается невысокой активностью воспалительного процесса в слизистой оболочке желудка, преобладанием дистрофических и атрофических изменений в пилорических железах с фовеолярной гиперплазией и мукоидизацией эпителия.
Выявленные изменения микробиоценоза в слизистых оболочках пищевода, желудка и двенадцатиперстной кишки позволяют утверждать, что речь идет о дисбактериозе, который характеризуется увеличением качественного и количественного состава микрофлоры, появлении нетипичных для данного биотопа бактерий с выраженными признаками патогенности (гемолитической, лецитиназной, РНК-азной, казеино-литической, каталазной, уреазной и цитотоксической активностью). Помимо H. pylori у больных с ПХЭС доминирующая микрофлора в пораженной слизистой оболочке представлена агрессивными штаммами стрептококков, стафилококков, пептококков, псевдомонад, лактобактерий, бацилл, коринебактерий и других условно патогенных и «нормальных» микроорганизмов, которые могут быть причастными к утяжелению патологического процесса. В слизистой оболочке происходит селекция среди бактерий — нормальных обитателей пищеварительного тракта штаммов с повышенным патогенным потенциалом и их усиленным размножением, что согласуется с данными В.М. Бондаренко, В.Г. Петровской (1997), О.В. Бухарина и В.А. Гриценко (2000).
Заключение
В отдаленные после холецистэктомии сроки лечебно-реабилитационные программы помимо коррекции секреторных и моторно-тонических нарушений гастродуоденальной и панкреатобилиарной зон должны предусматривать и коррекцию дисбиозов ЭГДЗ с использованием как эрадикационной терапии, так и комплексов с включением пре-, про- и синбиотиков. Полученные данные необходимо учитывать при определении тактики пред- и послеоперационного ведения больных желчнокаменной болезнью и прогнозировании воспалительных осложнений.
Выводы
- Постхолецистэктомический синдром в основном сопровождается закономерным сочетанием дистального эзофагита, атрофического антрального гастрита и дуоденита, ассоциированных в своем развитии с дуоденогастральным и дуоденогастроэзофагеальным рефлюксом.
- Хронический гастрит при ПХЭР отличается невысокой активностью воспалительного процесса, преобладанием дистрофических и атрофических изменений в пилорических железах с фовеолярной гиперплазией и мукоидизацией эпителия, снижением тощаковой и стимулированной кислой желудочной секреции, желудочным гипокинезом, дуоденальным дискинезом с дискоординацией антродуоденальной и дуоденоеюнальной пропульсии.
- В отдаленные сроки после холецистэктомии формируется дисбактериоз эзофагогастродуоденальной зоны с расширением качественного и количественного состава мукозной микрофлоры, включая появление нетипичных для данного биотопа бактерий с выраженными признаками патогенности (гемолитической, лецитиназной, РНК-азной, казеинолитической, каталазной, уреазной и цитотоксической активностью).
Литература
- Бондаренко В.М., Петровская В.Г. Ранние этапы развития инфекционного процесса и двойственная роль нормальной микрофлоры // Вестн. РАМН. — 1997. — № 3. — С. 7-10.
- Бухарин О.В., Гриценко В.А. Экологическая детерминированность внутривидового разнообразия патогенных бактерий // ЖМЭИ, 2000. -№ 1. — С. 103-106.
- Быстровская Е.В., Ильченко А.А. Постхолецистэктомический синдром: патогенетические и диагностические аспекты проблемы // Эксперим. и клин. гастроэнтерол. — 2009. — № 3. — С. 69-80.
- Ильченко А.А. Болезни желчного пузыря и желчных путей. Руководство для врачей. — М.: Мед. информ. агентство, 2011. — 880 с.
- Калинин А.В. Постхолецистэктомический синдром // Гастроэнтерология и гепатология: Руководство для врачей / Под ред. А.В. Калинина, А.Ф. Логинова, А.И. Хазанова. — 2-е изд. — М.: МЕД-пресс-информ, 2011. — С. 842-853.
- Лазебник Л.Б., Копанева М.И., Ежова Т.Б. Потребность в медицинской помощи после оперативных вмешательств на желудке и желчном пузыре: обзор литературы и собственные данные // Тер. арх, 2004. — № 2. — С. 83-87.
- Максимов, В.А., Чернышев А.Л., Тарасов К.М., Неронов В.А. Билиарная недостаточность — этиология, патогенез, клиника, диагностика, лечение. — М.: АдамантЪ, 2008. — 232 с.
- Саркисов Д.С. (ред.) Структурные основы адаптации и компенсации нарушенных функций: Руководство. — М.: Медицина, 1987. — 448 с.
- Чернин В.В. Болезни пищевода, желудка и двенадцатиперстной кишки: Руководство для врачей. — М.: Мед. информ. агентство, 2010. — 528 с.
- Abdel-Wahab M., Abo-Elenein A., Fathy O. et al. Does cholecystectomy affect antral mucosa? Endoscopic, histopathologic and DNA flow cytometric study // Hepatogastroenterology. — 2000. — Vol. 47, № 33. — P. 621–625
- Hao W.L., Lee Y.K. Microflora of the gastrointestinal tract: a review // Methods Mol. Biol. — 2004. — Vol. 268. — P. 491–502.
- Madura J.A. Primary bile reflux gastritis: diagnosis and surgical treatment // Am. J. Surg. — 2003. — Vol. 186, № 3. — P. 269–273.
- Mukaiya M., Hirata K., Katsuramaki T. et al. Isolated bacteria and susceptibilities to antimicrobial agents in biliary infections // Hepato-gastroenterology. — 2005. — Vol. 52, № 63. — P. 686–690.
- Santarelli L., Gabrielli M., Candelli M. et al. Postcholecystectomy alkaline reactive gastritis: a randomized trial comparing sucralfate versus rabeprazole оr no treatment // Eur. J. Gastroenterol., Hepatol. — 2003. — Vol. 15, № 9. — P. 975–979.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru







