В статье рассмотрены вопросы эффективности и безопасности локальных форм НПВП
Содержание статьи
Введение
В настоящее время в арсенале практикующего врача имеется широкий спектр лекарственных средств для эффективной терапии большинства заболеваний и патологических состояний. Однако успешное использование любого препарата возможно лишь при глубоком понимании его механизма действия, знании фармакологических свойств и возможных нежелательных реакций (НР), а главное — определении основной «точки приложения», т. е. той клинической ситуации, когда использование данного лекарства будет наиболее целесообразным. Важно иметь ясное представление о его терапевтических возможностях, причем источником информации здесь должны выступать не рекламные проспекты фирмы-производителя, а хорошо организованные клинические исследования и систематический анализ применения препарата в реальной клинической практике.
С этой позиции в настоящем обзоре мы предлагаем рассмотреть использование такого популярного класса фармакологических средств, как нестероидные противовоспалительные препараты (НПВП) для топического применения — локальные формы НПВП (ЛФН).
Фокус на ЛФН
Следует отметить, что НПВП являются наиболее востребованными анальгетиками. Механизм их действия связан с блокадой фермента циклооксигеназы 2 (ЦОГ-2) и подавлением синтеза простагландинов — важнейших медиаторов боли и воспаления, что определяет патогенетическое влияние НПВП на развитие и хронизацию боли, вызванной повреждением и воспалением. НПВП с успехом используются для контроля боли при травмах и заболеваниях суставов и позвоночника; это основное средство для купирования головной боли и мигрени, острой висцеральной боли (почечная и печеночная колика) и дисменореи [1]. Однако НПВП имеют принципиальный недостаток — они способны вызывать серьезные НР, в т. ч. угрожающие жизни НР со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы (ССС) и почек. Это существенно ограничивает, а в ряде случаев делает невозможным системное использование НПВП у лиц старших возрастных групп, большинство из которых имеют множественные коморбидные заболевания [1–3]. Так, в российских рекомендациях по рациональному использованию НПВП настоятельно не рекомендуется применять любые препараты этой группы лицам с высоким риском кардиоваскулярных осложнений, в частности больным, перенесшим инфаркт миокарда, ишемический инсульт или имеющим клинически выраженную ишемическую болезнь сердца [4]. Аналогичную позицию занимает Международное общество по изучению остеоартрита (Osteoarthritis Research Society International, OARSI), представившее последнюю редакцию рекомендаций по лечению этого заболевания в 2019 г. Так, эксперты OARSI предлагают исключить использование любых пероральных НПВП у пациентов с коморбидной патологией ССС («НПВП любого класса не рекомендовались пациентам с кардиоваскулярной коморбидностью из-за доказательств повышения риска сердечно-сосудистых заболеваний при использовании НПВП»), а также у немощных больных [5].
Однако в отношении ЛФН таких ограничений нет, поскольку их общее влияние на организм выражено очень слабо. Это связано с низким уровнем резорбции активного вещества из ЛФН в системный кровоток. Именно поэтому ЛФН рекомендуются как средства «первой линии» при лечении наиболее распространенного заболевания суставов — остеоартрита (ОА), которым страдают преимущественно пожилые люди [1, 6]. В упомянутых выше рекомендациях OARSI данная позиция обозначена предельно четко: «Локальные нестероидные противовоспалительные препараты были строго рекомендованы для лиц с ОА коленного сустава (Уровень рекомендаций 1А)» [5].
Лечебный эффект ЛФН связан с действием их активного компонента, подавляющего местное воспаление и препятствующего сенситизации периферических болевых рецепторов [6]. Следует отметить, что кожные покровы являются мощным барьером для любых лекарств. Роговой слой, состоящий из богатых кератином мертвых клеток, встроенных в сложную липидную матрицу, содержащую холестерин, керамиды и свободные жирные кислоты, препятствует проникновению гидрофильных молекул. В свою очередь, подлежащий жизнеспособный эпидермис содержит большое количество воды, что останавливает диффузию липофильных веществ. Поэтому лекарственные формы для накожного нанесения должны сочетать в себе липофильные и гидрофильные свойства, чтобы обеспечить успешное перемещение активной субстанции в подкожную клетчатку и более глубокие структуры. Проникновение действующего вещества к терапевтической мишени обеспечивается особыми биофизическими свойствами мазевой основы ЛФН, выступающей в роли проводника НПВП. Таким действием обладают модифицированные животные, растительные и неорганические масла, диметилсульфоксид, производные акриловой кислоты (карбополы), многоатомные спирты (глицерин, пропиленгликоль, изопропанол), амины (диэтиламин, этаноламин, гидроксиэтилпирролидин и др.), гидрофильные гели модифицированного крахмала, желатина и целлюлозы [7, 8]. В последние годы большой интерес вызывает использование в качестве переносчиков активной субстанции липидных микросфер и трансдермальных патчей, содержащих микроиглы [9, 10].
Тем не менее в медицинской литературе обсуждается достаточно низкая биодоступность активного вещества при использовании ЛФН [6–8]. Например, Х. Hui et al. (1998) [11] провели оценку проникновения диклофенака через кожу при нанесении ЛФН, содержащей 15 мг действующего вещества в 1 мл мази. Препарат наносился на кожу коленного сустава (площадь 20 см2) здоровых добровольцев и оставался на коже в течение 10 ч. В итоге суммарно в плазму крови в среднем попало лишь 6,6% от общего количества препарата, содержащегося в использованной ЛФН.
Весьма интересно сравнение концентрации действующего вещества в плазме крови после использования ЛФН и перорального приема НПВП. Для изучения этого вопроса была проведена серия клинических исследований. Так, J. Kienzler et al. (2010) [12] сравнили системную биодоступность диклофенака при использовании стандартного 1% геля и при пероральном приеме этого препарата. Участниками исследования стали 40 здоровых добровольцев, которые в течение 3 дней наносили гель на область коленного сустава по 4 г 4 р./день (суммарно 16 г) и на кисти рук по 2 г 4 р./день (суммарно 28 г) или принимали диклофенак перорально по 50 мг 3 р./день. Согласно полученным данным средняя концентрация диклофенака в плазме крови после нанесения геля была в 17 раз, а максимальная концентрация (Сmax) диклофенака в плазме крови — в 150 раз меньше, чем при пероральном приеме. В исследовании М. Brunner et al. (2011) [13] проводилось сравнение Сmax диклофенака в плазме крови при использовании ЛФН и при пероральном приеме у 12 здоровых добровольцев. Через 3 дня терапии Сmax диклофенака в плазме крови составила в среднем 4,89 и 1240 мг/мл при использовании ЛФН и пероральном приеме соответственно, т. е. Cmax диклофенака в плазме крови после перорального приема была в 250 раз выше. Показательны данные F. Erdogan et al. (2006) [14], которые оценили концентрацию нимесулида в плазме и синовиальной жидкости коленного сустава у 34 больных, получавших в течение 4–7 дней этот препарат накожно в виде 1% геля или перорально 200 мг/сут. Концентрации нимесулида в синовиальной жидкости и плазме крови составили 9,7±8,6, 11,8±3,0 и 1958,8±397,5, 3631,9±799,3 нг/мл при топическом и пероральном применении соответственно. Аналогичные данные были представлены для ибупрофена: при его пероральном приеме концентрация в плазме была в 300 раз выше, чем при использовании ЛФН; пиковая концентрация при локальном нанесении достигала лишь 2–8% концентрации, достигнутой после приема препарата внутрь [15].
Однако концентрация препарата в тканях непосредственно в области нанесения ЛФН может быть выше, чем при пероральном приеме. Это демонстрирует работа S. Miyatake et al. (2009) [16], которые определили количество диклофенака в мышцах удаленного коленного сустава (операция эндопротезирования) у 14 больных ОА, которые за 12 ч до операции использовали ЛФН с диклофенаком или пероральный диклофенак 37,5 мг. У лиц, применявших ЛФН, концентрация препарата составила в среднем 9,29 нг/мл, у пациентов, принимавших диклофенак перорально, данный показатель составил лишь 0,66 нг/мл (р=0,0196). В приведенном выше исследовании М. Brunner et al. (2011) [13] было показано, что проникновение НПВП в жировую ткань и скелетные мышцы после локального нанесения было в среднем на 324 и 209% выше, чем при пероральном приеме.
Важные данные по этому вопросу были получены в работе M. Dominikus et al. [17]. Авторы сравнили концентрации ибупрофена в различных тканях организма после 3 дней нанесения ЛФН с ибупрофеном (3 р./сут) на кожу в области коленного сустава или перорального приема ибупрофена в дозе 1200 мг/сут. Было показано, что концентрация действующего вещества в синовиальной жидкости в области нанесения ЛФН была сопоставима с таковой при пероральном приеме: 1,3±1,1 и 2,2±1,9 мкг/мл соответственно (p=0,2125). При этом концентрация ибупрофена в мышцах после местного использования была сопоставима с концентрацией ибупрофена в мышцах, которая достигалась при пероральном приеме: 8,4±8,9 и 5,3±3,7 мкг/г соответственно (p=0,4680). На основании полученных данных авторы сделали вывод, что при топическом применении ЛФН с ибупрофеном в месте нанесения препарата достигались тканевые концентрации ибупрофена, сопоставимые с концентрациями, которые регистрировали при пероральном приеме.
Повысить проницаемость кожи позволяет включение в состав ЛФН субстанций, оказывающих местно-раздражающее действие и усиливающих локальный кровоток, таких как этиловый спирт, ментол, камфора, эфирные масла, капсаицин [8]. Так, М. Brunner et al. (2005) [16] сравнили пенетрацию в ткани диклофенака в виде особой трансдермальной системы в комбинации с ментолом или эвкалиптовым маслом и обычного коммерческого препарата, содержащего диклофенак, у 20 здоровых добровольцев. Было показано, что новая трансдермальная система, включающая вещества, повышающие проницаемость кожи, обеспечивала 3–5-кратное увеличение концентрации диклофенака в плазме крови в сравнении с применением обычного геля.
Следует отметить, что при заболеваниях и патологических состояниях, которые являются показанием к применению ЛФН, основные источники боли располагаются достаточно поверхностно и вполне доступны для активной субстанции. При спортивных и бытовых травмах, а также при острой боли в спине это локальные участки повреждения мышечной ткани и связок; при ОА коленного сустава — воспаление в области энтезисов сухожилий и синовиальных сумок [19–21]. Необходимо также отметить, что синовиальная оболочка коленного сустава окружена жировой тканью, что повышает вероятность диффузии НПВП из ЛФН, обладающих липотропными свойствами, в полость сустава [13, 16]. Высока вероятность проникновения активной субстанции ЛФН в мелкие суставы, например кистей или стоп.
Имеются серьезные доказательства эффективности ЛФН при скелетно-мышечных заболеваниях, полученные в ходе хорошо организованных двойных слепых рандомизированных контролируемых исследований (РКИ) [21]. Так, ЛФН зарекомендовали себя как действенное и безопасное средство при ОА коленного сустава. В 2018 г. С. Zeng et al. [22] представили метаанализ 36 РКИ (n=7090), в которых сравнивался терапевтический потенциал ЛФН и плацебо, и 7 наблюдательных исследований, в которых оценивалось действие ЛФН (n=218 074). В большинстве РКИ ЛФН использовались при ОА коленного сустава (n=26). Еще в 7 работах эффект данных препаратов оценивался при множественной локализации поражения, в двух — при ОА коленного и тазобедренного суставов, в одной — при ОА коленного сустава и кистей. Согласно полученным данным активная терапия достоверно превосходила плацебо: величина снижения боли составила -0,30 (95% доверительный интервал [95% ДИ] от -0,40 до -0,20), величина улучшения функции сустава составила -0,35, (95% ДИ от -0,45 до -0,24).
Эти данные подтверждаются метаанализом, выполненным Кохрейновским обществом в 2017 г. [23]. Данная работа включала 39 РКИ (n=10631), в которых локальные средства использовались при различных заболеваниях и патологических состояниях, сопровождавшихся скелетно-мышечной болью. В числе прочих был проведен анализ длительного — от 6 до 12 нед. — применения ЛФН при ОА (13 РКИ, n=5648). Улучшение на 50% и более от исходного уровня в среднем было отмечено у 43–63% больных, получавших ЛФН (в зависимости от различных НПВП, входящих в состав ЛФН), и 23–50% больных, получавших плацебо. Индекс NNT (number need to treat — число больных, которых надо пролечить для получения заданного отличия от плацебо), который характеризует относительную эффективность активной терапии, составлял от 5,0 до 9,8.
Другой областью активного применения ЛФН является лечение острой скелетно-мышечной боли, вызванной различными травмами, такими как растяжение связок, чрезмерное мышечное напряжение или острое воспаление вследствие повреждения элементов опорно-двигательного аппарата [24]. В 2015 г. Кохрейновское общество представило метаанализ 61 РКИ, в которых изучалась эффективность ЛФН при данной патологии. Суммарно 5311 пациентов получали ЛФН, 3470 — плацебо. Согласно полученным результатам ЛФН существенно превосходили плацебо по достижению 50% улучшения. Индекс NNT был различным для отдельных представителей группы НПВП и варьировал от 1,8 (95% ДИ от 1,5 до 2,1) до 3,9 (95% ДИ от 2,7 до 6,7) [25].
Имеются единичные исследования, выполненные зарубежными учеными, в которых изучалась эффективность ЛФН при острой неспецифической боли в спине [26, 27].
Основным достоинством ЛФН, как уже было отмечено, является низкий риск развития системных «класс-специфических» НР со стороны ЖКТ, ССС и почек. Совсем недавно были представлены результаты метаанализа 19 РКИ, в которых оценивалась безопасность ЛФН. Показано, что риск развития каких-либо НР и отмены терапии при использовании этих препаратов достоверно выше в сравнении с плацебо: отношение шансов (ОШ) равнялось 1,16 (95% ДИ от 1,04 до 1,29) и 1,49 (95% ДИ от 1,15 до 1,92) соответственно. Однако подавляющее большинство НР было представлено местными реакциями со стороны кожи и подкожной клетчатки: ОШ 1,12 (95% ДИ от 0,93 до 1,34). При этом частота НР со стороны ЖКТ и ССС на фоне приема ЛФН и плацебо не различалась: ОШ 0,96 (95% ДИ от 0,73 до 1,27) и ОШ 1,21 (95% ДИ от 0,72 до 2,03) соответственно. Частота серьезных НР на фоне использования ЛФН оказалась даже ниже, чем при использовании плацебо, и составила 0,79 (95% ДИ от 0,37 до 1,71) [28].
Одним из наиболее популярных НПВП является ибупрофен — препарат, зарекомендовавший себя как эффективный и достаточно безопасный анальгетик. Хорошая переносимость ибупрофена позволяет использовать его в качестве безрецептурного обезболивающего средства. На основе ибупрофена создано большое число ЛФН, которые уже более четверти века активно используются в клинической практике [15, 29].
Опыт клинических исследований демонстрирует хороший лечебный потенциал ЛФН, содержащих ибупрофен в качестве активного компонента. Так, в упомянутом выше метаанализе С. Zeng et al. (2018) [22] при использовании ЛФН с ибупрофеном при ОА коленного сустава размер эффекта составил -0,68 (95% ДИ от -0,98 до -0,38) относительно купирования боли и -0,74 (95% ДИ от -1,12 до -0,36) относительно улучшения функции сустава соответственно по сравнению с плацебо. Эти значения ставят ЛФН, содержащие ибупрофен, в число наиболее эффективных средств данной группы. По результатам метаанализа Кохрейновского общества, индекс NNT при достижении существенного улучшения или полного купирования боли при использовании ЛФН, содержащих ибупрофен, составляет 3,9 (95% ДИ от 2,7 до 6,7) [23].
Левоментол — компонент, повышающий эффективность ЛФН
Хотя ибупрофен сам по себе является достаточно действенным компонентом ЛФН, тем не менее его сочетание с другими биологически активными субстанциями может повысить эффективность препарата. В этом плане большой интерес представляет гель для наружного применения, содержащий комбинацию ибупрофена и левоментола (препарат Дип Рилиф) [30].
Левоментол представляет собой синтетический левовращающий стереоизомер ментола, или (2S)-(2-пропил)-(5R)-метил-(1R)-циклогексанола, — компонента мятного эфирного масла. Левоментол имеет множест-во биологических эффектов. Он является активатором холодовых кожных рецепторов — катионных каналов с транзиторным рецепторным потенциалом меластатинового подсемейства 8 (Transient Receptor Potential Cation Channel Subfamily M Member 8), поэтому при нанесении на кожу и слизистые вызывает ощущение холода и усиливает микроциркуляцию. Левоментол после локального нанесения оказывает быстрое анальгетическое действие, связываясь с κ-опиоидными рецепторами, блокируя потенциал-зависимые натриевые каналы и рецепторы ГАМКА (γ-аминомасляной кислоты). Кроме того, он имеет определенные антимикробные свойства [31].
Как было отмечено выше, использование левоментола позволяет увеличить проницаемость кожи и повысить биодоступность ибупрофена [8]. При этом собственные обезболивающие свойства левоментола повышают общий анальгетический потенциал комбинированного препарата.
Существуют работы, демонстрирующие преимущество ЛФН, содержащих комбинацию ибупрофена и левоментола, в сравнении с препаратами, содержащими только ибупрофен. В 2019 г. A. Wade et al. [32] опубликовали данные РКИ, в котором сравнивалась эффективность геля, содержащего комбинацию ибупрофена (5%) и левоментола (3%), и гелей, содержащих только ибупрофен или только диклофенак (1,6%), при лечении 182 пациентов с острой спортивной травмой. Комбинированный препарат оказался более эффективным, чем монопрепараты сравнения. В среднем выраженность боли (по 11-балльной числовой рейтинговой шкале) через 2 ч после применения ЛФН, содержащей комбинацию ибупрофена и левоментола, ЛФН, содержащей только ибупрофен, или ЛФН, содержащей только диклофенак, снизилась на 3,373, 2,705 и 2,705 пунктов соответственно по сравнению с исходной. Число больных со значительным улучшением также было выше при использовании комбинированного препарата (рис. 1).
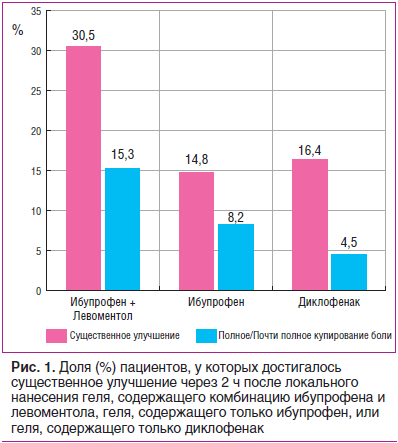
ЛФН на основе комбинации ибупрофена и левоментола хорошо известна в нашей стране и активно используется в клинической практике. Так, О.В. Воробьева и А.С. Лысенко (2018) [33] показали благоприятный эффект применения комбинированного геля ибупрофена и левоментола у 20 пациентов с острой болью в области плеча и шеи. На фоне использования этого средства в течение первых 7–10 дней боль была полностью купирована у 80% пациентов.
В работе Л.Н. Денисова и соавт. (2006) [34] было показано преимущество геля, содержащего ибупрофен и левоментол, в сравнении с ЛФН, содержащей только ибупрофен. Эти препараты использовались 3 р./день на протяжении 2 нед. у 98 больных с ревматоидным артритом и поражением коленного сустава. Анальгетический эффект оказался более выражен у пациентов, получавших комбинацию ибупрофена и левоментола, чем у больных, получавших только ибупрофен. Хорошую и очень хорошую оценку результатам лечения дали 69,6% пациентов, получавших исследуемый препарат, и 44,8% пациентов, применявших препарат сравнения. Было отмечено, что комбинированный препарат начинал действовать статистически значимо (p<0,05) раньше, чем монокомпонентный: в среднем через 11,7 мин против 33,96 мин.
Н.А. Шостак и соавт. (2006) [35] сравнили действие геля, содержащего ибупрофен и левоментол, и геля, содержащего только ибупрофен, у 58 больных с острой/подострой болью в шейном, грудном или поясничном отделе спины. Через 2 нед. снижение интенсивности болевых ощущений на фоне использования первого средства оказалось более выраженным, чем при применении контрольного препарата: в среднем (по 100 мм визуальной аналоговой шкале) с 56,5 до 17,3 мм и с 60,1 до 27,7 мм соответственно.
Заключение
Применение ЛФН является важным компонентом лечения острой и хронической скелетно-мышечной боли. Основным преимуществом этих фармакологических средств следует считать безопасность, что определяется низким уровнем проникновения активной субстанции в системный кровоток. Поэтому ЛФН рекомендуются пациентам с выраженной коморбидной патологией, когда использование пероральных, инъекционных или ректальных форм НПВП невозможно из-за высокого риска системных НР. Эффективность и хорошая переносимость ЛФН доказаны при ОА и травмах мягких тканей в ходе серии хорошо организованных контролируемых исследований. Гель, содержащий комбинацию ибупрофена и левоментола, обладает хорошим анальгетическим и противовоспалительным потенциалом и может широко использоваться при скелетно-мышечной боли различного происхождения.
Информация с rmj.ru


