Лечение ревматоидного артрита базисными противовоспалительными препаратами
Н. В. Чичасова, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Лечение ревматоидного артрита (РА), заболевания с неизвестной этиологией, сложным многокомпонентным патогенезом, чрезвычайной вариабельностью вариантов дебюта и течения, всегда представляло определенные трудности для практикующего врача.
Очевидно, что успех лечения во многом зависит от ранней диагностики и, соответственно, раннего начала патогенетической терапии. Последние классификационные критерии РА облегчают эту задачу, так как, используя их, врач в большинстве случаев может установить диагноз РА в течение первых 3–4 месяцев [1].
Лечение РА ориентировано на подавление активности и прогрессирования заболевания. Для лечения воспалительного процесса используются два вида терапии: 1) симптоматическая терапия нестероидными (НПВП) или глюкокортикоидными (ГК) противовоспалительными препаратами и 2) терапия базисными противовоспалительными препаратами (БПВП). Симптоматические средства способны уменьшить выраженность воспаления в синовиальной оболочке, уменьшить боль и скованность, однако эти препараты не влияют на течение РА.
Лечение синтетическими базисными противовоспалительными препаратами (БПВП) начинают сразу после установления диагноза РА (уровень доказательности 1а, уровень соглашения 9,9 ± 0,4) [2]. При раннем начале лечения (первые 3–6 месяцев) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью [3–6], что по современным представлениям и является основной целью лечения РА [7]. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. При анализе 14 рандомизированных клинических исследований (РКИ) была оценена частота развития эффекта у 1440 больных (1178 получали различные БПВП и 262 — плацебо) при различной длительности РА учитывались демографические факторы (пол, возраст), функциональный класс (ФК) по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник состояния здоровья HAQ (Health Assessment Questionnaire) и др.) [8]. При любой длительности РА различия в частоте развития эффекта между активным лечением и плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА эффективность БПВП снижалась с 52% «ответчиков» (< 1 года) до 35% «ответчиков» (> 10 лет) (табл. 1).
Помимо раннего начала лечения РА БПВП, необходим и жесткий контроль за выраженностью достигнутого эффекта, со своевременной коррекцией терапии. При таком подходе, как это было показано в ряде исследований [9–13], результат лечения лучше, чем при рутинном подходе. Это послужило основанием для формирования концепции современного лечения РА. В последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу «Лечение РА до достижения цели» (в оригинале — инициатива «Treat to target» — Т2Т) [7].
Общие принципы инициативы Т2Т:
А) Лечение ревматоидного артрита следует проводить на основании совместного решения пациента и ревматолога.
Б) Основная цель при лечении больного ревматоидным артритом — обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля клинических проявлений, предотвращения структурного поражения суставов, нормализации функционирования и социальных возможностей пациента.
В) Устранение воспаления — наиболее важный способ достижения этих целей.
Г) Для оптимизации исходов при ревматоидном артрите лечение следует проводить до достижения определенной цели, контролируя активность заболевания и соответствующим образом корригируя терапию.
Первый пункт этих рекомендаций ставит перед врачом задачу обязательного обучения больного для того, чтобы он осознанно участвовал в лечении. Пациенту необходимо разъяснить, что такое хроническое заболевание, какова цель лечения, необходимость длительного многомесячного непрерывного лечения для предотвращения тяжелых исходов и осложнений РА (выраженной деструкции, утраты функции, амилоидоза и пр.).
Основные рекомендации инициативы Т2Т определяют главную цель лечения — достижение клинической ремиссии или, как альтернатива, низкой активности РА, что должно поддерживаться в течение всего периода болезни. Для достижения этой цели больные с умеренной/высокой активностью болезни должны осматриваться ежемесячно, при стабильно низкой активности — реже, раз в 3–6 месяцев, с регистрацией количественных параметров активности и использованием валидированных индексов. Таким образом, врач на каждом визите должен объективно оценить динамику активности болезни. При отсутствии достижения цели (ремиссии или низкой активности, т. е. индекс активности болезни DAS28 > 3,2) через 3 месяца следует принять решение о коррекции терапии. Если врач видит отчетливую стабильно нарастающую тенденцию к улучшению, нет необходимости менять терапию каждые 3 месяца и следует подождать, когда улучшение прекратится и смена терапии станет обоснованной.
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) лечение РА начинают с монотерапии БПВП, а не с комбинации препаратов, и первым БПВП, назначаемым сразу после установки диагноза РА, должен быть Метотрексат (MTX) [2], по рекомендациям ACR (Американская коллегия ревматологов, American College of Rheumatology) первыми БПВП могут быть MTX и лефлуномид (LEF) [14]. Метаанализ 2008 года [15] показал равнозначную эффективность без значительных различий в переносимости и длительности применения между БПВП (MTX, LEF и Сульфасалазин (SSZ)), которые являются препаратами, наиболее часто применяемыми при РА. В настоящее время Сульфасалазин редко используется как первый препарат в лечении РА (при низкой активности серонегативного варианта болезни).
Метотрексат является высокоэффективным препаратом [16, 17], причем его эффект является дозозависимым [18]. Минимальная терапевтическая доза MTX составляет 10 мг/неделю, но при умеренной/высокой активности РА она должна быть увеличена в течение первых месяцев лечения до 15 мг/нед, а далее доза корригируется в зависимости от успеха лечения. Применяется как в таблетированной, так и в парентеральной форме.
И терапевтические эффекты, и токсичность MTX определяются фолатзависимыми механизмами. Подавление активности дигидрофолатредуктазы, ведущее к снижению синтеза ДНК, наблюдается главным образом при назначении очень высоких доз MTX онкологическим больным и составляет основу антипролиферативного действия препарата. При использовании низких доз MTX в ревматологии ингибиция дигидрофолатредуктазы, вероятно, имеет меньшее значение, а клиническая эффективность связана с действием его глутамированных производных. Весьма вероятно, что на фоне лечения низкими дозами MTX именно накопление метаболитов приводит к противовоспалительному и мягкому иммуносупрессивному эффекту. Таким образом, низкие дозы Метотрексата, используемые в лечении РА, приводят к противовоспалительному эффекту, а не к цитотоксическому, что имеет место при использовании высоких доз MTX в лечении опухолей [19].
Препарат обладает быстрым началом действия (в течение 2–3 месяцев) и дозозависимым эффектом [20]. В таблетированной форме препарата назначается 1 раз в неделю по 2,5 мг через 12 часов, вначале в пробных дозах 5 мг и 7,5 мг/нед, далее доза увеличивается до терапевтической. При применении парентеральных форм лечение также начинают с пробной дозы (5–7,5 мг/нед), далее доза может варьировать от 10 до 30 мг/неделю в зависимости от эффективности и переносимости. В контролируемом многомесячном исследовании было выявлено преимущество формы для подкожного введения перед таблетированной: более высокая эффективность при использовании одинаковых доз [21].
Лефлуномид (Арава) является дериватом изоксазола, создан специально для лечения РА, хотя в последние годы он начал использоваться и для лечения псориатической артропатии. Лефлуномид является «пролекарством», в желудочно-кишечном тракте и плазме быстро превращается в активный метаболит — малононитриламид (А77 1726), имеющий, в отличие от лефлуномида, открытое боковое ароматическое кольцо. Именно действием активного метаболита А77 1726 опосредован эффект лефлуномида.
По данным многочисленных экспериментальных исследований основным механизмом действия лефлуномида на активированные клетки является угнетение de novo синтеза пиримидиновых нуклеотидов в поздней G1-фазе клеточного цикла [22]. Предполагают, что лефлуномид действует избирательно на активированные Т-клетки, в то время как преобладающее большинство лимфоцитов находятся в фазе G0 до тех пор, пока не появится потребность в иммунном ответе [23]. Под воздействием метаболита А77 1726 не уменьшается количество клеток и внутриклеточная концентрация белков в угнетенных клетках после 72 часов воздействия метаболита А77 1726 в концентрации 100 мкмоль/л остается такой же, как в клетках в состоянии покоя. Лефлуномид не влияет на фагоцитоз человека. Все вышеперечисленные свойства позволяют рассматривать лефлуномид в большей степени как иммуномодулятор, нежели как иммунодепрессант.
Угнетение Т-клеточного аутоиммунного ответа сопровождается снижением синтеза провоспалительных цитокинов (интерферона-гамма, фактора некроза опухоли-альфа (ФНО-альфа), интерлейкина 6 (IL-6), интерлейкина-бета (IL-бета), простагландина Е2), оксида азота и матриксных металлопротеиназ (ММР-1, ММР-3, ММР-12) в крови и в культуре синовиальной ткани больных РА. Недавно получены данные о противовоспалительном эффекте лефлуномида в отношении культуры моноцитов и макрофагов синовиальной оболочки больных РА: показано уменьшение синтеза провоспалительных цитокинов культурами клеток [24].
Из-за длительной элиминации А77 1726 лечение лефлуномидом рекомендуется начинать с насыщающей дозы 100 мг в течение 3 дней для достижения устойчивой равновесной концентрации препарата в плазме крови. Без насыщающей дозы лекарства для достижения равновесной концентрации А77 1726 потребуется около 2 месяцев. В ходе многочисленных исследований терапевтическая доза определена как 20 мг/сутки (при слабых симптомах непереносимости возможно временное уменьшение дозы до 10 мг/сутки). Выведение препарата осуществляется желудочно-кишечным трактом (48%) и почками (43%). Возраст и пол не оказывают влияние на фармакокинетику А77 1726; однако у больных РА отмечается более высокая плазменная концентрация свободной фракции А77 1726. Метаболизм лекарства происходит быстрее у курильщиков.
Хотя в целом эффективность LEF и MTX равнозначна [15], но клиническая эффективность LEF имеет ряд особенностей.
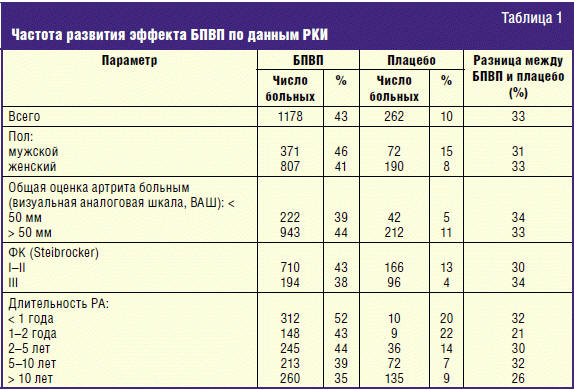
Следует отметить очень быстрое развитие эффекта при применении LEF. Эффект LEF проявляется через 4 недели от начала приема, что продемонстрировано в зарубежных исследованиях (рис. 1) [31] и подтверждено нашим собственным опытом [25–28]. Уже через 1 месяц после начала лечения (табл. 2) отмечается отчетливое уменьшение выраженности суставного синдрома и заметное снижение концентрации С-реактивного белка (СРБ) — практически в 2 раза [28]. Известно, что СРБ является лабораторным тестом, гораздо более тесно коррелирующим с активностью РА, чем СОЭ. При продолжении лечения эффект препарата быстро нарастает в течение первых 4–5 месяцев и продолжает увеличиваться при продолжении лечения до 12 месяцев.
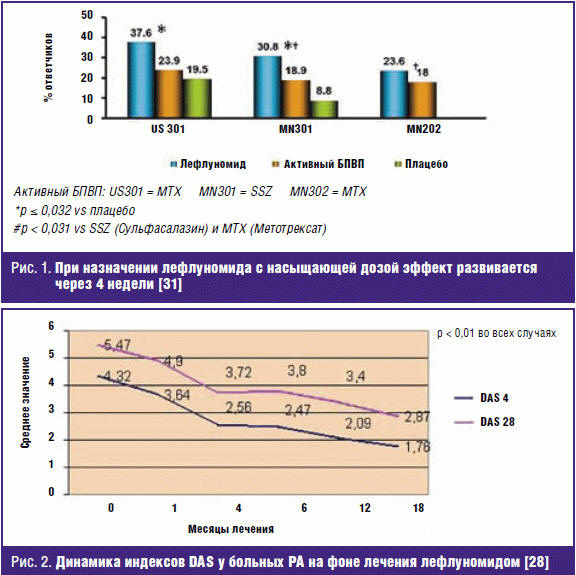

Оценивая динамику индекса активности болезни (Disease activity score, DAS) в различной его модификации — DAS 4, DAS 28 (рис. 2), можно увидеть, что Арава через 6, 12, 18, 24 и 36 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (критерии EULAR). Из рис. 2 видно, что уже через 3–4 месяца средний уровень активности соответствовал низкой.
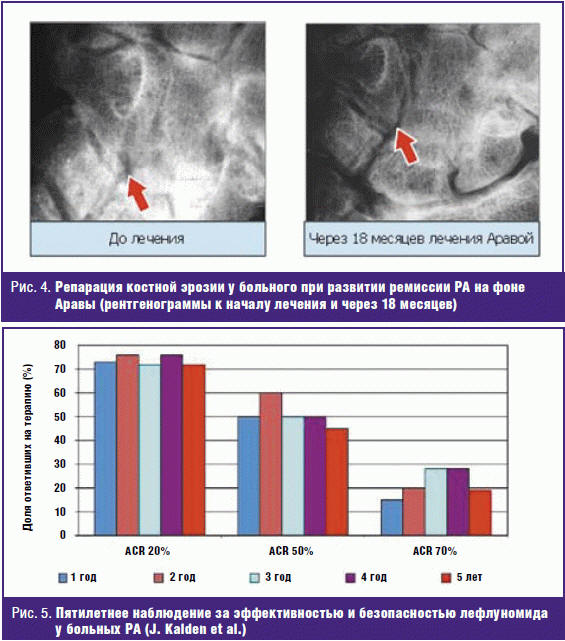
Такое быстрое подавление активности РА при приеме LEF обусловило и еще одну особенность препарата. При сравнении влияния лефлуномида на деструктивный процесс в суставах с базисным действием Метотрексата и Сульфасалазина было показано, что эффект LEF сопоставим с действием Метотрексата, но превышает действие Сульфасалазина [29–31]. По нашим многолетним исследованиям влияния базисных препаратов на темпы деструкции при РА (рис. 3) было показано [32], что только под влиянием LEF выраженное уменьшение числа новых эрозий отмечается уже в первые 6 месяцев лечения. Под влиянием всех других базисных средств, включая Метотрексат, в первое полугодие терапии темп прогрессирования деструктивного артрита значительно не меняется и только к 12 месяцам успешной терапии можно зарегистрировать подавление прогрессирования деструкции в суставах кистей и стоп, а наиболее отчетливое подавление деструкции при приеме различных БПВП можно зарегистрировать только через 18 месяцев успешной терапии. Судя по быстрому снижению концентрации СРБ под влиянием лефлуномида, можно утверждать, что Арава быстрее других базисных средств подавляет ревматоидное воспаление в синовиальной оболочке, что и приводит к ранней остановке прогрессирования деструкции. Впервые нами продемонстрировано заживление костной эрозии у больного с тяжелым РА (исходное число эрозий более 100), на фоне ремиссии отмечено заживление эрозии в крючковидной кости левого запястья через 18 месяцев приема LEF (рис. 4) [33].
Лефлуномид возможно применять в длительные сроки (в исследованиях до 5 лет) без развития вторичной неэффективности (рис. 5), что очень важно с учетом хронического характера течения РА [34, 35].
Основной отдаленной целью терапии при РА является сохранение функциональной способности больного, предупреждение развития инвалидности. Поэтому особый интерес представляет влияние терапии лефлуномидом на функциональное состояние больных, оцениваемое по стандартным тестам (HAQ, SF-36): уже через 6 месяцев только у 10% больных средний балл индекса HAQ-DI составлял 1,6–2,1; а средний балл 0,5 (то есть практически полное отсутствие функциональной недостаточности) отмечалось у 54% больных [36]. При оценке качества жизни больных РА по тесту SF-36 уже через 6 месяцев достигнуто достоверное улучшение по 5 из 8 доменов (данные Института ревматологии РАМН). Сравнение влияния на качество жизни лефлуномида и Метотрексата за 1–2 года терапии было продемонстрировано преимущество лефлуномида с достоверным улучшением по 3 из 8 доменов (телесная боль, жизнеспособность и ролевое эмоциональное функционирование) (рис. 6) [37]. Как видно из рисунка, при приеме LEF в ряде доменов качество жизни пациентов приблизилось к популяционной норме.

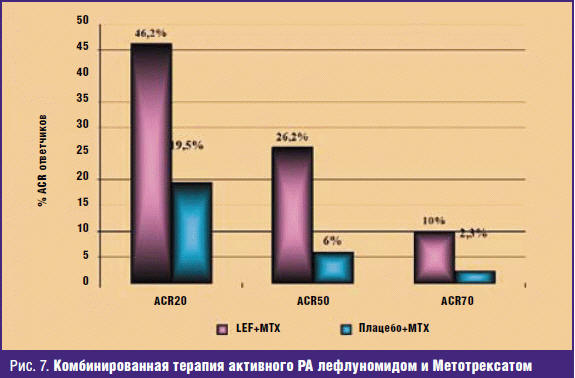
Еще одним аспектом использования лефлуномида при РА является комбинация препарата с другими БПВП. При недостаточности эффекта базисного средства такой подход обеспечивает оптимизацию терапии. В опубликованном в 2005 году исследовании были оценены возможности Аравы при комбинированном базисном лечении. Арава была назначена 968 больным РА, из которых у 672 развился клинический эффект. Остальные больные при недостаточности эффекта по критериям DAS28 были разделены на две группы: 1-я группа больных получала лефлуномид в комбинации с Сульфасалазином, 2-я группа — Сульфасалазин и плацебо. Через 24 недели зарегистрировано достоверно более выраженное снижение активности при комбинации базисных средств по сравнению с монотерапией Сульфасалазином [38]. В другом исследовании продемонстрирован достоверно более выраженный эффект комбинации лефлуномида (10–20 мг/сут) и Метотрексата (10–20 мг/нед) по сравнению с монотерапией Метотрексатом (рис. 7) [39]. Возможно использование LEF и в комбинации с генно-инженерными биологическими препаратами: адалимумабом, тоцилизумабом и абатацептом. Менее желательно комбинировать LEF с инфликсимабом, хотя имеются сообщений об удачном использовании и этой комбинации [40].
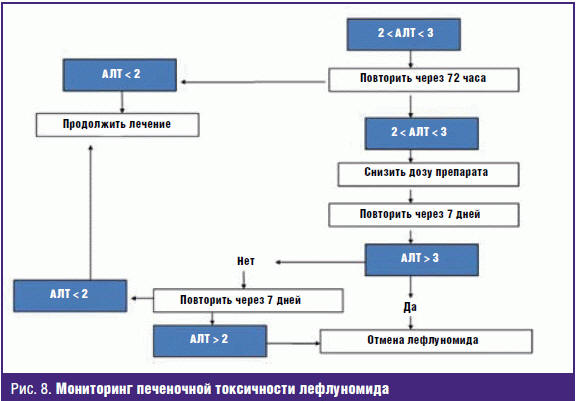
Отмечается хорошая переносимость лефлуномида в сроки лечения до 2–3 лет, как по данным отечественных, так и зарубежных авторов [31, 41]. Среди наших 50 больных лефлуномид был отменен из-за диареи в 1 случае и из-за кожного зуда у 6 больных, причем отмена препарата вследствие непереносимости потребовалась только у лиц старше 50 лет [28]. У половины больных, получавших LEF, в первые месяцы лечения отмечается повышенное выпадение волос, не потребовавшее отмены лечения. Примерно у 10% больных при назначении LEF может появиться артериальная гипертензия (или измениться течение существовавшей артериальной гипертензии), что требует мониторирования артериального давления и коррекции антигипертензивной терапии. Повышение печеночных ферментов отмечается реже, чем при приеме MTX, однако необходим регулярный мониторинг за уровнем аспартатаминотрансферазы и аланинаминотрансферазы (рис. 8). Развитие инфекционных заболеваний требует перерыва в лечении Аравой до купирования инфекции, далее можно продолжать лечение в обычной суточной дозе. Частота развития реакций непереносимости в контролируемых исследованиях лефлуномида показала, что переносимость лефлуномида не уступает переносимости Метотрексата [30, 35, 42].
Таким образом, лефлуномид является активным базисным противовоспалительным препаратом более чем у 90% больных РА. Препарат отличается быстрым развитием эффекта как в отношении параметров активности РА, так и в отношении прогрессирования деструкции, что приводит к стойкому улучшению функции опорно-двигательного аппарата и улучшения качества жизни больных. Побочные реакции на фоне лефлуномида развиваются редко и в большинстве случаев не ведут к его отмене.
Литература
- Aletaha D., Neogi T., Silman A. J. et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative // Ann. Rheum. Dis. 2010, 69: 1580–1588.
- Smolen J. S., Landeve R., Breedveld F. C. et al. EULAR recommendation for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs // Ann. Rheum. Dis. 2010, 69: 964–975.
- Emery P., Breedveld F. C., Hall S. et al. Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomized, double-blind, parallel treatment trial // Lancet. 2008, 372: 375–382.
- Nandi P., Kingsley G. H., Scott D. L. Disease-modifying antirheumatic drugs other than methotrexate in rheumatoid arthritis and seronegative arthritis // Curr. Opin. Rheumatol. 2008, 20: 251–256.
- Plosker G. L., Croom K. F. Sulphasalazine: a review of its use in the management of rheumatoid arthritis // Drugs. 2005, 65: 1825–1849.
- Dougados M., Emery P., Lemmel E. M. et al. Efficacy and safety of leflunomide and predisposing factors for treatment response in patients with active rheumatoid arthritis: RELIF 6-month data // J. Rheum. 2003, 30: 2672–2579.
- Smolen J. S., Aletha D., Bijsma J. W. J. et al. Treating rheumatoid arthritis to target: recommendations of an international task force // Ann. Rheum. Dis. 2010, 69: 631–637.
- Lard L. R., Visser H., Speyer I. et al. Early versus delayed treatment un patients with recent-onset rheumatoid arthritis: comparison of two cohorts who received different treatment strategies // Amer. J. Med. 2001, V. 111: 446–451.
- Grigor C., Capell H., Stirling A. et al. Effect of treatment strategy of tight control of rheumatoid arthritis (the TIСORA study): a single-blind randomised controlled trial // Lancet. 2004, 364: 263–269.
- Korpela M., Laansonen L., Hannonen P. et al. Retardation of joint damage in patients with early rheumatoid arthritis by initial aggressive treatment with disease-modifying antirheumatic drugs: five-year experience from FIN-RACo study // Arthr. Rheum. 2004, 50: 2072–2081.
- Goekoop-Ruiterman Y. P., de Vries-Bouwstra J. K., Allaart C. F. et al. Comparison of treatment strategies in early rheumatoid arthritis: a randomized trial // Ann. Intern. Med. 2007, 146: 406–415.
- Verstappen S. M. M., Jacobs J. W., van der Veen M. J. et al. Intensive treatment with methotrexate in early rheumatoid arthritis: aiming for remission. Computer Assisted Management in Early Rheumatoid Arthritis (CAMERA, an open-label strategy trial) // Ann. Rheum. Dis. 2007, 66: 1443–1449.
- Bakker M. F., Jacobs W. C., Welsing P. M. J. et al. Early clinical response to treatment predict 5-year outcome in RA patients: follow-up results from the CAMERA st4 // Ann. Rheum. Dis. 2011, 70: 1099–1103.
- Saag K. G., Teng G. G., Patkar N. M. et al. American College of Rheumatology 2008 Recommendations for the Use of Nonbiologic and Biologic Disease-Modifying Antirheumatic Drugs in Rheumatoid Arthritis // Arthr. Care and Res. 2008, 59: 762–784.
- Donanue K. E., Gartlenhar G., Jonas D. E. et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis // Ann. Int. Med. 2008, 148: 124–134.
- Weinblatt M. E. Efficacy of methotrexate in rheumatoid arthritis // Br. J. Rheum. 1995, 34 (Suppl. 2): 43–48.
- Visser K., van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature // Ann. Rheum. Dis. 2009, 68: 1094–1099.
- Pincus T., Yazici Y., Sokka T. et al. Methotrexate as the anchor drug. for the treatment of early rheumatoid arthritis // Clin. Exp. Rheum. 2003, 21 (Supl. 31): S178–185.
- Chan E. S. L., Cronstein B. N. Molecular action of methotrexate in inflammatory diseases // Arthr. Res. 2002, 4: 266–273.
- Aletaha D., Smolen J. S. Effectiveness profiles and dose dependent retention of traditional disease modifying antirheumatic drugs for rheumatoid arthritis. An observational study // J. Rheum. 2022, 29: 1631–1638.
- Braun J., Kastner P., Flaxenberg P. et al. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis // Arthr. Rheum. 2008, 58: 73–81.
- Silva H. T., Morris Jr. E. Leflunomide and malononitroamides // Exp. Opin. Invest Drugs. 1997, 6, 51–64.
- Ruckemann K., Fairbanks L., Carrey E. et al. Leflunomide inhibits pyrimidine de novo synthesis in mitogen-stimulated T-lymphocytes from healthy humans // J Biol. Chem. 1998; 273: 21682–21691.
- Cuoto M., Sulli A., Ghiorzo P. et al. Anti-inflammatory effects of leflunomide on cultured synovial macrophages from patients with rheumatoid arthritis // Ann Rheum Dis. 2003; 62: 297–302.
- Cohen S., Weaver A., Schiff M., Strand V. Two-year treatment of active RA with leflunomide compared with placebo or methotrexate // Arthritis rheum. 1999; 159: 2542–2550.
- Strand V., Cohen S., Shiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch Inter Med. 1999; 2542–2550.
- Emery P., Breedveld F. C., Lemmel E. M. et al. A comparation of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology (Oxford). 2000; 39: 655–665.
- Чичасова Н. В., Бродецкая К. А., Иголкина Е. В. и др. 18-месячное применение лефлуномида — клиническая эффективность, переносимость и влияние на прогрессирование эрозивного артрита у больных РА // Научно-практическая ревматология. 2004, № 2. Тезисы «Школы молодых ревматологов. № 11, с. 124.
- Smolen J. S., Kalden J. R., Scott D. L., Rozman B., Kvien T. K., Larsen A. et al. Sulphasalasine in active rheumatoid arthritis: a double-blind, randomized, multicenter trial. European Leflunomide Study Group // Lancet. 1999; 353: 259–266.
- Emery P., Breedveld F. C., Lemmel E. M. et al. A comparation of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology (Oxford). 2000; 39: 655–665.
- Osiri M., Shea B., Robinson V. et al. Leflunomide for the treatment of RA: A systematic review and metaanalysis // J. Rheumatology. 2003: 30: 6.
- Чичасова Н. В., Чижова К. А., Иголкина Е. В. и др. Новый базисный препарат для лечения ревматоидного артрита — Арава (лефлуномид): опыт многомесячного применения // РМЖ. 2004, т. 12, 2 (202), с. 124–128.
- Chichasova N., Brodetskaya K., Igolkina E. et al. Leflunomide for the treatment of rheumatoid arthritis during 18 months: the clinical efficacy, safety and influence on radiological progression // Annals of Rheumatic Diseases. 2004, vol. 673, Suppl. 1, p. 530 (AB0062).
- Scott D. L., Smolen J. S., Kalden J. R. et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double-blind, placebo-controlled trial versus sulfasalasine // Ann Rheum Dis. 2001; 60: 913–923.
- Kalden J. R., Schattenkirchner M., Sorensen H., Emery P., Deighton C., Rozman B., Bredveld F. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five-year follow-up // Arthritis Rheum. 2003; 48: 1513–1520.
- Strand V., Cohen S., Shiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate // Arch Inter Med. 1999; 159: 2542–2550.
- Strand V., Scott D. L., Emery P. et al. Physical function and health related quality of life analysis of 2-year data from randomized, controlled studies of leflunomude, sulfasalazine, or methotrexate in patients with active rheumatoid arthritis // J. Rheum. 2005, 32: 590–601.
- Dougados M., Emery P., Lemmel E. M. et al. When a DMARD fails, shoud patients switch to sulfasalazine or add sulfasalazine to continuing leflunomide? // Ann. Rheum. Dis. 2005, 64: 44–51.
- Kremer J. M., Genovese M. C., Cannon G. W. et al. Combination leflunomide and methotrexate (MTX) therapy for patients with active rheumatoid arthritis failing MTX monotherapy: open-label extension of a randomized, double-blind, placebo controlled trial // J. Rheum. 2004, v. 31: 1521–1531.
- Hansen K. E., Cush J., Singhal A. et al. Safety and efficacy of leflunomide in combination with infliximab in rheumatoid arthritis // Arthr. Rheum. 2004, v. 51: 228–232.
- Чичасова Н. В., Насонов Е. Л. Лефлуномид в лечении ревматических заболеваний. М.: МегаПро, 2010, 110 с.
- Smolen J. S., Kalden J. R., Scott D. L., Rozman B., Kvien T. K., Larsen A. et al. Efficacy and safety of leflunomide compared with placebo and sulphasalasine in active rheumatoid arthritis: a double-blind, randomized, multicenter trial. European Leflunomide Study Group // Lancet. 1999; 353: 259–266.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





