ИСПОЛЬЗОВАНИЕ МЕТОДА ТФЭ ДЛЯ ЭКСТРАКЦИИ ПРОИЗВОДНОГО 3-ГИДРОКСИ-3-ПИРРОЛИН-2-ОНА ИЗ ПЛАЗМЫ КРОВИ
Научная статья
Булгакова Е.А.1, *, Карпенко Ю.Н.2
1, 2 Пермская государственная фармацевтическая академия, Пермь, Россия
* Корреспондирующий автор (bulgakova_pfa[at]mail.ru)
Аннотация
Высокий рост заболеваний, связанных с нарушениями основных когнитивных функций, обуславливает необходимость поиска и внедрения в медицинскую практику новых и эффективных ноотропных препаратов.
Синтезированное в Пермской государственной фармацевтической академии биологически активное соединение 1-аминокарбонилметил-4-ацетил-5-(4-бромфенил)-3-гидрокси-3-пирролин-2-он было рекомендовано для доклинических исследований как потенциальное ноотропное средство.
В настоящее время широкое применение в практике доклинических исследований для изолирования лекарственных препаратов из биологических жидкостей находит метод твердофазной экстракции (ТФЭ), позволяющий сочетать изолирование и очистку от соэкстрактивных веществ биологической матрицы.
Ключевые слова: твердофазная экстракция, высокоэффективная жидкостная хроматография, валидация биоаналитических методик.
USE OF SFE METHOD FOR THE EXTRACTION OF A DERIVANT OF 3-HYDROXY-3-PYRROLIN-2-ONE FROM BLOOD PLASMA
Research article
Bulgakova E.A.1, *, Karpenko Yu.N.2
1, 2 Perm State Pharmaceutical Academy, Perm, Russia
* Corresponding author (bulgakova_pfa[at]mail.ru)
Abstract
The high growth of diseases associated with impaired basic cognitive functions necessitates the search and implementation of new and effective nootropic drugs in medical practice.
The biologically active compound of 1-aminocarbonylmethy-4-acetyl-5-(4-bromophenyl)-3-hydroxy-3-pyrrolin-2-one synthesized at the Perm State Pharmaceutical Academy was recommended for preclinical studies as a potential nootropic agent.
Currently, the practice of preclinical studies for the isolation of drugs from biological fluids is widely used in solid-phase extraction (SPE), which allows one to combine isolation and purification from coextracting substances of the biological matrix.
Keywords: solid-phase extraction, high-performance liquid chromatography, validation of bioanalytical methods.
В современном мире существенно возросла проблема, связанная с увеличением числа заболеваний и пограничных состояний, которые сопровождаются нарушением функций мозга. Для ее решения требуется разработка и внедрение в медицинскую практику новых и эффективных ноотропных препаратов.
В настоящее время на этапе доклинических исследований в качестве потенциального ноотропа находится соединение КОН-2 (1-аминокарбонилметил-4-ацетил-5-(4-бромфенил)-3-гидрокси-3-пирролин-2-он (5), синтезированное в Пермской государственной фармацевтической академии под руководством профессора Гейна В.Л. [3].
При проведении фармакокинетических исследований важной задачей является разработка методик определения лекарств в биологических жидкостях и тканях. Для изолирования лекарственных препаратов из биологических жидкостей широкое применение находит метод твердофазной экстракции (ТФЭ) [6], [7]. Данный способ пробоподготовки сочетает в себе не только извлечение анализируемого вещества, но и очистку от соэкстрактивных веществ, что позволяет получать высокоочищенные пробы, пригодные для анализа методом высокоэффективной жидкостной хроматографии [1], [8].
Целью данной работы явилась разработка и валидация методики изолирования КОН-2 из плазмы крови методом ТФЭ.
Изучение условий изолирования КОН-2 методом твердофазной экстракции проводили на картриджах для твердофазной экстракции Strata C18-E (Phenomenex). Данные патроны упакованы сорбентом на основе силикагеля с привитой обращенной фазой С18. Пробоподготовку осуществляли на установке для твердофазной экстракции с вакуумной камерой на 10 позиций VACMASTER.
Анализ полученных извлечений проводили на жидкостном хроматографе «Shimadzu LC-20», снабженным колонкой с обращено-фазным сорбентом и спектрофотометрическим детектором (диодная матрица).
При разработке методики учитывались следующие факторы: условия подготовки патрона (кондиционирование, удаление соэкстрактивных веществ плазмы), состав элюента и условия элюирования целевого компонента.
Предварительно были изучены условия твердофазной экстракции КОН-2 из водных растворов. Для этого были проанализированы водные растворы КОН-2 с концентрацией 5 мкг/мл.
Пробоподготовка включала следующие стадии: кондиционирование патрона; загрузка анализируемого образца; промывка патрона от соэкстрактивных веществ; элюирование анализируемого вещества.
На этапе кондиционирования через патрон последовательно со скоростью 1 мл/мин пропускали 1 мл метанола и 1 мл воды. Далее загружали 1 мл водного раствора КОН-2 с концентрацией 5 мкг/мл. Для промывки патрона использовали 10% раствор метанола (1 мл) и воду (1 мл). В качестве элюентов были апробированы метанол и ацетонитрил. Элюирование осуществляли двумя порциями растворителя – 1 и 0,5 мл. Результаты анализа полученных элюатов отражены в таблице 1.
Таблица 1 – Содержание КОН-2 в элюатах при ТФЭ на патронах StrataC18-E
| Элюент | Степень извлечения КОН-2 из водного раствора, % (n=6) | |
| Метанол | 1,0 мл | 23,37 ± 1,26 |
| 0,5 мл | 3,72 ± 0,78 | |
| Ацетонитрил | 1,0 мл | 26,81 ± 0,74 |
| 0,5 мл | – | |
Установлено, что 1 мл растворителя недостаточно для полного элюирования КОН-2 метанолом, и более 3% аналита обнаруживается после повторного элюирования 0,5 мл растворителя.
Также были проанализированы фракции, полученные на этапе промывки 10% метанолом и водой. Установлено, что значительная часть КОН-2 (более 20%) теряется на данной стадии. Результаты представлены в таблице 2.
Таблица 2 – Содержание КОН-2 в «промывочных» фракциях
| «Промывочные» фракции | Содержание КОН-2, % (n=6) |
| 10% раствор метанола | 23,37 |
| Вода дистиллированная | 3,72 |
Чтобы снизить потери аналита на этапе промывки патрон после загрузки образца промывали 0,01М раствором кислоты хлористоводородной и водой дистиллированной. Использование кислоты привело к лучшей сорбции КОН-2 на сорбенте (за счет перехода вещества в молекулярную форму) и отсутствию анализируемого вещества в «промывочных» фракциях.
Для увеличения выхода КОН-2 на этапе элюирования нами были апробированы метанол и ацетонитрил, подщелоченные аммиаком водным до рН 10, с целью переведения вещества в ионизированное состояние. В случае использования подщелоченного метанола степень экстракции КОН-2 возросла до 74%.
Данные условия были апробированы на модельных смесях плазмы крови с концентрацией КОН-2 5 мкг/мл. Установлено, что использование на этапе промывки патрона от соэкстрактивных веществ 0,01М раствора кислоты хлористоводородной и воды дистиллированной, и элюирование метанолом, подщелоченным аммиаком водным до рН 10 позволило извлечь более 62 % аналита.
Таким образом, на основании проведенных исследований нами предложена следующая схема изолирования КОН-2 из плазмы крови методом твердофазной экстракции:
- Кондиционирование патрона путем последовательного промывания 1 мл метанола и 1 мл воды очищенной.
- Загрузка патрона 1 мл плазмы.
- Промывка патрона с целью удаления белков и других эндогенных компонентов плазмы 1 мл 0,01 М раствора кислоты хлористоводородной и 1 мл воды очищенной.
- Элюирование сорбированных аналитов 1,5 мл метанола pH
Валидация
Валидацию разработанной биоаналитической методики проводили в соответствии с современными требованиями [2], [4,] [5] по следующим параметрам: специфичность, линейность, правильность, прецизионность, предел обнаружения и количественного определения.
Для определения специфичности разработанных условий проводили анализ стандартных растворов КОН-2 (5 мкг/мл), холостого образца плазмы крови и модельной смеси плазмы с известным содержанием аналита. Примеры хроматограмм приведены на рис. 1.
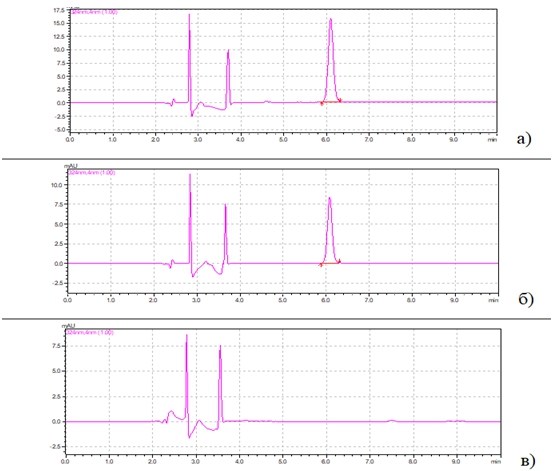
Рис. 1 – Хроматограммы: а) стандартного раствора КОН-2 (5 мкг/мл); б) извлечения из модельной смеси плазмы крови с КОН-2 (5 мкг/мл); в) извлечения из холостой пробы плазмы крови
Идентификацию пика КОН-2 проводили по времени удерживания и УФ- спектру, сравнивая с аналогичными параметрами стандартного раствора вещества. Анализ хроматограммы извлечения из холостой пробы плазмы крови показал отсутствие мешающих пиков на месте выхода исследуемых соединений.
Для установления линейности методики были проанализированы 7 образцов модельных смесей плазмы с содержанием КОН-2 в диапазоне 0,2 – 10 мкг/мл. Образцы готовили к анализу в соответствии с разработанной методикой пробоподготовки и хроматографировали по 3 раза. Результаты определения линейности приведены на рис. 2.
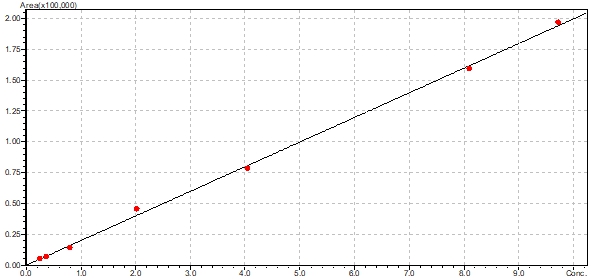
Рис. 2 – Калибровочный график количественного определения КОН-2
Коэффициент корреляции составил 0,9987315, что подтверждает линейность методики в указанном диапазоне концентраций. Уравнение калибровочного графика имеет вид Y = 1972,49*X (Y – площадь пика, X – концентрация, мкг/мл).
Предел обнаружения КОН-2 при использовании разработанной методики – 0,1 мкг/мл, предел количественного определения – 0,2 мкг/мл.
Для оценки пригодности методики по параметрам прецизионность и правильность были приготовлены 6 модельных биообразцов на 4 уровнях концентраций КОН-2. Пробоподготовку образцов осуществляли в соответствии с предложенной методикой. Прецизионность и правильность методики оценивалась по величинам относительного стандартного отклонения (RSD,%) и относительной величине систематической ошибки (δ,%), соответственно (таблица 3).
Таблица 3 – Оценка правильности и прецизионности методики определения КОН-2 в плазме крови
| Концентрация КОН-1 в модельной смеси, мкг/мл | (n = 6) | SD | RSD,% | ε,% |
| 0,29 | 0,26 | 0,019 | 7,2976 | -10,3 |
| 0,44 | 0,44 | 0,0469 | 10,6265 | 0 |
| 4,42 | 4,53 | 0,3111 | 6,8616 | 2,49 |
| 6,94 | 6,95 | 0,4759 | 6,8465 | 0,14 |
Полученные величины относительного стандартного отклонения и относительной погрешности не превышают 15%, что соответствует требованиям действующих руководств.
Таким образом, предложена высокочувствительная и эффективная методика изолирования КОН-2 из плазмы крови, соответствующая современным требованиям валидации биоаналитических методик.
| Конфликт интересов
Не указан. |
Conflict of Interest
None declared. |
Список литературы / References
- Динамическое концентрирование органических веществ на неполярных сорбентах / О.А.Филиппов [и др.] // Журн. аналит. химии. – 2003. – Т. 58, №5. – С. 454-479.
- Руководство по экспертизе лекарственных средств. Том первый / А. Н. Миронов – Москва: Гриф и К, 2013. – 328 с.
- Шуклина Н.С. Поиск соединений, обладающих ноотропной активностью, в ряду 3-пирролин-2-онов: автореф. дис. …канд. биол. наук: 14.00.25 / Шуклина Наталья Сергеевна. – Пермь, 2001. – 21 с.
- Guidance for Industry: Bioanalytical method validation / U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office. Washington, DC, 2001. – 25 p.
- Guideline on validation of bioanalytical methods (draft) / European Medicines Agency. Committee for medicinal products for human use. London, 2009. – 23 p.
- McDonald P.D. Solid Phase Extraction Applications guide and Bibliography. / McDonald P.D., E.S.P Bouvier. // A Resource for Sample Preparation Methods Development / Waters, Milford, MA, 1995. – 420 р.
- Soltes L. Effective One/Two Step Purification of Various Materials by Solid-phase Extraction Soltes, L., Sebille B. // Biomedical Chromatography. -1997. – Vol. 11. – P. 348–351.
- Żwir-Ferenc A. Solid phase extraction technique – trends, opportunities and applications (Review) / Żwir-Ferenc A., Biziuk M. / Polish J. of Environ. Stud. – 2006. – Vol. 15, No. 5. – P. 677-690.
Список литературы на английском языке / References in English
- Dinamicheskoye kontsentrirovaniye organicheskikh veshchestv na nepolyarnykh sorbentakh [Dynamic concentration of organic substances on non-polar sorbents] / O.A. Filippov // Zh. analyt. Khimii. [Journal of Analytical Chemistry] – 2003. – V. 58, No. 5. – P. 454-479. [in Russian]
- Rukovodstvo po ekspertize lekarstvennykh sredstv. Tom pervyy [Guidelines for examination of medicines. Volume One] / A. N. Mironov – Moscow: Grif and K, 2013. – 328 p. [in Russian]
- Shuklina N.S. Poisk soyedineniy, obladayushchikh nootropnoy aktivnost’yu, v ryadu 3-pirrolin-2-onov [Search for compounds with nootropic activity in the series 3-pyrrolin-2-ones] / Shuklina N.S. Abstract of PhD in Biology: 14.00.25 / Shuklina Natalya Sergeevna. – Perm, 2001. – 21 p. [in Russian]
- Guidance for Industry: Bioanalytical method validation / U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office. Washington, DC, 2001. – 25 p.
- Guideline on validation of bioanalytical methods (draft) / European Medicines Agency. Committee for medicinal products for human use. London, 2009. – 23 p.
- McDonald P.D. Solid Phase Extraction Applications guide and Bibliography. / McDonald P.D., E.S.P Bouvier. // A Resource for Sample Preparation Methods Development / Waters, Milford, MA, 1995. – 420 р.
- Soltes L. Effective One/Two Step Purification of Various Materials by Solid-phase Extraction Soltes, L., Sebille B. // Biomedical Chromatography. -1997. – Vol. 11. – P. 348–351.
- Żwir-Ferenc A. Solid phase extraction technique – trends, opportunities and applications (Review) / Żwir-Ferenc A., Biziuk M. / Polish J. of Environ. Stud. – 2006. – Vol. 15, No. 5. – P. 677-690.




