Эмпирическая антибактериальная профилактика при преждевременном разрыве плодных оболочек в сроке гестации 22–34 недели
Введение
Преждевременный разрыв плодных оболочек (ПРПО) — это нарушение целостности оболочек плода и излитие околоплодных вод до начала родовой деятельности независимо от срока беременности. ПРПО возникает в 38% преждевременных родов [1].
ПРПО является не только наиболее частой причиной преждевременных родов, но и связан с неблагоприятными неонатальными последствиями [2, 3]. Также ПРПО может способствовать развитию ряда осложнений у матери. Так, при ПРПО риск хориоамнионита возрастает с увеличением длительности разрыва мембраны [4]. В свою очередь, хориоамнионит может стать причиной послеродовой атонии матки с кровотечением, эндометрита, перитонита, сепсиса, респираторного дистресс-синдрома и, в редких случаях, смерти [5].
Актуальность данного исследования заключается в том, что информация о микробиологическом мониторинге позволит практикующим врачам правильно решать вопрос о назначении адекватной и эффективной эмпирической антибактериальной терапии до получения результатов бактериологических исследований, на которые требуется 72 ч от момента забора материала.
Цель исследования: улучшить исходы беременности, осложнившейся ПРПО в сроке гестации 22–34 нед., путем назначения в качестве стартовой антибиотикопрофилактики схем антибактериальных препаратов, обладающих высокой активностью в отношении всех наиболее часто высеиваемых микроорганизмов у данной категории пациенток.
Для достижения поставленной цели были определены следующие задачи: изучить и сравнить результаты бактериальных посевов отделяемого из полости матки у беременных с ПРПО, проходящих лечение в московских стационарах; определить чувствительность выявленных микроорганизмов к антибактериальным препаратам диско-диффузионным методом; разработать схему стартовой антибиотикопрофилактики в зависимости от полученных результатов.
Материал и методы
В исследовании проведено клинико-лабораторное обследование 60 беременных с ПРПО на сроках гестации с 22 нед. по 33 нед. и 6 дней. В зависимости от срока родоразрешения все пациентки были разделены на 2 группы: 1-ю группу составили 16 беременных с ПРПО на сроках гестации с 22 нед. по 27 нед. и 6 дней, 2-ю группу — 44 беременные с ПРПО на сроках гестации с 28 нед. по 33 нед. и 6 дней.
У всех пациенток при поступлении брали посев отделяемого из полости матки с определением чувствительности к антибактериальным препаратам диско-диффузионным методом. Посев исходного материала проводили на специализированные среды (агар 5% кровяной и среда Сабуро) с последующим выделением чистых культур микроорганизмов и их идентифицированием общепринятыми методами. Были проанализированы видовой состав и частота встречаемости всех микроорганизмов, высеиваемых в диагностически значимых титрах (≥105 КОЕ/мл).
Результаты исследования
В посевах обеих групп в 16 (20%) случаях роста микрофлоры не выявлено, в остальных посевах в подавляющем большинстве случаев выделены ассоциации микроорганизмов: один микроорганизм выделен лишь в 4 (25%) случаях в 1-й группе и в 8 (18%) — во 2-й группе, два микроорганизма и более — в 12 (75%) и 36 (82%) случаях соответственно. Статистически значимых различий между группами не выявлено (р>0,05). Анализ видового состава посевов отражен в таблице 1.
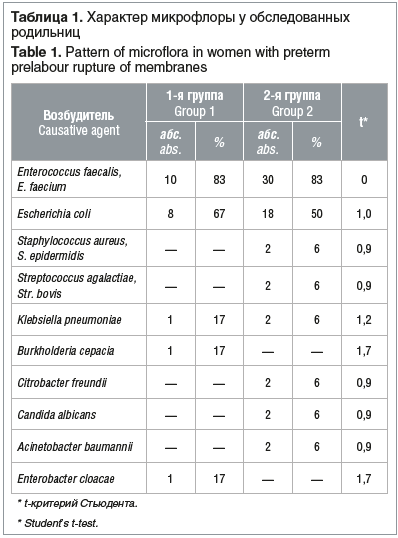
Анализ спектра выделенных микроорганизмов показал, что Enterococcus faecalis и E. faecium определяли в 83% от всех посевов отделяемого из полости матки в обеих группах. Также часто выделяли Escherichia coli, Klebsiella pneumoniae. В единичных случаях высеивались Staphylococcus aureus и S. epidermidis, Streptococcus agalactiae и Str. bovis, Burkholderia cepacia, Еnterobacter cloacae, Candida. Достоверных различий между группами не выявлено (р>0,05).
Полученные результаты показывают, что у беременных с ПРПО в подавляющем большинстве случаев имеет место высокий уровень бактериальной обсемененности содержимого полости матки различными ассоциациями микроорганизмов в высоких титрах, ведущими из которых являются бактерии семейств Enterococcaceae и Enterobacteriaceae. Таким образом, эмпирическая антибактериальная профилактика при ПРПО должна включать препараты, в спектр действия которых входят перечисленные выше возбудители. Отсутствие достоверных различий характера выделяемой патогенной микрофлоры у беременных с ПРПО в различные сроки гестации позволяет не делать различий между данными группами пациенток при назначении стартовой антибактериальной профилактики.
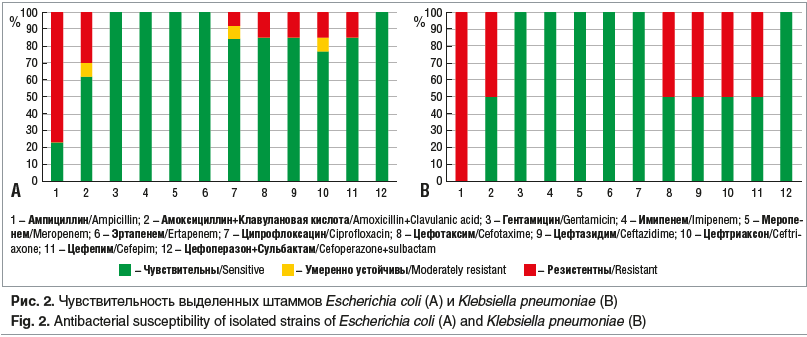
В дальнейшем были проанализировали полученные результаты антибиотикограмм. Чувствительность наиболее часто высеиваемых микроорганизмов показана на рисунках 1, 2.
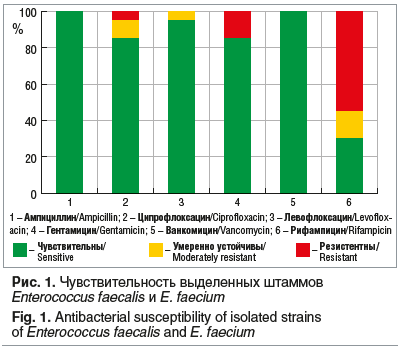
Известно, что наиболее важной особенностью рода энтерококков является их высокий уровень эндемической антибиотикорезистентности. Согласно литературным данным, энтерококкам изначально присуща высокая устойчивость к аминогликозидам. Также некоторые энтерококки имеют внутренние механизмы устойчивости к β-лактамным антибиотикам, т. к. продуцируют лактамазу [6]. Описаны штаммы энтерококков, устойчивые почти ко всем антибиотикам, включая тетрациклины, макролиды и хлорамфеникол. Ранее ванкомицин всегда считался средством, действующим на штаммы энтерококков с множественной устойчивостью. Однако в последние два десятилетия появились особо вирулентные штаммы энтерококков, резистентные к ванкомицину (vancomycin-resistant Еnterococcus) [6–8].
В нашем исследовании все выделенные штаммы энтерококков обладали достаточно высокой чувствительностью к различным группам антибактериальных препаратов. Все энтерококки обладали чувствительностью к пенициллинам. К гентамицину (аминогликозидный ряд) были чувствительны 85% выделенных штаммов. К ципрофлоксацину (фторхинолон II поколения) чувствительны также 85% штаммов, к левофлоксацину (фторхинолон III поколения) — 95%. Однако более половины выделенных штаммов были резистентны к рифампицину. В нашей работе ни в одном клиническом случае не были выделены ванкомицин-резистентные энтерококки.
Кишечная палочка в настоящее время проявляет устойчивость к более «старым» антибиотикам, оказавшись при этом чувствительной к более новым, что вполне закономерно. Максимальной активностью к E. coli среди пенициллинов обладают аминопенициллины в комбинации с ингибиторами β-лактамаз. Среди цефалоспоринов наибольшей активностью обладают цефалоспорины III и IV поколений [9]. Аминогликозиды проявляют высокую природную активность в отношении грамотрицательных бактерий, однако в последние годы отмечен рост устойчивости некоторых штаммов к аминогликозидам (к гентамицину и тобрамицину в большей степени, чем к нетилмицину и амикацину) [9]. Фторхинолоны II и III поколений также проявляют высокую природную активность в отношении Enterobacteriaceae. Наименьший уровень устойчивости госпитальных штаммов Enterobacteriaceae отмечен к карбапенемам. Результаты нашего исследования имеют ряд отличий от представленных выше данных литературы: минимальная резистентность у выделенных штаммов выявлена по отношению к карбапенемам, цефоперазону + сульбактаму и, вопреки нашим ожиданиям, к гентамицину. Максимальная резистентность — к пенициллинам, как к незащищенным, так и в комбинации с ингибиторами β-лактамаз. Следует отметить достаточно высокую резистентность высеянных штаммов к цефалоспоринам III и IV поколений, фторхинолонам.
В последнее десятилетие отмечается значительный рост заболеваний, вызываемых условно-патогенными микроорганизмами, в т. ч. K. pneumoniae.
Согласно данным зарубежной литературы в период с 2013 по 2015 г. резистентность у K. pneumoniae ко многим антибактериальным препаратам неуклонно росла. Так, например, резистентность данного микроорганизма к цефотаксиму, цефепиму и карбапенемам составляла 38–41%, 33–41% и менее 0,1–2% соответственно [10].
A. Magyar в своей работе приводит еще более высокие цифры — резистентность K. pneumoniae к цефалоспоринам достигает 60% из-за быстрого роста распространенности штаммов Klebsiella с расширенным спектром β-лактамазы [11]. В нашем исследовании все выделенные штаммы обладали достаточно высокой чувствительностью к различным группам антибактериальных препаратов. K. pneumoniae обладали высокой чувствительностью к карбапенемам и гентамицину (аминогликозидный ряд). К защищенным пенициллинам и цефалоспоринам были чувствительны 50% выделенных штаммов.
Заключение
На долю E. faecalis и E. faecium, E. coli, K. pneumoniae приходится до 80% от всех высеиваемых возбудителей при ПРПО. Именно поэтому при подборе эмпирической антибиотикопрофилактики в первую очередь мы учитывали чувствительность данных микроорганизмов.
Помимо результатов антибиотикограмм нами рассматривалась токсичность препаратов, т. к. некоторые антибактериальные препараты запрещены к применению в период всей беременности или в определенные триместры.
Наблюдающийся в последние годы рост внутриутробных инфекций у недоношенных детей, рождение которых ассоциировалось с ПРПО, обусловлен ростом штаммов кишечной палочки, устойчивых к ампициллину. Интранатальная профилактика внутриутробных инфекций ампициллином доказала свою эффективность в отношении β-гемолитического стрептококка. Однако на сегодняшний день данный препарат не может являться препаратом выбора для проведения антибиотикопрофилактики при ПРПО вследствие роста ампициллин-устойчивых штаммов E. coli [12].
Мы пришли к выводу, что препаратами выбора при назначении эмпирической антибиотикопрофилактики при ПРПО в настоящее время являются цефалоспорины III поколения (цефотаксим, цефтазидим), исключая цефтриаксон. Данные антибактериальные препараты обладают высокой активностью в отношении всех наиболее часто высеиваемых микроорганизмов (среди E. faecalis и E. faecium все выделенные штаммы чувствительны к цефазолину, следовательно, и к цефалоспоринам следующих поколений, среди E. coli чувствительны 85%, среди K. pneumoniae — 50%). К тому же применение данных антибиотиков разрешено как в III, так и во II триместрах беременности.
Помимо перечисленных выше микроорганизмов, цефалоспорины III поколения также обладают достаточно высокой активностью по отношению к S. aureus и S. epidermidis, Str. agalactia и Str. bovis, K. pneumoniae, высеиваемым в 6–17% случаев.
Цефотаксим обладает выраженной устойчивостью ко многим бактериальным β-лактамазам (кроме ферментов расширенного спектра действия) и высокоактивен в отношении многих грамположительных и грамотрицательных аэробных бактерий. Главное преимущество цефтазидима — очень высокая активность в отношении Pseudomonas spp. С учетом высокого бактерицидного потенциала цефтазидима в отношении синегнойной палочки за ним закреплен статус резервного препарата (назначение оправдано при доказанной инфекции, обусловленной P. aeruginosa, или подозрении на нее).
Таким образом, препаратом выбора при проведении эмпирической антибактериальной терапии при ПРПО в сроках 22–34 нед. гестации, согласно нашим исследованиям, является цефотаксим.
Благоприятный исход при ПРПО в первую очередь зависит от правильно выбранной эмпирической антибактериальной терапии. Разработанные нами на основании полученных антибиотикограмм схемы антибактериальных препаратов обладают высокой активностью в отношении всех наиболее часто высеиваемых микроорганизмов при ПРПО. Применение указанных препаратов в качестве стартовой антибиотикопрофилактики у беременных с ПРПО, родоразрешенных в г. Москве, вне зависимости от метода родоразрешения, улучшало результаты исхода при данном осложнении.
Сведения об авторах:
1Котомина Татьяна Сергеевна — к.м.н., заведующая отделением патологии беременных, ORCID iD 0000-0002-5660-2380;
2Подтетенев Андрей Дмитриевич — д.м.н., заместитель главного врача по акушерско-гинекологической помощи, ORCID iD 0000-0003-2074-9038;
1Буржунова Мадина Мирзаевна — врач акушер-гинеколог, ORCID iD 0000-0002-2198-9917.
1ГБУЗ «ГКБ № 52 ДЗМ». 123182, Россия, Москва, ул. Пехотная, д. 3.
2ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ». 123423, Россия, Москва, ул. Саляма-Адиля, д. 2/44.
Контактная информация: Котомина Татьяна Сергеевна, e-mail: tatakotomina@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 08.08.2018.
About the authors:
1Tatiana S. Kotomina — MD, PhD, Head of the Department of Pregnancy Disorders, ORCID iD 0000-0002-5660-2380;
2Andrey D. Podtetenev — MD, PhD, Deputy Head Physician on Obstetrics and Gynecology, ORCID iD 0000-0003-2074-9038;
1Madina M. Burzhunova — MD, gynecologist, obstetrician, ORCID iD 0000-0002-2198-9917.
1City Clinical Hospital No. 52. 3, Pekhotnaya str., Moscow, 123182, Russian Federation
2L.A. Vorokhobov City Clinical Hospital No. 67. 2/44, Salyama Adilya str., Moscow, 123423, Russian Federation.
Contact information: Tatiana S. Kotomina, e-mail: tatakotomina@mail.ru Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 08.08.2018.
Информация с rmj.ru






