Проблема терапии остеоартрита (ОА) коленного сустава имеет большое социально-экономическое значение в связи с высокой распространенностью этой патологии и ее прогнозируемым ростом в последующие годы [1, 2]. Поскольку по-прежнему ОА является частой причиной инвалидизации, а результаты его лечения во многих случаях не оправдывают ожидания, постоянно проводится поиск новых схем лечения, разрабатываются подходы к терапии с учетом новых знаний об этом заболевании.
Врачи в прошлом веке исходили из того, что дегенеративные изменения в суставах — это некая «плата за долгую жизнь». Кажущаяся неотвратимость изменений диктовала терапевтический подход: применялись преимущественно симптоматические препараты, физиотерапия, предлагалось использовать вспомогательные средства для облегчения передвижения больных.
В 1911 г. T. Muller предложил выделить группу заболеваний суставов дегенеративно-дистрофической природы как «arthrosis deformans», где ОА отводилось ведущее место. ОА долгое время называли «деформирующим остеоартрозом», хотя понятно, что любое хроническое заболевание суставов в процессе развития сопровождается дефигурацией и деформацией. Положение об ОА как о дистрофически-дегенеративном заболевании суставов полностью сформировалось в середине 1980-х гг., когда было определено, что хондроциты имеют низкую метаболическую активность и поэтому не способны восстановить поврежденный хрящ. Также считалось, что вследствие отсутствия васкуляризации хрящ не может ответить обычной воспалительной реакцией на раздражение [3]. Во втором десятилетии XXI в. в связи с развитием молекулярной биологии стало возможным изучение патогенеза ОА на субклеточном уровне, и это прояснило природу заболевания [4–7]. В последние годы четко доказано, что такой взгляд является ошибочным: ОА не просто болезнь износа («wear and tear»), а скорее аномальное ремоделирование суставных тканей под действием множества провоспалительных факторов, продуцируемых прежде всего субхондральной костью и синовиальной оболочкой. Патологическое ремоделирование формирует функциональную дисфункцию всех суставных структур с развитием однотипных патобиохимических изменений и клинических проявлений. Местная продукция провоспалительных цитокинов оказывает влияние на инициацию и усугубление других возраст-зависимых и метаболических заболеваний. Воспаление рассматривается как основной фактор развития и прогрессирования ОА [4–7].
Сегодня нам известно о значении воспаления в патогенезе ОА (доказано участие провоспалительных цитокинов: ИЛ-1, ИЛ-6, ФНО-альфа, а также матриксных металлопротеиназ, оксида азота и др.), характере деструктивных изменений соединительнотканных структур, формирующих сустав (дегидратация, фибрилляция, истончение хряща и др.) и нарушений синовиальной среды сустава (низкая молекулярная масса, пониженная вязкость и упругость синовиальной жидкости) [4, 6–8]. Можно предполагать, что одновременное воздействие по этим трем направлениям (подавление воспаления, замедление деструкции — «хондропротекция» — сдвиг баланса в сторону анаболических процессов в хряще и вискосупплементация) позволит добиться не только симптоматического эффекта, но и воздействия на механизмы развития и прогрессирования ОА, что будет обеспечивать более высокую эффективность терапии.
В препарате Инъектран® ХС представлен в виде гомогенизированной субстанции MV 7–13 kDa, получаемой из трахеи телят. Соотношение сульфатных групп в препарате (по данным клинических испытаний): ХС 4-го типа (ХС-4) — 53,9%, ХС 6-го типа (ХС-6) — 37,2%. Наилучшая абсорбция и биодоступность обеспечиваются низким молекулярным весом, наилучший эффект препарата — близким к составу хряща человека соотношением ХС-4/ХС-6 (61% : 34%). ХС-4 — маркер «молодости» хряща. Современные исследования убедительно доказали, что с возрастом уменьшается содержание в хрящевой ткани ХС-4 и увеличивается содержание ХС-6. ХС-4 обладает лучшей способностью аккумулировать влагу и имеет лучшие амортизационные свойства [16].
Ферматрон® относится к 4-му поколению препаратов гиалуроновой кислоты (ГК), имеет оптимальный молекулярный вес 1,1–2,2 млн дальтон, примерно соответствующий молекулярному весу нормальной синовиальной жидкости, изготовлен путем бактериальной ферментации. Стерилизация препарата проводится по методу микромембранной фильтрации с сохранением максимальной нативности препарата, рН-стабилизация осуществляется фосфатным буферным раствором, идентичным человеческому. Ферматрон® в концентрации 1% был выбран, с одной стороны, из соображений экономической целесообразности. С другой стороны, мы предположили, что если положительный терапевтический эффект 1% формы выпуска будет обнаружен в ходе исследования, то эффект от более вязких и концентрированных форм ГК будет как минимум сопоставимым.
Всего в исследовании приняли участие 125 пациентов в возрасте от 50 до 70 лет, из них 25 мужчин и 100 женщин. Критериями включения в исследование были: установленный диагноз первичного ОА коленного сустава, рентгенологическая стадия III по Келлгрену — Лоуренсу, боль не менее 40 мм по ВАШ, потребность в системном приеме НПВП. Критерии исключения были следующие: внутрисуставное введение препаратов ГК в течение 3 мес., предшествующих исследованию, прием глюкозамина сульфата или ХС за 1,5 мес. до исследования, вторичный ОА, оперативные вмешательства на коленном суставе, болезни крови, прием оральных антикоагулянтов и варфарина, онкозаболевания. Средний возраст пациентов составлял 62±3,21 года, средняя продолжительность заболевания — 9,4±2,8 года. Соотношение мужчин и женщин в каждой группе было сопоставимо (табл. 1).
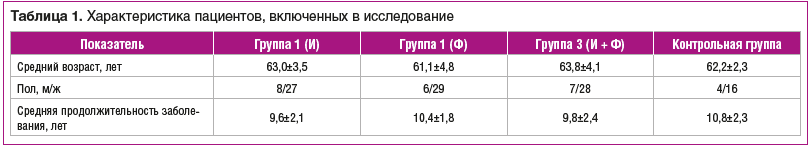
Пациенты были рандомизированы на 3 группы по 35 человек, одна группа стала контрольной.
Группа 1 (35 человек) получала НПВП + Инъектран® 200 мг в/м через день № 25, группа 2 (35 человек) — НПВП + Ферматрон® 1% 2 мл с интервалом 7 дней в/с № 3, группа 3 (35 человек) — НПВП + Инъектран® 200 мг в/м через день № 25 + Ферматрон® 1% 2 мл с интервалом 7 дней в/с № 3.
Контрольная группа (20 человек) получала только НПВП. Эта группа была сформирована из пациентов, которые по разным причинам не могли или не хотели применять другие препараты.
Оценку симптомов заболевания проводили при помощи индекса WOMAC до начала терапии, через 8 и 12 нед. Интенсивность боли при ходьбе оценивалась по визуальной аналоговой шкале (ВАШ). Также исследовали потребность пациентов в НПВП до и после проведенной терапии. Этот критерий мы посчитали важным, т. к. в реальной клинической практике отмечалась высокая коморбидность, у 89 человек (71,2%) имелось 2 и более заболеваний, у большинства пациентов присутствовала сердечно-сосудистая и другая патология (табл. 2), требующая минимизации системного применения НПВП для снижения риска нежелательных реакций.

В исследовании был применен факторный протокол 2×2, чтобы оценить роль каждого исследуемого фактора (в нашем случае — лекарственного препарата) по отдельности и в комбинации, а также результаты отсутствия влияния обоих факторов.
Мы сознательно отбирали пациентов с III рентгенологической стадией ОА, чтобы оценить лечебное воздействие у больных с наиболее выраженными симптомами заболевания.
Содержание статьи
Результаты исследования
Лечение завершили все пациенты. У 3 пациентов при введении Ферматрона были отмечены болевые ощущения в месте инъекции, самостоятельно исчезнувшие в течение суток. При применении Инъектрана нежелательных реакций не отмечено.
Оценка боли при ходьбе по ВАШ до начала терапии и сразу после ее окончания была проведена отдельно (рис. 1), поскольку именно эта характеристика очень важна для врача и определяет готовность пациента расширять двигательную активность. Было выявлено, что уменьшение боли при ходьбе имело место во всех группах. В группах, получавших Инъектран® (группа 1) или Ферматрон® (группа 2), динамика снижения болевого синдрома была сопоставимой и составила чуть более 30% в обеих группах, это достоверные значения по сравнению с исходными (р® + Ферматрон®, боль при движении уменьшилась более чем на 50% от исходных значений, т. е. применение двух препаратов одновременно позволило улучшить результаты лечения в 1,5 раза. Межгрупповые различия достоверны (р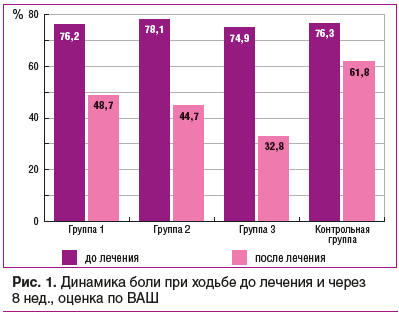
Во всех группах исследования пациенты смогли снизить дозу применяемых НПВП (табл. 3). В контрольной группе 80% пациентов сохранили к 8-й нед. прежнюю дозу НПВП, тогда как в группе 3 — только 5,7%, в группе 2 — 17,1%, в группе 1 — 11,5%. Межгрупповые различия достоверны (р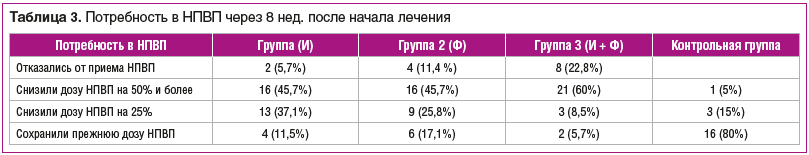
К окончанию терапии снижение суммарного индекса WOMAC в наибольшей степени отмечено в группе 3 — более чем на 50%, в группах 1 и 2 — более чем на 40%, в контрольной группе — на 20%. Во всех группах через 12 нед. отмечалась тенденция к сохранению и даже нарастанию эффекта от проведенной терапии (рис. 2). Таким образом, наблюдается эффект последействия, достигающий наибольшей выраженности при совместном применении Инъектрана и Ферматрона в группе 3. Межгрупповые различия (между группами 1 и 3, 2 и 3) к 12-й нед. наблюдения достоверны (р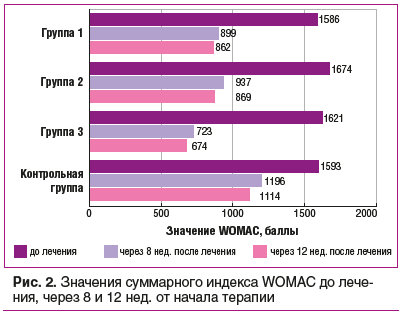
Применение Инъектрана и Ферматрона по отдельности имело высокую эффективность в отношении влияния на ведущие симптомы ОА у пациентов с тяжелым течением заболевания и III рентгенологической стадией по Келлгрену. Однако совместное применение двух препаратов потенцировало лечебное действие каждого из них, о чем свидетельствует динамика таких показателей, как боль, скованность, функциональная недостаточность в группе 3, получавшей Ферматрон® и Инъектран® одновременно (рис. 3).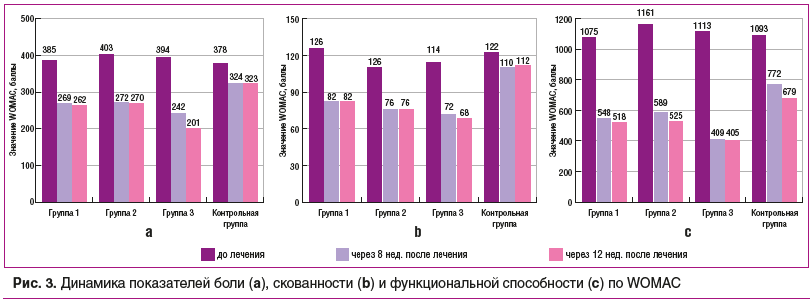
После завершения курса лечения в группе 3 показатели боли уменьшились в 2 раза, в группах 1 и 2 — более чем на 30%. В контрольной группе результат существенно ниже — 15%. Функциональные нарушения в группе 3 регрессировали на 64% от исходного уровня, в группе 1 — на 52%, в группе 2 — на 47%, а в контрольной группе — менее чем на 30%. Показатели скованности в группе 3 уменьшились на 41%, в группе 2 — на 31%, в группе 1 — на 35%, в контрольной — на 9% от начальных значений.
Обсуждение результатов
Пациенты с III рентгенологической стадией и высокой интенсивностью болевого синдрома часто становятся кандидатами на эндопротезирование коленного сустава. Успешная терапия боли и воспаления у этой группы больных способна отсрочить эндопротезирование или сохранить сустав. Также важно понимать, что всегда есть пациенты с противопоказаниями к проведению эндопротезирования, которые нуждаются в облегчении симптомов заболевания методами консервативной терапии.
Особого внимания заслуживает тот факт, что во всех исследуемых группах у большей части пациентов удалось снизить суммарную недельную дозу системных НПВП на 25% и 50%, а в некоторых случаях больные смогли полностью отказаться от приема препаратов этой группы. Наряду с уменьшением клинических проявлений заболевания ограничение приема системных НПВП является важнейшим результатом, влияющим на качество жизни пациентов, поскольку в нашем исследовании и в реальной клинической практике большинство из них имеют сердечно-сосудистую патологию, при которой применение НПВП в высоких и средних дозах в постоянном режиме нежелательно из-за угрозы дестабилизации АД, прогрессирования хронической сердечной недостаточности и хронической болезни почек и повышения риска сердечно-сосудистых событий. В условиях коморбидности это имеет большое значение, т. к. позволяет уменьшить вероятность лекарственных взаимодействий и снизить риски нежелательных реакций.
Основными симптомами, ухудшающими качество жизни при ОА коленного сустава, являются боль и нарушение функции. Облегчение этих симптомов ассоциируется у пациента с эффективностью проводимой терапии. Для врача отсутствие боли и прогрессирующих функциональных нарушений означает, что пациент отвечает на проводимое лечение и имеет возможность сохранить сустав.
Результаты лечения самими пациентами в целом были оценены положительно, без выраженных межгрупповых различий (рис. 4). Преобладали хорошие и отличные оценки терапии, это связано с оправданием ожиданий пациентов в плане уменьшения болей в суставе в покое и при движении. Неудовлетворительные и удовлетворительные результаты были преимущественно у лиц с нейропатической болью и депрессивными проявлениями. Таким пациентам в дальнейшем может быть рекомендовано применение дулоксетина, прегабалина и габапентина, низких доз трамадола. При неэффективности всех использованных медикаментозных методов лечения данная категория больных может быть направлена на эндопротезирование сустава.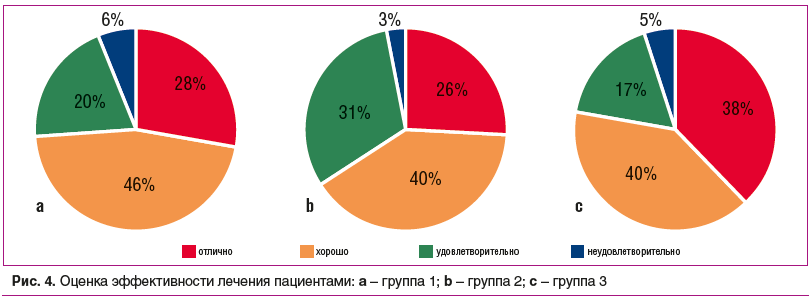
Согласно результатам проведенного исследования сочетанное применение Инъектрана и Ферматрона позволяет к 8-й нед. лечения уменьшить болевой синдром более чем на 50%, способствует сокращению скованности на 41% и приводит к уменьшению функциональных нарушений на 64% от исходных показателей и расширению двигательной активности у пациентов с ОА коленного сустава. К 12-й нед. наблюдения, через 1 мес. после окончания применения препаратов, положительный эффект не только сохраняется, но и нарастает, продолжается регресс клинической симптоматики. Эта тенденция отмечается во всех 3 основных группах исследования.
Гиалуронат натрия влияет на синовиальный гомеостаз путем восстановления вязкоэластичных свойств синовиальной жидкости, стабилизации коллагеновых волокон капсулы и лигаментарного аппарата, восстановления скорости транспорта метаболитов от клеток через синовиальную среду в лимфатические сосуды и поддержания нормального уровня транссиновиального обмена за счет барьерной и механической функций ГК, а на микроуровне происходит восстановление вязкоэластичного окружения клеточных структур синовиальной оболочки, ноцицепторов, угнетение миграции, фагоцитоза и высвобождения простагландинов под действием ГК и стимуляция выработки сoбственной ГК синовиоцитами [17–19].
ХС, согласно данным многочисленных исследований, повышает эластичность и механическую прочность хряща, обеспечивает гидратацию и накопление ГК, повышает секрецию внеклеточного матрикса (коллаген, аннексин, аггрекан) и факторов роста (PENK, CTGF) соединительной ткани, тормозит деградацию хряща путем блокирования протеаз (SERPINA3, SERPIN1), повышает активность хондроитинсульфатных гликозилтрансфераз, отвечающих за реконструкцию соединительной тка-
ни [9, 20–22].
Противовоспалительное действие его реализуется путем связывания с рецептором СD44 и снижения транскрипции провоспалительного сигнального фактора NF-kB, снижения активации провоспалительных цитокинов (ИЛ-1, -6, ФНО), ингибирования синтеза ММР и простагландина Е, подавления синтеза ИЛ-1-индуцированной экспрессии СОХ2 и повышения уровня тромбоспондина-1 — ингибитора ангиогенеза [9, 13, 20–26].
Выводы
Результативность комплексной терапии Ферматроном и Инъектраном оказалась выше, чем результативность применения каждого из препаратов по отдельности (также показавшего хорошую эффективность). Каждый из использованных в исследовании препаратов оказывает не только симптоматическое, но и патогенетическое действие.
Причиной успеха комплексной терапии может быть взаимодействие ХС и гиалуронана, при котором ХС защищает ГК от воздействия гиалуронидазы путем угнетения ее активности и потенцирования противовоспалительного и регуляторного действия на метаболизм хряща.
Информация с rmj.ru






