БИОВЫЩЕЛАЧИВАНИЕ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ ОТХОДОВ ОБОГАЩЕНИЯ
Научная статья
Булаев А.Г.1, *, Меламуд В.С.2
1 ORCID: 0000-0001-7914-9817,
1, 2 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук; Москва, Россия;
1 Биологический факультет, Московский государственный университет имени М.В .Ломоносова; Москва, Россия
* Корреспондирующий автор (bulaev.inmi[at]yandex.ru)
Аннотация
Был проведен процесс перколяционного биовыщелачивания цветных металлов (меди и цинка) из отходов обогащения (хвостов флотации) медно-цинковой сульфидной руды. Проба отходов содержала 0,26 и 0,22% меди и цинка. Процесс биовыщелачивания проводили с использованием микробного консорциума предварительно адаптированного к перерабатываемым отходам, который включал Acidithiobacillus ferrivorans, At. caldus, Leptospirillum ferriphilum, Ferroplasma acidiphilum и Acidiplasma sp. Перед процессом биовыщелачивания отходы обогащения подвергали кислотному выщелачиванию 10% серной кислотой, что позволило извлечь 39 и 42% меди и цинка. Биовыщелачивание на протяжении 200 суток позволило извлечь в жидкую фазу 67,5 и 53,9% меди и цинка.
Ключевые слова: отходы обогащения, ацидофилы, биовыщелачивание.
BIOX OF COLOR METALS FROM WASHERY REFUSES
Research article
Bulaev A.G.1, *, Melamud V.S.2
1 ORCID: 0000-0001-7914-9817,
1, 2 Vinogradsky Institute of Microbiology, Federal Research Center “Fundamentals of Biotechnology” of the Russian Academy of Sciences; Moscow, Russia;
1 Lomonosov Moscow State University; Moscow, Russia
* Corresponding author (bulaev.inmi[at]yandex.ru)
Abstract
The process of percolation BIOX of non-ferrous metals (copper and zinc) from washery refuses (flotation tailings) of copper-zinc sulfide ore was carried out. The waste sample contained 0.26% of copper and 0.22% of zinc. The bioleaching process was performed with the use of microbial consortium pre-adapted to recyclable waste, which included Acidithiobacillus ferrivorans, At. caldus, Leptospirillum ferriphilum, Ferroplasma acidiphilum and Acidiplasma sp. Before the BIOX process, the washery refuses were subjected to acid leaching with 10% sulfuric acid, which made it possible to extract 39 and 42% of copper and zinc. Bioleaching for 200 days made it possible to extract 67.5 and 53.9% of copper and zinc in the liquid phase.
Keywords: enrichment wastes, acidophiles, bioleaching.
Введение
Биогидрометаллургические технологии широко применяются для получения цветных и благородных металлов из сульфидных руд и концентратов. С помощью биогидрометаллургии получают в такие металлы как медь, уран, никель и золото [1]. Основой биогидрометаллургических технологий являются процессы микробного окисления сульфидных минералов, содержащихся в рудах, ацидофильными микроорганизмами, использующими в качестве энергетического субстрата двухвалентное железо, серу и сульфидные минералы [2]. Ионы цветных металлов (меди, цинка, никеля, кобальта) входят непосредственно в состав сульфидных минералов (например: халькопирита (CuFeS2), борнита (Cu5FeS4), энаргита (Cu3AsS4), ковеллина (CuS), халькозина (Cu2S), сфалерита (ZnS), пентландита ((Fe, Ni)9S8) и др.), поэтому при окислении сульфидных минералов происходит выход ионов цветных металлов в раствор, откуда они затем извлекаются различными методами (цементация, жидкостная экстракция, осаждение сероводородом, извлечение с помощью ионообменных смол). При переработке сульфидных руд и концентратов золота в процессе биоокисления золотовмещающих сульфидных минералов происходит разрушение их кристаллической решетки, а золото не растворяется непосредственно в процессе биоокисления, а только вскрывается, становясь доступным для цианирования [3].
Выделяют отвальное, кучное, подземное и чановое (реакторное или агитационное) биоокисление [4]. В случае подземного выщелачивания производится закачка раствора, содержащего кислоту, окислитель (Fe3+), генерируемый микроорганизмами, а также клетки микроорганизмов непосредственно в место залегания руды. При отвальном и кучном выщелачивании осуществляется обработка растворами отвалов руд (чаще некондиционных) или куч измельченного и окомкованного рудного материала, расположенного на площадке с гидроизоляцией. Чановое или реакторное биовыщелачивание подразумевает проведение окисления измельченного сырья в реакторах с перемешиванием [5]. По сравнению с подземным, отвальным и кучным биовыщелачиванием, чановое обеспечивает переработку сырья с большей скоростью, но требует гораздо больших капитальных и эксплуатационных затрат. Поэтому кучное биовыщелачивание применяется для переработки бедных руд цветных металлов, прежде всего меди, а чановое – для переработки сульфидных концентратов золотосодержащих руд [1].
В табл. 1 приведены примеры использования кучного биовыщелачивания для переработки бедных медных руд с содержанием меди от 0,15 до 2% [6]. Масса эксплуатируемых куч бедных медных руд может достигать нескольких миллионов тонн, время их эксплуатации – нескольких лет. По приблизительным оценкам около 5% мирового производства меди обеспечивается кучным биовыщелачиванием [1]. Россия в настоящее время отстает от мирового уровня развития технологии кучного биовыщелачивания, несмотря на то, что в СССР в 1970-1980 гг. проводились полупромышленные испытания по кучному выщелачиванию меди из руд месторождений Урала и Казахстана [7]. При этом Россия, являющаяся лидером по добыче некоторых цветных металлов (например, по добыче никеля РФ в 2014 году занимала второе место в мире (260 тыс. т), по кобальту – пятое (6300 тыс. т.), по меди и свинцу – седьмое (850 и 195 тыс. т., соответственно [8]), могла бы занять лидирующие позиции по использованию биогидрометаллургии, в частности кучного биовыщелачивания. Особенно широкое применение могут найти биогидрометаллургические технологии для переработки бедных руд цветных металлов (прежде всего меди, а также цинка и никеля), а также отходов их добычи и обогащения. Отвалы пустой породы, которые накапливаются в непосредственной близости от карьеров горно-добывающих предприятий, а также хранилища отходов обогащения по сути являются техногенными месторождениями бедных сульфидных руд [8], [9], [10], [11], [12]. Согласно различным оценкам, ежегодно в странах СНГ складируется в отвалах около 5 млрд. т. вскрышных пород и 700 млн. т хвостов. Всего в отвалах горнодобывающих предприятий Российской Федерации накоплено более 40 млрд. т отходов [13]. Отечественные исследователи сходятся на том, что данные хранилища негативно воздействуют на окружающую среду, прежде всего путем загрязнения поверхностных и подземных вод и как следствие, почв [14], [15]. Площадь почвенного покрова, загрязненного цветными металлами, достигает в России 3,6 млн га, при этом чрезвычайно высокий уровень загрязнения степенью загрязнения обнаружен на площади более 0,25 млн. га. [16].
Таблица 1 – Примеры переработки бедных медных руд с помощью кучного биовыщелачивания [6]
| Месторождение (Страна) | Содержание меди в руде, % | Производство меди, т/год |
| Duval (США) | 0,15 – 0,20 | 2,500 |
| Bluebird (США) | 0,5 | 6,800 |
| Degtyarsky (СССР) | н.д. | 900 |
| Kosaka (Япония) | 0,15 – 0,25 | 800 |
| Río Tinto (Испания) | н.д. | 8,000 |
| Cananea (Месика) | н.д. | 9,000 |
| St. Domingo (Португалия) | н.д. | 670 |
| Cerro Colorado (Чили) | 1,0 | 130,000 |
| Ivan (Чили) | 2,1 | 10,000 |
| Quebrada Blanca (Чили) | 0,9 | 82,000 |
| Chuquicamata (Чили) | 0,3 | 12,500 |
| Los Bronces (Чили) | 0,45 | 46,400 |
| Zaldívar (Чили) | н.д. | 147,000 |
| Alliance Copper (Чили) | 1,4 | 20,000 |
| Escondida (Чили) | 0,3-0,7 | 750,000 |
| Spence (Чили) | 1,1 | 200,000 |
| Zijinshan (КНР) | 0,3 | Н.д. |
На некоторых ГОКах накоплены сотни миллионов тонн. вскрышных пород и отходов обогащения. Они могли бы быть переработаны с помощью технологий отвального и кучного биовыщелачивания. Российскими исследователями проведен ряд лабораторных исследований по переработке отходов обогащения (хвостов) с помощью биовыщелачивания. Пиритные хвосты флотации полиметаллических руд содержат достаточно высокие количества цветных металлов (до 1%) и золота (до 2 г/т) и могут рассматриваться как техногенное сырье. Показано, что биоокисление позволяет достичь достаточно высокого извлечения ценных металлов из хвостов (от 40 до 90% меди и цинка) за срок от 21 до 130 суток [8], [9], [10], [11], [12]. Таким образом, биовыщелачивание позволяло извлекать цветные металлы из хвостов с различной эффективностью, что могло быть обусловлено как особенностями минерального состава различных отходов, так особенностями составом микробных культур, используемыми для выщелачивания. Известно, что промышленные процессы биовыщелачивания осуществляются не чистыми культурами, а сообществами микроорганизмов [2]. При этом наилучших результатов окисления, как правило, удается достичь при использовании микробных сообществ, адаптированных к конкретному минеральному сырью [2], [17]. Эта закономерность была подтверждена и на примере процесса биовыщелачивания отходов обогащения. В работе [12] было показано, что использование сообщества, состоящего из аборигенных микроорганизмов, выделенных непосредственно из мест складирования отходов обогащения, позволило проводить процесс биовыщелачивания с более высокой эффективностью, чем использование типового штамма A. ferrooxidans.
Целью данной работы было проведение лабораторных испытаний по биовыщелачиванию цветных металлов (меди и цинка) из пробы отходов обогащения (хвостов флотации) одного из ГОКов России в перколяционной установке, чтобы оценить перспективность кучного биовыщелачивания для переработки данных отходов. Для проведения процесса микробный консорциум был предварительно адаптирован для окисления конкретного субстрата, а его состав после адаптации был определен с помощью молекулярно-биологических методов.
Материалы и методы
Объектом исследования являлась проба лежалых пиритных хвостов обогащения с одного из ГОКов России. Выход класса крупности -100 мкм составил 100% Минеральный и химический состав пробы приведен в табл. 2 и 3. Проба характеризовалась высоким содержанием пирита, кроме того в пробе было зафиксировано высокое содержание оксидного железа, что свидетельствовало о том, что в процессе хранения хвосты обогащения подвергались окислению (в том числе биологическому). В хвостах обогащения содержались медь и цинк (0,26 и 0,22%, соответственно). Рентгенодифрактометрический анализ показал присутствие халькопирита и сфалерита.
Таблица 2 – Химический состав усредненной пробы лежалых пиритных хвостов обогащения
| Элемент | Символ | Содержание, масс. доля, % |
| Сера общая | Sобщ. | 17,80 |
| Сера сульфидная | Sсульфид. | 14,5 |
| Железо общее | Feобщ. | 17,4 |
| Железо сульфидное | Feсульфид. | 13,4 |
| Железо оксидное | Feоксидн. | 3,3 |
| Медь | Cu | 0,26 |
| Цинк | Zn | 0,22 |
Таблица 3 – Минеральный состав усредненной пробы лежалых пиритных хвостов обогащения по данным рентгенодифрактометрического метода
| Минеральная фаза | Формула | Содержание, % масс. доли |
| Пирит | FeS2 | 31 |
| Халькопирит | CuFeS2 | 0,5 |
| Гипс | CaSO4∙2H2O | 13 |
| Ярозит | KFe3(SO4)2(OH)6 | 1 |
| Мусковит | K,Al2(AlSi3O8)(OH,F)2 | 4 |
| Плагиоклаз | NaAlSi3O8 | 2 |
| Клинохлор | (K,Mg)6(SiAl)4O10(F,OH)2 | 5 |
| Сфалерит | ZnS | 1 |
| Кварц | SiO2 | 41 |
При проведении процессов биоокисления величины рН и Eh измеряли с помощью рН-метра-милливольтметра рН-150МA (Беларусь), значения Eh выражали относительно нормального водородного электрода. Концентрацию ионов Fe2+ и Fe3+ определяли трилонометрическим титрованием [18]. Определение содержания железа, меди и цинка в твердой фазе проводили методами фазового анализа [19]. Концентрации меди и цинка определяли с помощью атомно-абсорбционного спектрометра с пламенной ионизацией Perkin Elmer 3100 (США).
Для создания микробного консорциума в качестве инокулята использовалось микробный консорциум, сформировавшееся в процессе биовыщелачивания отходов обогащения [8], а также чистые культуры Sulfobacillus thermosulfidooxidans Sh 10-1 и Sh 10-2, Acidithiobacillus caldus MBC, и Acidiplasma sp. MBA-1. Для адаптации микробного сообщества инокулят был засеян в цилиндрические стеклянные сосуды с эрлифтным перемешиванием, вмещающие 1 л жидкой среды. В сосуды помещали по 100 мл инокулята, 900 мл минеральной питательной среды, используемой для культивирования ацидофильных железо- и сероокислителей [20], а также 100 г навески пиритных хвостов обогащения. Хвосты обогащения предварительно промывали, чтобы удалить оксидные соединения, не являющиеся питательным субстратом для микроорганизмов, 10% раствором серной кислоты, затем дистиллированной водой, а затем высушивали. Культивировали микробный консорциум при комнатной температуре (20-25°С). Об адаптации сообщества микроорганизмов к субстрату судили по параметрам жидкой фазы в процессе окисления (концентрации железа, pH, Eh среды, количество клеток микроорганизмов), которые позволяют характеризовать активность окисления минералов, содержащихся в хвостах обогащения. После достижения стабильных параметров жидкой фазы и высокого числа клеток микроорганизмов микробный консорциум культивировали в полупроточном режиме, один раз в 25−30 сут. заменяя 10% жидкой среды и внося навески промытых хвостов обогащения.
Видовой состав сформировавшегося микробного сообщества, проводили с помощью ДГГЭ. Пробу для анализа отбирали после начала полупроточного культивирования. ДНК из образцов выделяли и очищали по стандартным методикам, описанным ранее [21]. Реакцию амплификации проводили в 20 мкл смеси, содержащей однократный реакционный буфер фирмы «Evrogen», 200 мкг каждого дезоксирибонуклеотид-трифосфата, соответствующее количество каждого праймера, 1 ед. активности Taq ДНК полимеразы (Evrogen, Россия) и 1 мкл раствора матричной ДНК в концентрации 1–10 нг. Для амплификации использовались праймеры Univ515F 5′-GTGBCAGCMGCCGCGGTA-3′ (универсальный) и Bac907R 5′-CCGTCAATTCMTTTGAGTTT-3′ (бактериальный) или Arch915R 5′-GTGCTCCCCCGCCAATTCCT-3′ (архейный). Температурную программу подбирали экспериментально, основываясь на стандартном протоколе ПЦР. Перед проведением анализа DGGE к полученным ампликонам добавляли участок, богатый Г+Ц нуклеотидами, для чего проводили реамплификацию с праймерами, содержащими так называемый Г+Ц-кламп, состоящий из 40 нуклеотидов: 515FGCclamp5’CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCGGTGBCAGCMGCCGCGGTAAВ-3′. Во всех экспериментах в качестве одного из отрицательных контролей использовали реакцию без добавления ДНК. Амплификацию проводили на многоканальном ДНК-амплификаторе Терцик (ДНК-технология, Россия). Продукты амплификации анализировали с помощью электрофореза в 1,5% агарозном геле. Полученные с помощью ПЦР ампликоны разделяли на основании характеристики их плавления в 8% (по объему) полиакриламидном геле с относительным градиентом концентрации денатурирующих агентов от 30% до 70% с помощью прибора TV400-DGGE (SCIE-PLAS, Англия). Электрофорез проводили при постоянном напряжении 70 В и температуре 60°C в течение 20 ч. После электрофореза гель промывали бидистиллированной водой и затем окрашивали SYBR® Gold (Molecular probes, Лейден, Нидерланды) в течение 40 мин в темноте. После окрашивания продукт амплификации визуализировали на трансиллюминаторе при длине волны 470 нм, и нужные полосы вырезали для дальнейшего анализа. Полосы из геля помещали в пробирки, содержащие 20 мкл дистиллированной воды, и оставляли в холодильнике на ночь для элюирования ДНК из геля. Элюат в количестве 1мкл использовали в качестве матрицы для проведения ПЦР с соответствующими праймерами. Продукты реамплификации чистили электрофорезом в 1,5% агарозном геле, ДНК из которого вырезали и чистили с помощью набора для очистки ДНК из геля и реакционных смесей (Цитокин, Россия). Секвенирование проводили по методу Сэнгера. Первичный анализ сходства полученных нуклеотидных последовательностей генов 16S рРНК проводили с помощью сервера BLAST (ncbi.nlm.nih.gov/blast). Выравнивание последовательностей и построение филогенетического дерева исследуемых бактерий осуществляли с помощью пакета программ MEGA 6 [22].
Биовыщелачивание проводили в перколяционных установках, состоящих из колонок в которые помещали навески сырья, емкостей для сбора продуктивных растворов, емкостей для регенерации окислителя, снабженной компрессором для аэрацией (рис. 1).
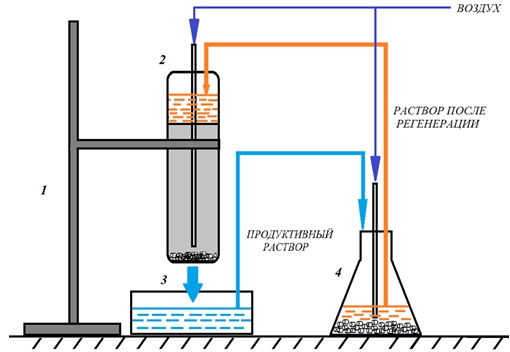
Рис. 1 – Схема перколяционной установки. 1 – штатив; 2 – перколяционная колонка; 3 – емкость для сбора продуктивного раствора; 4 – емкость для регенерации окислителя
Каждая перколяционная колонка вмещала 1 кг отходов обогащения. Перед началом процесса биовыщелачивания отходы флотации, помещенные в колонки, промывали 10 % (м/об.) раствором серной кислоты. После кислотной промывки продуктивный раствор удаляли. После этого в каждую колонку вносили по 700 мл. культуры, выращенной на жидкой среде с отходами обогащения в качестве питательного субстрата. Выщелачивание проводили в режиме затопления, наливая раствор в верхнюю часть колонки. Просочившийся через слой сырья продуктивный раствор поступал в емкость для сбора продуктивных растворов. Так как в ходе перколяции раствора, содержащего окислитель, через слой сырья, содержащего окислитель (Fe3+), трёхвалентное железо восстанавливалось до двухвалентного, продуктивные растворы переносили в емкость-регенератор, куда подавали воздух с помощью компрессора. Благодаря интенсивной аэрации в емкости-регенераторе микроорганизмы окисляли двухвалентное железо до трехвалентного. В емкость-регенератор помещали керамические кольца Рашига, чтобы избежать вымывания биомассы. После окисления раствор переносили в верхнюю часть колонки для перколяции. Процесс биоокисления проводили в две стадии по 100 суток. После первой стадии навески хвостов обогащения в перколяцию прекращали, проводили промывку подкисленной водой (рН 1,5), затем дистиллированной водой. Навески извлекали из колонок, высушивали до постоянного веса, чтобы определить выход твердой фазы после биовыщелачивания, определяли химический состав остатков биоокисления. Затем остатки биоокисления снова помещали в колонки и повторяли процесс биовыщелачивания. После второй стадии биовыщелачивания остатки биовыщелачивания анализировали как указано выше.
Процесс биовыщелачивания проводили в двух проворностях, в результатах работы представлены средние значения всех параметров.
Результаты исследований и их обсуждение
Параметры жидкой фазы при адаптации микробного консорциума к пиритным хвостам представлены в табл. 4. Как видно из представленных данных концентрация двухвалентного железа в процессе адаптации была практически равна нулю, а Eh был выше 800 мВ, рН постепенно снижался пока не стабилизировался на уровне 1,69.
Таблица 4 – Параметры жидкой фазы при адаптации микробного сообщества к пиритным хвостам при 22−25°С
| Сутки | Fe3+, г/л | Fe2+, г/л | ∑Fe, г/л | pH | Eh, мВ | Численность микроорганизмов, кл/мл ×107 |
| 0 | 0,49 | 0 | 0,49 | 2,27 | 749 | 2,60 |
| 5 | 1,19 | 0 | 1,19 | 1,79 | 830 | 53 |
| 10 | 1,54 | 0 | 1,54 | 1,72 | 860 | 80 |
| 15 | 1,54 | 0 | 1,54 | 1,69 | 891 | 72 |
| 20 | 1,82 | 0 | 1,82 | 1,69 | 880 | 100 |
Численность микроорганизмов в жидкой фазе достаточно быстро росла и за 20 суток адаптации выросла на два порядка. Все это указывает на то, что микробный консорциум достаточно быстро адаптировался к минеральному субстрату. После 20 суток адаптации микробный консорциум поддерживался в полупроточном режиме – с интервалом 25-30 суток заменяли 10-20% жидкой среды и вносили свежие навески отходов обогащения. При поддержании консорциума в полупроточном режиме параметры жидкой фазы были стабильными: концентрация ионов Fe3+ была в интервале 1,6-2,5 г/л, рН в диапазоне 1,5-1,7. После того, как можно стало возможным судить о стабильности состава микробного консорциума по стабильности физико-химических параметров жидкой фазы, была отобрана проба для анализа с помощью ДГГЭ фрагментов генов 16S рРНК. Анализ показал, что в консорциуме присутствовали как бактерии, так и археи. Были выявлены Acidithiobacillus ferrivorans, At. caldus, Leptospirillum ferriphilum, Ferroplasma acidiphilum и Acidiplasma sp. Следует отметить, что виды архей рода Acidiplasma порядка Thermoplasmatales практически не отличаются друг от друга по последовательности генов 16S рРНК, поэтому не могут быть идентифицированы с помощью использованного метода до вида, в отличие от остальных микроорганизмов сообщества [23].
Таким образом, микробный консорциум был успешно адаптирован к минеральному сырью. Достаточно большое для консорциума ацидофильных микроорганизмов, окисляющих сульфидные минералы видовое разнообразие, выявленное с помощью ДГГЭ, указывает на то, что используемый субстрат является благоприятным для развития различных ацидофильных микроорганизмов и относительно легко окисляется при невысоких температурах.
Перед началом процесса биовыщелачивания отходы флотации, помещенные в колонки, промывали 10 % (м/об.) раствором серной кислоты (1 л раствора на 1 кг отходов), чтобы удалить оксидные соединения, которые могли бы препятствовать контакту микроорганизмов с сульфидными минералами и избежать колебаний рН при проведении процесса биовыщелачивания. Усредненный состав продуктивных растворов кислотной промывки представлен в Таблице 5.
Таблица 5 – Содержание металлов в продуктивном растворе кислотного выщелачивания и степень извлечения из отходов обогащения
| Парметр | Fe3+ | Fe2+ | ∑ Fe | Cu2+ | Zn2+ |
| Содержание в растворе, г/л | 10,50 | 9,94 | 20,44 | 1,49 | 1,33 |
| Извлечение в раствор, % | – | – | 8,22 | 39,98 | 42,16 |
На смачивание 1 кг отходов обогащения ушло примерно 300 мл раствора кислоты. Поэтому объем продуктивного раствора составил примерно 70% от объема раствора кислоты. Как следует из представленных данных, при кислотном химическом выщелачивании удалось достигнуть достаточно высокой степени извлечения меди и цинка (39 и 42%, соответственно). Также стоит отметить, что pH продуктивного раствора значительно превышал pH 10% раствора серной кислоты, использованного для выщелачивания (0,8 и 0 соответственно). Это является следствием растворения оксидных минералов, содержащихся в отходах обогащения [24]. Достаточно высокое извлечение меди и цинка при кислотном выщелачивании может свидетельствовать о том, что часть данных металлов может содержаться в оксидных минералах. Несмотря на то, что анализ минерального состава выявил присутствие халькопирита и сфалерита (сульфидных минералов), можно предположить, что некоторая часть цветных металлов была представлена в аморфных оксидных соединениях, которые не могут быть выявлены рентгеноструктурным анализом [24]. Это подтверждается данными о том, что халькопирит трудно поддается выщелачиванию растворами кислот [25].
В колонках с отходами обогащения, подвергнутыми предварительному кислотному выщелачиванию, после слива продуктивных растворов кислотного выщелачивания был начат процесс биовыщелачивания. Для этого был использован микробный консорциум, адаптированный на первом этапе исследования. Жидкая фаза из сосудов, в которых культивировали микробный консорциум, была подвергнута отстаиванию и фильтрованию через бумажный фильтр, чтобы удалить из жидкой фазы минеральные частицы. Для биовыщелачивания отходов обогащения, смоченных в ходе кислотного выщелачивания использовали, 700 мл жидкой фазы на 1 кг отходов. Таким образом, соотношение твердой и жидкой фазы в процессе было 1:1. Аналогично была проведена 2 стадия биовыщелачивания.
Параметры продуктивных растворов приведены на рис. 2. Как видно из представленных данных pH раствора колебался на протяжении процесса биовыщелачивания (особенно сильно в первые 50 суток 1 стадии) (рис. 2а)
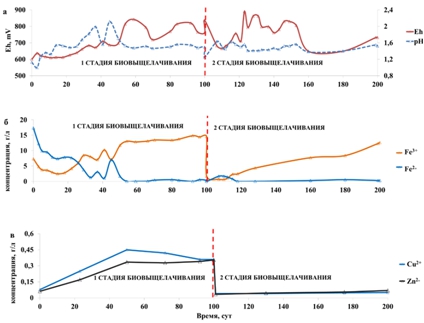
Рис. 2 – Параметры продуктивных растворов биовыщелачивания: А – Eh и рН; Б – концентрации ионов Fe3+ и Fe2+; В – концентрации ионов Cu2+ и Zn2+
Поэтому требовалось постоянное внесение дополнительного количества серной кислоты в растворы для поддержания pH в диапазоне 1,3-1,5. Средний расход серной кислоты составил 25 кг/т (кг кислоты на тонну сырья).
Концентрация двухвалентного железа в начале 1 стадии процесса биоокисления была достаточно высокой (почти 17 г/л), а затем постепенно снизилась практически до нуля и не поднималась выше десятых долей грамма. В начале 2 стадии процесса концентрация двухвалентного железа незначительно росла (до 1,68 г/л), а затем также снижалась до десятых долей грамма (рис. 2б). Это свидетельствует о том, что активность микроорганизмов в толще отходов обогащения в начале процесса оставалась невысокой, но затем постепенно увеличилась, очевидно, по мере их роста и колонизации поверхности минеральных частиц. Поскольку продуктивные растворы подавались на стадию регенерации (окисления железа микроорганизмами), то в колонки подавался раствор, содержащий только трехвалентное железо. По мере просачивания через слой отходов трехвалентное железо реагировало с сульфидными минералами и восстанавливалось. Это вело к постепенному увеличению суммарной концентрации железа в растворе. Так как в ходе биооксиления микроорганизмы развивались и в навеске отходов обогащения, они стали активно окислять двухвалентное железо не только в регенераторе, но и в перколяционных колонках, что и привело к снижению концентрации Fe2+ в продуктивных растворах. Концентрация трехвалентного железа постепенно росла и на 1 и 2 стадии процесса, достигнув в конце 1 и 2 стадий 14 и 12,5 г/л, соответственно. Изменению концентраций ионов Fe3+ и Fe2+ соответствовали колебания Eh (рис. 2а).
Концентрации цветных металлов возрастали в ходе процесса биоокисления и на 1 и на 2 стадии, но оставались при этом низкими. На первой стадии биовыщелачивания концентрации меди и цинка достигли 0,36 и 0,355 г/л, на второй лишь 0,05 и 0,069 г/л, соответственно.
После проведения биовыщелачивания был проанализирован состав твердых остатков биовыщелачивания и рассчитаны степени извлечения металлов. Эти данные представлены в табл. 6 и на рис. 3.
Из представленных данных видно, что значительная часть металлов была извлечена уже при кислотном выщелачивании. При этом первая стадия биовыщелачивания позволила извлечь дополнительно около 20% меди и 10% цинка, а извлечение меди и цинка на второй стадии было крайне незначительным. Нужно отметить, что выщелачивание сульфидного железа было достаточно значительным (11 и 25% на первой и второй стадии). Это указывает на достаточно активное биовыщелачивание пирита и на достаточно высокую активность биоокисления. Низкое извлечение цветных металлов на второй стадии позволяет сделать вывод о том, что минералы, которые относительно легко подвергаются кислотному или биовыщелачиванию были растворены в начале процесса, тогда как оставшаяся часть либо плохо подвергалась биоокислению, либо находилась в сростках с минералами, препятствующими биологическому либо химическому выщелачиванию.
Таблица 6 – Содержание металлов твердых остатках биовыщелачивания и выход твёрдой фазы
| Содержание, % | Выход твердой фазы, % | |||
| Feобщ. | Feсульфид. | Cu | Zn | |
| 14,7 | 13,4 | 0,11 | 0,12 | 88,4 |
| 12,9 | 11,8 | 0,1 | 0,12 | 84,5 |
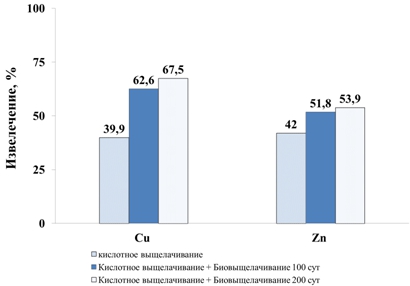
Рис. 3 – Извлечение меди и цинка в процессе кислотного и биовыщелачивания
Результаты данной работы позволили оценить перспективность технологии кучного биовыщелачивания для переработки лежалых отходов обогащение некоторых типов. Проба отходов, использованная в данной работе (как и многие отходы флотации полиметаллических руд вообще [26]), характеризовалась содержанием цветных металлов сходным с содержанием таковых в бедных рудах, перерабатываемых с помощью кучного биовыщелачивания (табл. 1). При этом в ней содержалось намного больше железа в сульфидных и оксидных минералах, чем обычно содержится в таких рудах. Поэтому в продуктивных растворах выщелачивания присутствовала высокая концентрация железа, намного превышающая концентрацию цветных металлов. Это может создавать определенные препятствия для извлечения металлов из продуктивных растворов [28]. Это позволяет сделать вывод о необходимости разработки модификаций технологии кучного биовыщелачивания для применения их для переработки по крайней мере некоторых типов отходов обогащения. Это должно стать предметом будущих исследований, так как отходы обогащения являются весьма перспективным техногенным сырьем.
| Финансирование
Работа была выполнена в рамках государственного задания при поддержке Министерства науки и высшего образования Российской Федерации |
Funding
The work was carried out as part of a government task with the support of the Ministry of Science and Higher Education of the Russian Federation. |
| Конфликт интересов
Не указан. |
Conflict of Interest
None declared. |
Список литературы / References
- Johnson D. B. Biomining – biotechnologies for extracting and recovering metals from ores and waste materials / D. B. Johnson // Current Opinion in Biotechnology. — 2014. — V. 30. — P. 24–31. — doi: 10.1016/j.copbio.2014.04.008
- Кондратьева Т. Ф. Микроорганизмы в биогеотехнологиях переработки сульфидных руд / Т. Ф. Кондратьева, А. Г. Булаев, М. И. Муравьев — Москва: Наука, 2015. — 212 с.
- Rawlings D. E. Heavy metal mining using microbes / D. E. Rawlings // Annual Review of Microbiology. — 2002. — V. 56. — P. 65–91. — doi: 10.1146/annurev.micro.56.012302.161052
- Каравайко Г. И. Биогеотехнология металлов. Практическое руководство / Г. И. Каравайко, Д. Росси, А. Агате и др. —Москва: Центр международных проектов ГКНТ, 1989. —375 с.
- van Aswegen P.C., van Niekerk J., Olivier W. The BIOXΤΜ process for the treatment of refractory gold concentrate: Biomining / P. C. van Aswegen, J. van Niekerk, W. Olivier; edited by D.E.Rawlings, B.D. Johnson. — Berlin-Heidelberg: Springer Verlag, 2007. — P. 1–35. — doi: 10.1007/978-3-540-34911-2
- Gentina J. C. Application of bioleaching to copper mining in Chile / J. C. Gentina, F. Acevedo // Electronic Journal of Biotechnology. — 2013. — V. 16. Is. 3. — doi: 10.2225/vol16-issue3-fulltext-12
- Халезов Б. Д. Кучное выщелачивание медных и медно-цинковых руд (отечественный опыт): монография / Б. Д. Халезов; под ред. А. И. Окунева. — Екатеринбург: РИО УрО РАН, 2013. — 348 с
- Mineral commodity summaries 2015 // U.S. Geological Survey, 2015 — 196 p., — doi.org/10.3133/70140094.
- Kondrat’eva T. F. Percolation bioleaching of copper, zinc and gold recovery from flotation tailings of the sulfide complex ores of the Ural region, Russia / T. F. Kondrat’eva, T. A. Pivovarova, A. G. Bulaev and others // Hydrometallurgy. — 2012. — V. 111−112. — P. 82–86. — doi: 10.1016/j.hydromet.2011.10.007
- Sagdieva M. G., Borminskiy S. I., Mavjudova A. M., Cherkasova G. V., Scott B. Bioleaching of Whitehorse copper tailing with use of tank method / M. G. Sagdieva, S. I. Borminskiy, A. M. Mavjudova and others // Proceedings of the 19th International Biohydrometallurgy Symposium (IBS 2011) 18−22 September 2011, Changsha, China / Central South university. — Changsha, 2011. — P. 593–596.
- Черкасова Д. В. Биологическое выщелачивание отходов флотации сульфидных медно-цинковых руд в перколяционной установке / Д. В. Черкасова, М. Д. Бакаева, С. П. Четвериков и др. // Биотехнология. — 2012. — № 6. — С. 61–69.
- Четверикова Д. В. Биологическое выщелачивание цинка и меди из отходов флотацинного обогащения сульфидных руд Бурибаевского горно-обогатительного комбината в перколяционной установке / Д. В. Четверикова, М. Д. Бакаева, С. П. Четвериков и др. // Известия Самарского научного центра Российской академии наук. — 2013. — Т. 15. — № 3 (5). — С. 1690–1693.
- Грановская Н. В. Техногенные месторождения полезных ископаемых / Н. В. Грановская, А. В. Наставкин, Ф. В. Мещанинов. — Ростов-на-Дону: ЮФУ, 2013. — 93 с.
- Бурдзиева О. Г. Эколого-экономические аспекты хранения отходов горного производства / О. Г. Бурдзиева, Е. В. Шевченко // Горный информационно-аналитический бюллетень. — 2010. — №8. — С. 37−42.
- Орехова Н. Н. Эколого-экономические аспекты комплексной переработки техногенно- го гидроминерального сырья / Н. Н. Орехова, И. В. Шадрунова // Горный информационно-аналитический бюллетень. — 2014. — Т. S — С. 161−179
- Соловьянов А. А. Прошлый (накопленный) экологический ущерб: проблемы и решения. 1. Источники и виды загрязнения / А. А. Соловьянов // Экологический вестник России. — 2015. — № 3. — С. 20−26.
- Parada P. Biomass production and inoculation of industrial bioleaching processes / P. Parada, P. Morales, R. Collao and others // Advanced Materials Research. — 2013. — V. 825. — P. 296−300. — doi: 10.4028/www.scientific.net/AMR.825.296
- Резников А.А. Методы анализа природных вод / А. А. Резников, Е. П. Муликовская, И. Ю. Соколов. — Москва: Недра, 1970. — 140 с.
- Филиппова Н. А. Фазовый анализ руд и продуктов их переработки / Н. А. Филипова. — Москва: Химия, 1975. — 279 с.
- Zaulochnyi P. A. Two-stage process of bacterial-chemical oxidation of refractory pyrite-arsenopyrite gold-bearing concentrate / P. A. Zaulochnyi, A. G. Bulaev, E. E. Savari and others // Applied biochemistry and microbiology. — 2011. — V. 47. — № 9. — P. 833–840. — doi: 10.1134/S0003683811090080
- Maniatis T. Molecular Cloning: A Laboratory Manual / T. Maniatis, E. Fritsch, D. M. Sambrook. — New York: Cold Spring Harbor Laboratory, 1982.— 545 p.
- Tamura K. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0 / K. Tamura, G. Stecher, D. Peterson and others // Molecular Biology and Evolution. — 2013. — V. 30. — P. 2725–2729. — doi: 10.1093/molbev/mst197
- Булаев А. Г. Применение метода REP-PCR для типирования близкородственных штаммов эвриархей рода Acidiplasma (Thermoplasmatales) / А. Г. Булаев, М. В. Сухачева, Б. Б. Кузнецов // Микробиология. — 2016. — Т. 85. — № 2. — C. 223−226. — doi: 10.1134/S0026261716020041
- Lottermoser B.G. Mine Wastes. Second Edition. / B. G. Lottermoser. — Berlin-Heidelberg: Springer-Verlag, 2007. — 304 p. — doi: 10.1007/978-3-540-48630-5
- Watling H. R. The bioleaching of sulphide minerals with emphasis on copper sulphides — A review / H. R. Watling // Hydrometallurgy. — 2006. — V. 84. — P. 81–108. — doi: 10.1016/j.hydromet.2006.05.001
- Марченко Н.В. Металлургия тяжелых цветных металлов / Н. В. Марченко, Е. П. Вершинина, Э. М. Гильдебрандт. — Красноярск: ИПК СФУ, 2009. — 394 c.
- Kordosky G. A. Copper recovery using leach/solvent extraction/electrowinning technology / G. A. Kordosky. // The Journal of The South African Institute of Mining and Metallurgy. — 2002. — V. 102. — Is. 8. — P. 445−450. — doi: hdl.handle.net/10520/AJA0038223X_2713
Список литературы на английском языке / References in English
- Johnson D. B. Biomining – biotechnologies for extracting and recovering metals from ores and waste materials / D. B. Johnson // Current Opinion in Biotechnology. — 2014. — V. 30. — P. 24–31. — doi: 10.1016/j.copbio.2014.04.008
- Kondrat’eva T. F. Mikroorganizmy v biogeotekhnologiyah pererabotki sul’fidnyh rud [Microorganisms in biotechnologies of sulfide ores processing] / Т. F. Kondrat’eva , A. G. Bulaev, M. I. Muravyov — Moscow: Nauka, 2015. —212 p. [in Russian]
- Rawlings D. E. Heavy metal mining using microbes / D. E. Rawlings // Annual Review of Microbiology. — 2002. — V. 56. — P. 65–91. — doi: 10.1146/annurev.micro.56.012302.161052
- Karavaiko G. I. Biogeotekhnologiya metallov. [Biogeotechnology of metals] / G. I. Каравайко, G. Rossi, A. Agate and others — Moscow: Centre for International Projects, 1989. —375 p.
- van Aswegen P.C., van Niekerk J., Olivier W. The BIOXΤΜ process for the treatment of refractory gold concentrate: Biomining / P. C. van Aswegen, J. van Niekerk, W. Olivier; edited by D.E.Rawlings, B.D. Johnson. — Berlin-Heidelberg: Springer Verlag, 2007. — P. 1–35. — doi: 10.1007/978-3-540-34911-2
- Gentina J. C. Application of bioleaching to copper mining in Chile / J. C. Gentina, F. Acevedo // Electronic Journal of Biotechnology. — 2013. — V. 16. Is. 3. — doi: 10.2225/vol16-issue3-fulltext-12
- Khalezov B. D. Kuchnoe vyshchelachivanie mednyh i medno-cinkovyh rud (otechestvennyj opyt): monografiya [Heap leaching of copper and copper-zinc ores (domestic experience): Monograph] / B.D. Khalezov; edited by A. I. Okunev. — Yekaterinburg: RIO UrO RAN, 2013. — 348 p. [in Russian]
- Mineral commodity summaries 2015 // U.S. Geological Survey, 2015 — 196 p., — doi.org/10.3133/70140094.
- Kondrat’eva T. F. Percolation bioleaching of copper, zinc and gold recovery from flotation tailings of the sulfide complex ores of the Ural region, Russia / T. F. Kondrat’eva, T. A. Pivovarova, A. G. Bulaev and others // Hydrometallurgy. — 2012. — V. 111−112. — P. 82–86. — doi: 10.1016/j.hydromet.2011.10.00
- Sagdieva M. G., Borminskiy S. I., Mavjudova A. M., Cherkasova G. V., Scott B. Bioleaching of Whitehorse copper tailing with use of tank method / M. G. Sagdieva, S. I. Borminskiy, A. M. Mavjudova and others // Proceedings of the 19th International Biohydrometallurgy Symposium (IBS 2011) 18−22 September 2011, Changsha, China / Central South university. — Changsha, 2011. — P. 593–596.
- Cherkasova D. V. Biologicheskoe vyshchelachivanie othodov flotacii sul’fidnyh medno-cinkovyh rud v perkolyacionnoj ustanovke [Biological leaching of zinc and copper from the sulphidic ores flotation waste of buribay concentrating industrial complex in the percolator] / D. V. Cherkasova, M. D. Bakaeva, S. P. Chetverikov and others // Biotechnology in Russia. — 2012. — № 6. — P. 61–69. [in Russian]
- Chetverikova D. V. Biologicheskoe vyshchelachivanie cinka i medi iz othodov flotacinnogo obogashcheniya sul’fidnyh rud Buribaevskogo gorno-obogatitel’nogo kombinata v perkolyacionnoj ustanovke [Biological leaching of zinc and copper from the sulphidic ores flotation waste of Buribay concentrating industrial complex in the percolator] / D. V. Chetverikova, M. D. Bakaeva, S. P. Chetverikov and others // Izvestia RAS SamSC. — 2013. — Т. 15. — № 3 (5). — P. 1690–1693. [in Russian]
- Granovskaya N. V. Tekhnogennye mestorozhdeniya poleznyh iskopaemyh [Technogenic mineral deposits] / N. V. Granovskaya, A. V. Nastavkin, F. V. Meshchaninov. — Rostov-on-Don: SFU, 2013. — 93 p. [in Russian
- Burdzieva O. G. Ehkologo-ehkonomicheskie aspekty hraneniya othodov gornogo proizvodstva [Ecological and economic aspects of processing of mining wastes storage] / O. G. Burdzieva, E. V. Shevchenko // Mining informational and analytical bulletin. — 2010. — №8. — P. 37−42. [in Russian]
- Orekhova N. N. EHkologo-ehkonomicheskie aspekty kompleksnoj pererabotki tekhnogenno- go gidromineral’nogo syr’ya [Ecological and economic aspects processing of technogenic hydromineral raw materials] / I. V. Shadrunova, N. N. Orekhova // Mining informational and analytical bulletin. — 2014. — №. S1. — P. 161−179. [in Russian
- Solov’yanov A. А. roshlyj (nakoplennyj) ehkologicheskij ushcherb: problemy i resheniya. 1. Istochniki i vidy zagryazneniya [Accumulated environmental damage: problems and solutions. 1. Sources and types of pollution] / A. A. Solov’yanov // Ecological Bulletin of Russia. — 2015. — № 3. — P. 20−26. [in Russian]
- Parada P. Biomass production and inoculation of industrial bioleaching processes / P. Parada, P. Morales, R. Collao and others // Advanced Materials Research. — 2013. — V. 825. — P. 296−300. — doi: 10.4028/www.scientific.net/AMR.825.296
- Reznikov A.A. Metody analiza prirodnyh vod [Metody analiza prirodnyh vod] / A. A. Reznikov, E. P. Mulikovskaya, I. Y. Sokolov. — Moscow: Nedra, 1970. — 140 p. [in Russian]
- Filippova N. A. Phazovyj analiz rud I produktov ih pererabotki [Phase analysis of ores and products thereof] / N. A. Filippova. — Moscow: Chimia, 1975. — 279 p. [in Russian]
- Zaulochnyi P. A. Two-stage process of bacterial-chemical oxidation of refractory pyrite-arsenopyrite gold-bearing concentrate / P. A. Zaulochnyi, A. G. Bulaev, E. E. Savari and others // Applied biochemistry and microbiology. — 2011. — V. 47. — № 9. — P. 833–840. — doi: 10.1134/S0003683811090080
- Maniatis T. Molecular Cloning: A Laboratory Manual / T. Maniatis, E. Fritsch, D. M. Sambrook. — New York: Cold Spring Harbor Laboratory, 1982.— 545 p.
- Tamura K. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0 / K. Tamura, G. Stecher, D. Peterson and others // Molecular Biology and Evolution. — 2013. — V. 30. — P. 2725–2729. — doi: 10.1093/molbev/mst197
- Bulaev A. G. Primenenie metoda REP-PCR dlya tipirovaniya blizkorodstvennyh shtammov ehvriarhej roda Acidiplasma (Thermoplasmatales) [Typing of the closely related strains of euryarchaeal genus Acidiplasma (Thermoplasmatales) using REP-PCR DNA fingerprinting] / A. G. Bulaev, M. V. Sukhacheva, B. B. Kuznetsov // Microbiology. — 2016. — V. 85. — № 2. — P. 253−256. — doi: 10.1134/S0026261716020041
- Lottermoser B.G. Mine Wastes. Second Edition. / B. G. Lottermoser. — Berlin-Heidelberg: Springer-Verlag, 2007. — 304 p. — doi: 10.1007/978-3-540-48630-5
- Watling H. R. The bioleaching of sulphide minerals with emphasis on copper sulphides — A review / H. R. Watling // Hydrometallurgy. — 2006. — V. 84. — P. 81–108. — doi: 10.1016/j.hydromet.2006.05.001
- Marchenko N. V. Metallurgiya tyazhelyh cvetnyh metallov [Metallurgy of heavy non-ferrous metals] / N. V. Marchenko, E. P. Vershinina, E. M. Hildebrandt — Krasnoyarsk: IPK SFU, 2009. — 394 p.
- Kordosky G. A. Copper recovery using leach/solvent extraction/electrowinning technology / G. A. Kordosky. // The Journal of The South African Institute of Mining and Metallurgy. — 2002. — V. 102. — Is. 8. — P. 445−450. — doi: hdl.handle.net/10520/AJA0038223X_2713




