Материал и методы: в открытое контролируемое исследование был включен 21 больной АГ, ассоциированной с СД 2-го типа (15 женщин, средний возраст 50±6 лет). Всем больным исходно и через 6 мес. лечения проводили суточное мониторирование артериального давления (СМАД), лабораторные тесты (гликозилированный гемоглобин (HbA1C), липидный спектр крови), магнитно-резонансную томографию (МРТ) головного мозга и ультразвуковое сканирование сонных артерий. После исходного обследования пациенты в течение 6 мес. получали селективный бета-блокатор бисопролол в стартовой дозе 5 мг, которую увеличивали до 10–15 мг/сут. Средние дозы бисопролола составили 7,25 мг (5–15 мг/сут, n=21).
Результаты исследования: через полгода лечения бисопрололом было отмечено значимое снижение АД как по данным офисных измерений (на 17/8,7 мм рт. ст., р
Заключение: 6-месячная терапия бисопрололом больных АГ, ассоциированной с СД 2-го типа, сопровождается выраженным антигипертензивным эффектом, уменьшением толщины стенки сонных артерий и обратным развитием доклинических МРТ-признаков структурных повреждений головного мозга в виде уменьшения выраженности ликвородинамических расстройств.
Ключевые слова: артериальная гипертония, сахарный диабет, суточное мониторирование АД, МРТ головного мозга, нарушения ликвородинамики, сонные артерии, бисопролол, Конкор.
Для цитирования: Фальковская А.Ю., Мордовин В.Ф., Белокопытова Н.В., Усов В.Ю., Сухарева А.Е., Рябова Т.Р., Шарыпова Н.Г. Антигипертензивная и церебропротективная эффективность бисопролола у больных артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа // РМЖ. 2018. №11(I). С. 7-11
A.Yu. Falkovskaya1, V.F. Mordovin1, N.V. Belokopytova2, Yu.V. Usov1, A.E. Suhareva1, T.R. Ryabova1, N.G. Sharypova1
1 Research Institute for Cardiology, Tomsk National Research Medical Center
2 Bureau of Medical and Social Expertise in the Tomsk Region
Aim: to study the interaction of the long-term therapy with bisoprolol on blood pressure, early structural brain damage and wall thickness of carotid arteries in patients with hypertension (H) combined with type 2 diabetes mellitus (DM).
Patients and Methods: 21 patients with H combined with type 2 DM (15 women, mean age 50±6 years) were included in the open controlled trial. Ambulatory blood pressure monitoring (ABPM), laboratory tests (glycosylated hemoglobin (HbA1C), blood lipid spectrum), magnetic resonance imaging (MRI) of the brain and sonography of carotid arteries were conducted to all patients initially and after 6 months of treatment. After the initial examination, the patients received selective beta-blocker bisoprolol at a starting dose of 5 mg, which was increased to 10–15 mg/day. The average doses of bisoprolol amounted to 7.25 mg (5–15 mg/day, n=21).
Results: a significant decrease in blood pressure was manifested in both office measurements (17/8.7 mm Hg, p<0.0001) and ABPM results (-17.5/-12.1 mm Hg, p<0.0001) after six months of treatment with bisoprolol. The increased blood pressure load (systolic/diastolic) decreased by an average of 38.2/37.7%, respectively. Target blood pressure values were achieved in 71% of patients. Besides, a significant decrease in the thickness of intima-media complex of carotid arteries (from 0.75±0.06 to 0.68±0.14 mm, p=0.02) was determined, and the MRI results showed an essential decrease in the linear dimensions of the ventricular system of the brain and subarachnoid spaces, the severity of which depended on the degree of average values reduction of the ABPM parameters. Relevant changes in HbA1C level and lipid spectrum parameters were not manifested.
Conclusion: a 6-month therapy with bisoprolol for patients with hypertension combined with type 2 DM is followed by a pronounced antihypertensive effect, decrease in the wall thickness of the carotid arteries and involution of non-clinical MRI indications of structural brain damage in the form of reduced severity of liquor-dynamic disturbances.
Key words: hypertension, diabetes mellitus, ambulatory blood pressure monitoring, brain MRI, liquor-dynamic disturbances, carotid arteries, bisoprolol, Concor.
For citation: Falkovskaya A.Yu., Mordovin V.F., Belokopytova N.V. et al. Antihypertensive and cerebral protective efficacy of bisoprolol in patients with hypertension combined with type 2 diabetes mellitus // RMJ. 2018. № 11(I). P. 7–11.
Статья посвящена изучению антигипертензивной и церебропротективной эффективности бисопролола у больных артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа. Показано, что 6-месячная терапия бисопрололом сопровождается выраженным антигипертензивным эффектом, уменьшением толщины стенки сонных артерий и обратным развитием доклинических МРТ-признаков структурных повреждений головного мозга.
Актуальность
Артериальная гипертония (АГ) остается одним из самых распространенных заболеваний сердечно-сосудистой системы и лидирующей причиной кардиоваскулярных осложнений [1]. Согласно результатам эпидемиологического исследования ЭССЕ-РФ распространенность повышенного артериального давления (АД) в среднем по всем регионам России, включенным в исследование, составила 33,8±0,4% [2]. У каждого четвертого-пятого пациента АГ сочетается с сахарным диабетом (СД) 2-го типа [3], что ассоциируется с 2–3-кратным возрастанием риска сердечно-сосудистых осложнений [4], которое пропорционально степени повышения АД [5].
Церебрососудистые осложнения занимают 2-е место в структуре общей смертности и являются лидирующей причиной инвалидности во всем мире [5, 6]. К предикторам мозговых инсультов относятся ранние структурные повреждения головного мозга, выявляемые при проведении нейровизуализирующих исследований. Немаловажно, что хроническая церебрососудистая патология тесно связана не только с острыми мозговыми катастрофами, но и с развитием когнитивных расстройств [7].
Среди ранних церебрососудистых изменений, наиболее часто выявляемых при проведении магнитно-резонансной томографии (МРТ) головного мозга, следует отметить нарушения ликвородинамики, которые характеризуются увеличением линейных размеров боковых желудочков и субарахноидальных пространств [8]. Патогенез развития гидроцефалии сложен и недостаточно изучен. Причинами гидроцефалии служат повышенное образование ликвора, снижение его резорбции либо нарушение проходимости путей циркуляции ликвора. АГ, СД и гиперхолестеринемия, помимо возраста и заболевания мозговых оболочек, считаются основными факторами риска гидроцефалии [8]. Клиническая значимость нарушений ликвородинамики определяется, прежде всего, тем, что длительное течение внутричерепной гипертензии в большинстве случаев сопровождается атрофией вещества головного мозга с развитием когнитивного дефицита [9]. Вместе с тем расширение ликворных пространств может носить заместительный характер вследствие первичной утраты вещества головного мозга. Не менее важно, что в большинстве случаев ликвородинамические нарушения сочетаются с другими патологическими структурными изменениями головного мозга, в т. ч. цереброишемического характера [10]. К числу предикторов мозгового инсульта относится также увеличение толщины стенки мозговых артерий [11], в т. ч. у больных СД [12].
Одной из причин частого сочетания АГ и СД считается симпатическая гиперактивация [13]. Более того, гиперсимпатикотония имеет самостоятельное патогенетическое значение в поражении органов-мишеней, не зависящее от уровня АД [14]. При этом развивается гипертрофия гладкомышечных клеток, которая сопровождается утолщением сосудистой стенки, сосудистым ремоделированием и ухудшением кровоснабжения органов-мишеней [13, 14]. В настоящее время установлено, что больные с сочетанием АГ и СД имеют максимальную степень симпатической гиперактивности по сравнению с больными с изолированной АГ или СД без АГ [15], что может определять более высокую частоту органных повреждений у данной категории пациентов. В связи с этим снижение симпатического тонуса можно рассматривать в качестве самостоятельной терапевтической мишени, однако данных по этому вопросу к настоящему времени по-прежнему недостаточно.
Классическими препаратами с симпатолитическим эффектом являются бета-адреноблокаторы (БАБ), которые дополнительно блокируют секрецию ренина в юкста-гломерулярном аппарате почек и таким образом снижают активность ренин-ангиотензин-альдостероновой системы (РААС) [16–19]. Однако в настоящее время данные о церебропротективных эффектах БАБ немногочисленны, а порой и противоречивы [5, 20]. Поскольку бисопролол обладает очень высокой селективностью в отношении бета-1-адренорецепторов и является метаболически нейтральным, его использование может иметь преимущества перед другими препаратами этой группы для больных, страдающих СД [21]. Вместе с тем вопросы церебропротекции при использовании бисопролола у больных АГ, ассоциированной с СД, остаются недостаточно изученными.
Гипотеза исследования. В основу настоящего исследования положена гипотеза о том, что снижение симпатического тонуса при использовании селективного бета-блокатора бисопролола у больных АГ, ассоциированной с СД 2-го типа, способно оказывать не только антигипертензивное действие, но и сопровождаться обратным развитием ранних структурных изменений головного мозга и магистральных церебральных артерий.
Цель исследования: изучить влияние длительной терапии бисопрололом на показатели артериального давления, ранние структурные повреждения головного мозга и толщину стенки сонных артерий у больных АГ, ассоциированной с СД 2-го типа.
Материал и методы
В открытое контролируемое исследование был включен 21 больной АГ, ассоциированной с СД 2-го типа (15 женщин, средний возраст 50±6 лет). Клиническая характеристика обследованных больных представлена в таблице 1. Критериями включения в исследование были: верифицированный СД 2-го типа у лиц обоего пола в возрасте от 30 до 80 лет; офисное АД >140/85 мм рт. ст., 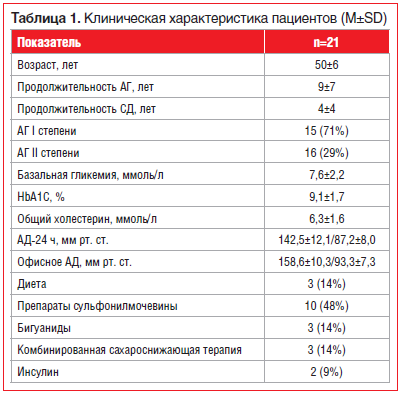
подписанное информированное согласие на участие в исследовании; отсутствие выраженных острых и хронических заболеваний, определяющих тяжесть состояния пациентов и требующих медикаментозной коррекции, а также отсутствие неврологической симптоматики, черепно-мозговых травм и нейроинфекций в анамнезе. Из исследования исключали больных с уровнем гликозилированного гемоглобина (HbA1c) >10%; симптоматической АГ; АГ III степени; кризовым течением АГ; скоростью клубочковой фильтрации 2; беременностью; наличием признаков обострения хронической ишемической болезни сердца (ИБС) (острый инфаркт миокарда, нестабильная стенокардия); перенесенными острыми нарушениями мозгового кровообращения и транзиторными ишемическими атаками вне зависимости от срока давности; нарушениями протокола исследования; при отказе пациента от участия в исследовании и наличии абсолютных противопоказаний к применению БАБ.
Среди пациентов, включенных в исследование, хроническая ИБС была у 5 больных, которые исходно и на протяжении всего исследования принимали дезагреганты и статины. Другой сердечно-сосудистой терапии пациенты исследования не получали. Режим сопутствующей терапии у всех пациентов в течение всего исследования не менялся.
Всем больным исходно и через 6 мес. лечения проводили суточное мониторирование АД (СМАД), лабораторные тесты (HbA1C, липидный спектр крови), МРТ головного мозга и ультразвуковое сканирование сонных артерий.
СМАД выполняли системами автоматического измерения АД SpaceLabs 90207 (SpaceLabs, Inc., USA), ABPM-04 (Meditech, Hungary), CardioTens 0364 (Meditech Kft, Hungary), основанными на осциллометрическом методе измерения АД.
МРТ головного мозга проводили на низкопольном магнитно-резонансном томографе «Magnetom-OPEN» («Siemens AG», Германия), имеющем резистивный магнит с силой магнитного поля 0,2 Тесла. Для получения Т1— и Т2-взвешенных изображений использовалась импульсная последовательность спин-эхо. Для Т1-взвешенных изображений, выполненных в аксиальной, параллельно орбитомеатальной линии, и сагиттальной плоскостях, применялись параметры: TR=450 мсек., TE=15 мсек., угол α=70°. Изображения в режиме Т2 имели следующие параметры: TR=6000 мсек., TE=117 мсек. и проводились в аксиальной плоскости. Толщина срезов составляла 6 мм.
Протокол проведения МРТ головного мозга включал получение аксиальных и сагиттальных срезов в режиме спин-эхо по Т1, использовавшихся для клинической оценки поражения отдельных анатомических структур мозга, а также аксиальных по Т2 — для проведения расчетов объема повреждения мозга по настоящей методике. При этом во всех случаях параметры Т2-взвешенного исследования были неизменными. Определение нарушений ликвородинамики заключалось в оценке линейных размеров ликворопроводящих структур, включавшей в себя измерение в аксиальной плоскости в режиме Т2 поперечных размеров тел, передних и задних рогов боковых желудочков, тела III желудочка и субарахноидального пространства во фронтальных, париетальных и окципитальных областях. За нормальные размеры структур головного мозга принимались данные группы здоровых лиц, для которых в норме ширина боковых желудочков не превышала 1,5 см, а поперечный размер субарахноидальных пространств составлял не более 0,25 см.
Исследование структурных изменений сонных артерий проводили на ультразвуковой диагностической системе «ACUSON» 128 XP/10 (США) с использованием линейного датчика 10 МГц по общепринятой методике.
Уровень гликемии определяли в плазме венозной крови ферментным (глюкозооксидазным) методом с использованием стандартных наборов («BIOCON», Germany). Концентрацию выражали в ммоль/л. Уровень HbA1C определяли ионообменным методом с помощью стандартных наборов («BIOCON», Germany). Исследование липидного спектра крови проводили энзиматическим колориметрическим методом с помощью стандартных наборов («BIOCON», Germany).
После исходного обследования пациенты в течение 6 мес. получали селективный БАБ бисопролол (оригинальный препарат Конкор, фирма «Мерк», Германия) в стартовой дозе 5 мг, которую увеличивали до 10–15 мг/сут. Средние дозы бисопролола составили 7,25 мг (5–15 мг/сут, n=21).
Титрация дозы бисопролола проводилась каждые 2 нед. в течение первых 3 мес. Для достижения целевых уровней АД через 3 мес. терапии дополнительное назначение диуретиков потребовалось 9 (43%) больным.
Статистический анализ данных был выполнен с использованием пакета программ Statistica ver. 10.0 for Windows. Данные представлены в виде средней величины (M) и стандартного отклонения (SD): M±SD. Определение согласия с нормальным законом распределения признаков проверяли по критериям Колмогорова — Смирнова с поправкой Лиллиефорса, Шапиро — Уилка. Оценку однородности генеральных дисперсий проводили с помощью теста Левена. При нормальном распределении применяли параметрические методы анализа, при отсутствии нормального распределения — непараметрические методы. Сравнительный анализ двух зависимых групп выполняли с помощью параметрического t-критерия Стьюдента или непараметрического критерия Вилкоксона и критерия знаков. Для поиска возможных взаимосвязей использовали корреляционный анализ количественных признаков (параметрический корреляционный анализ Пирсона и непараметрический метод Спирмена). Критическим уровнем значимости для всех используемых процедур статистического анализа считали p
Результаты
Через полгода лечения бисопрололом было отмечено значимое снижение АД как по данным офисных измерений (на 17±4,4/10±2,5 мм рт. ст., р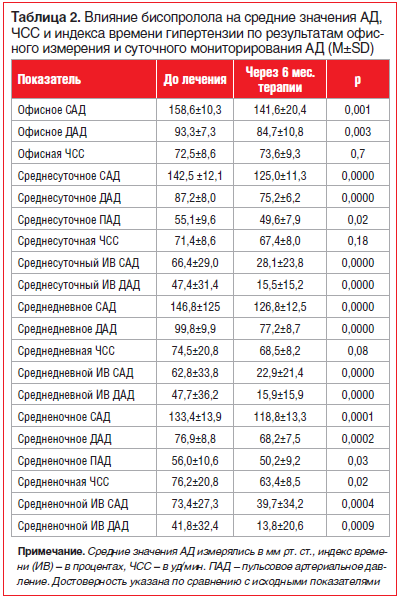
Кроме того, было выявлено достоверное уменьшение толщины комплекса интима-медиа внутренних сонных артерий (от 0,75±0,06 до 0,68±0,14 мм, p=0,02), а по результатам МРТ головного мозга имело место существенное уменьшение линейных размеров желудочковой системы и субарахноидальных пространств (табл. 3).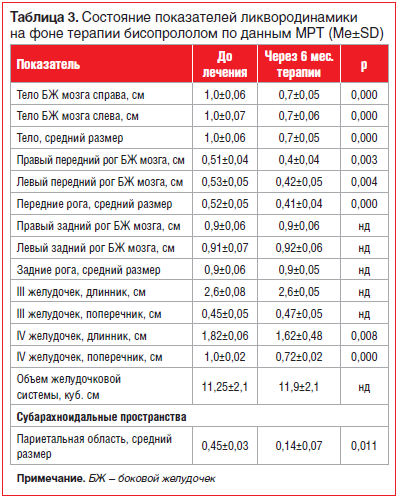
Редукция линейных размеров боковых желудочков имела прямую связь с положительной динамикой среднесуточных значений систолического АД (САД) (r=0,438, р=0,046) и диастолического АД (ДАД) (r=0,476, р=0,028), среднедневного САД (r=0,477, р=0,029), с уменьшением продолжительности САД за сутки (r=0,519, р=0,016). Улучшение суточных профилей как САД (r=-0,449, р=0,012), так и ДАД (r=-0,428; р=0,018) сопровождалось сокращением суммарного объема желудочков головного мозга. Уменьшение размеров субарахноидальных пространств также зависело от увеличения суточного индекса САД (r=-0,332; p=0,018). Таким образом, благоприятное воздействие проводимой терапии на состояние ликвородинамики во многом определяется степенью антигипертензивного эффекта и его стабильностью в течение суток.
Значимых изменений уровня HbA1C и параметров липидного спектра отмечено не было (от 9,1±1,7 до 8,8±1,1%, p=0,3 для HbA1С; от 6,3±1,6 до 6,3±1,7 ммоль/л, p=0,7 для общего холестерина (ХС); от 3,4±1,8 до 3,2±1,9 ммоль/л, p=0,5 для триглицеридов; от 3,7±0,8 до 3,4±0,5 ммоль/л, p=0,2 для ХС липопротеинов низкой плотности; от 0,9±0,3 до 1,1±0,4 ммоль/л, p=0,4 для ХС липопротеинов высокой плотности).
Обсуждение
Антигипертензивная и антиишемическая эффективность БАБ, в т. ч. бисопролола, к настоящему времени достаточно хорошо изучена [16–19]. Полученные нами результаты подтверждают значимое снижение АД под влиянием бисопролола у больных АГ, ассоциированной с СД 2-го типа.
Что касается церебропротективной эффективности антигипертензивной терапии, то согласно современным данным она определяется, прежде всего, степенью снижения АД, а при выборе препарата следует ориентироваться на сопутствующую патологию [22]. Учитывая существенную роль симпатической гиперактивации в формировании повреждений органов-мишеней, снижение симпатического тонуса позволяет рассчитывать на обратное развитие органных повреждений, в т. ч. ранних церебрососудистых изменений.
Коррекция гиперсимпатикотонии возможна как немедикаментозными, так и медикаментозными способами. Так, к настоящему времени получены убедительные доказательства симпатомодулирующих эффектов низкокалорийных диетических режимов и регулярных программ физических упражнений, что нашло отражение в современных рекомендациях по лечению АГ [22]. Кроме того, активно изучаются инвазивные методы снижения симпатического тонуса [23], однако согласно последним рекомендациям [22] в настоящее время инвазивные методики могут использоваться только в рамках научных исследований, до получения убедительных результатов их эффективности и безопасности. Среди фармакологических подходов к снижению симпатической гиперактивации особое место занимают БАБ как классические симпатолитики. Механизмом действия БАБ является снижение биодоступности катехоламинов, что предотвращает неблагоприятное действие последних на ткани и органы [19]. Кроме того, БАБ оказывают антирениновое действие, а активация РААС является важным фактором в развитии АГ и поражении органов-мишеней [19]. Помимо влияния на частоту сердечных сокращений (ЧСС), сердечный выброс и активность РААС, бета-блокаторы нормализуют барорефлексы аорты и синокаротидного синуса, уменьшают симпатический тонус центральной нервной системы, снижают венозный возврат и объем плазмы крови, повышают эластичность сосудистой стенки, а также ограничивают негативное действие стрессорных факторов, приводящих к повышению выброса катехоламинов [24]. Несмотря на хорошо изученную антигипертензивную и антиишемическую эффективность бисопролола в крупных рандомизированных клинических исследованиях [25], сведения о влиянии БАБ на церебрососудистую патологию не столь многочисленны и порой противоречивы. В исследовании UKPDS (1998), ставшем одним из самых крупных в области первичной профилактики осложнений СД, было доказано, что строгий контроль АД существенно снижает риск возникновения осложнений у пациентов с СД 2-го типа, в т. ч.
инфаркта миокарда, инсульта, заболеваний периферических сосудов и микроангиопатии, а также смертность от СД и общую смертность [5, 26]. Однако в исследовании CAFÉ [27] было показано, что БАБ атенолол повышает центральное давление в аорте, что может способствовать гемодинамическому ущербу в отношении целевых органов, в т. ч. головного мозга. При этом причиной повышения центрального давления на фоне атенолола считают возникновение феномена десинхронизации. Этот феномен характеризуется тем, что возвращенная пульсовая волна при урежении сердечного ритма накладывается на систолическую пульсовую, в результате чего происходят парадоксальное повышение систолического давления в аорте и ухудшение органного кровотока. Именно эти эффекты БАБ способны объяснить негативные результаты метаанализа 2008 г. [20], согласно которым снижение ЧСС у пациентов с АГ, получающих бета-блокаторы, ассоциировалось с увеличением риска сердечно-сосудистых событий и смерти. По данным нашего исследования, значимое снижение ЧСС под влиянием бисопролола имело место лишь в ночное время, тогда как среднесуточное изменение ЧСС было несущественным, что могло ограничить негативное влияние диссинхронии на головной мозг. Наличие у БАБ церебропротективных эффектов было также продемонстрировано в работе Н. Л. Афанасьевой и соавт., согласно которой всего через 6 нед. лечения метопрололом у больных АГ отмечались значимое возрастание мозгового кровотока по данным перфузионной сцинтиграфии мозга и улучшение показателей когнитивной функции [28].
Однако следует иметь в виду, что класс БАБ весьма гетерогенен и различается по липо- и гидрофильности, определяющей особенности их выведения и ряд побочных эффектов, а также по степени селективности. Бисопролол обладает амфифильными свойствами, вследствие чего характеризуется высокой биодоступностью и выводится в равных пропорциях с желчью и мочой, что избавляет от необходимости корректировать дозу у больных с умеренной почечной или печеночной недостаточностью [17]. Высокая селективность бисопролола, являющаяся эталонной среди высокоселективных БАБ, объясняет отсутствие ухудшения состояния липидного и углеводного обмена при его применении [21]. Мы также не выявили значимого изменения уровней HbA1C и показателей липидного спектра крови, что подтверждает метаболическую нейтральность бисопролола. Поэтому отрицательные результаты, полученные в исследованиях с одним БАБ, вероятно, не следует автоматически экстраполировать на другие препараты этого класса [24].
Заключение
Полученные нами данные убедительно свидетельствуют о том, что использование бисопролола у больных АГ в сочетании с СД 2-го типа способно оказывать церебропротективные эффекты в виде уменьшения размеров ликворных пространств, зависящие от выраженности и стабильности снижения АД. При этом уменьшение внутричерепной гипертензии, несомненно, имеет существенное клиническое значение, учитывая роль гидроцефалии в развитии глобальной ишемии мозга и гибели мозговых клеток [8, 9].
Кроме того, согласно нашему исследованию, на фоне лечения бисопрололом имело место уменьшение толщины стенки внутренних сонных артерий. Отсутствие зависимости данных изменений от выраженности снижения АД свидетельствует о самостоятельном положительном влиянии бисопролола на структуру сосудистой стенки, возможно, обусловленное симпатолитическими и противовоспалительными эффектами терапии. Так, в исследовании А. В. Прасолова и соавт. было показано, что лечение бисопрололом больных стабильной ИБС через 8 нед. сопровождалось снижением уровня провоспалительных цитокинов (фактора некроза опухоли α, интерлейкина-1β, интерлейкина-6), молекул межклеточной адгезии (SVCAM-1), С-реактивного белка и уменьшением жесткости сосудистой стенки [27]. В нашем исследовании на фоне лечения бисопрололом было отмечено значимое снижение пульсового давления, что может косвенно свидетельствовать об уменьшении сосудистой жесткости и отражать органопротективный эффект терапии.
Таким образом, согласно результатам нашей работы 6-месячная терапия бисопрололом больных АГ, ассоциированной с СД 2-го типа, сопровождается выраженным антигипертензивным эффектом, уменьшением толщины стенки сонных артерий и обратным развитием доклинических МРТ-признаков структурных повреждений головного мозга в виде уменьшения выраженности ликвородинамических расстройств.
Литература
1. Lim S. S., Vos T., Flaxman A. D. et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study // Lancet. 2010. Vol. 380. P.2224–2260.
2. Муромцева Г. А., Концевая А. В., Константинов В. В. и др. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012–2013 гг. Результаты исследования ЭССЕ-РФ // Кардиоваскулярная терапия и профилактика. 2012. № 13 (6). С.4–11 [Muromceva G.A., Koncevaya A. V., Konstantinov V. V. i dr. Rasprostranennost` faktorov riska neinfekcionny`x zabolevanij v rossijskoj populyacii v 2012–2013 g. Rezul`taty` issledovaniya E`SSE-RF // Kardiovaskulyarnaya terapiya i profilaktika. 2012. № 13 (6). S.4–11 (in Russian)].
3. Weycker D., Nichols G. A., O’Keeffe-Rosetti M. et al. Excess risk of diabetes in persons with hypertension // Journal of Diabetes and Its Complications. 2009. Vol. 23. P.330–336.
4. Duckworth W., Abraira C., Moritz T. et al. Glucose control and vascular complications in veterans with type 2 diabetes // N Engl Jю Med. 2009. Vol. 360. P.129–139.
5. UK Prospective Diabetes Study Group. Tight Blood Pressure Control and Risk of Macrvascular and Microvascular complications in Type 2 Diabetes: UKPDS 38 // BMJ. 1998. Vol. 317. P.703–713.
6. Feigin V. L. Stroke in developing countries: can the epidemic be stopped and outcomes improved? // Lancet Neurol. 2007. Vol. 6. P.94–97.
7. Bokura H., Kobayashi S., Yamaguchi S. et al. Silent Brain Infarction and Subcortical White Matter Lesions Increase the Risk of Stroke and Mortality: A Prospective Cohort Study // J. of Stroke and Cerebrovascular Diseases. 2006. Vol.15 (2). P.57–63.
8. Johanson C. E., Duncan III J.A., Klinge P. M. et al. Multiplicity of cerebrospinal fluid functions: New challenges in health and disease // Cerebrospinal Fluid Research. 2008. Vol. 5. P.1–32. DOI:10.1186/1743–8454–5–10
9. Гусев Е. И., Скворцова В. И. Ишемия головного мозга. М.: Медицина, 2001. 328 с. [Gusev E.I., Skvorcova V. I. Ishemiya golovnogo mozga. M.: Medicina, 2001. 328 s. (in Russian)].
10. Мордовин В. Ф., Пекарский С. Е., Фальковская А. Ю. и др. Диагностика и лечение хронических форм недостаточности мозгового кровообращения у больных с гипертонической болезнью / под ред. В. Ф. Мордовина, Р. С. Карпова. Томск: STT. 2011. 592 c. [Mordovin V.F., Pekarskij S. E., Fal’kovskaya A. Yu. i dr. Diagnostika i lechenie hronicheskih form nedostatochnosti mozgovogo krovoobrashcheniya u bol’nyh s gipertonicheskoj bolezn’yu / pod red. V. F. Mordovina, R. S. Karpova. Tomsk: STT. 2011. 592 c. (in Russian)].
11. Dijk J. M., van der Graaf Y., Bots M. L. et al. Carotid intima–media thickness and the risk of new vascular events in patients with manifest atherosclerotic disease: the SMART study // European Heart Journal. 2006. Vol. 27. 1971–1978. DOI:10.1093/eurheartj/ehl136
12. Lee E. J., Kim H. J., Bae J. M. et al. Relevance of Common Carotid Intima-Media Thickness and Carotid Plaque as Risk Factors for Ischemic Stroke in Patients with Type 2 Diabetes Mellitus // American Journal of Neuroradiology. 2007. Vol. 28 (5). P.916–919.
13. Grassi G., Mark A., Esler M. The sympathetic nervous system alterations in human hypertension // Circ Res. 2015. Vol. 13 (6). P.976–990.
14. Mancia G., Grassi G. The autonomic nervous system and hypertension // Circ Res. 2014. Vol. 114 (11). P.1804–1814.
15. Huggett R. J., Scott E. M., Gilbey S. G. et al. Impact of type 2 diabetes mellitus on sympathetic neural mechanisms in hypertension // Circulation. 2003. Vol. 108. P.3097–3101.
16. Лупанов В. П. Влияние кардиоселективного бета-блокатора бисопролол на предупреждение эффектов бета-адренергической стимуляции и препятствие реализации кардиотоксического влияния катехоламинов при лечении больных с ССЗ // Медицинский совет. 2016. № 13. C.48–55 [Lupanov V. P. Vliyanie kardioselektivnogo beta-blokatora bisoprolol na preduprezhdenie ehffektov beta-adrenergicheskoj stimulyacii i prepyatstvie realizacii kardiotoksicheskogo vliyaniya katekholaminov pri lechenii bol’nyh s SSZ // Medicinskij sovet. 2016. № 13. C.48–55 (in Russian)].
17. Лупанов В. П. Кардиоселективный бета-блокатор бисопролол в лечении больных ишемической болезнью сердца // Российский кардиологический журнал. 2011. № 3 (89). С.96–100 [Lupanov V. P. Kardioselektivnyj beta-blokator bisoprolol v lechenii bol’nyh ishemicheskoj bolezn’yu serdca // Rossijskij kardiologicheskij zhurnal. 2011. № 3 (89). S.96–100 (in Russian)].
18. Кириченко А. А. Место бисопролола в терапии артериальной гипертензии и ишемической болезни сердца // Фарматека. 2009. № 8. C.10–17 [Kirichenko A. A. Mesto bisoprolola v terapii arterial’noj gipertenzii i ishemicheskoj bolezni serdca // Farmateka. 2009. № 8. C.10–17 (in Russian)].
19. Ухолкина Г. Б. Бета-блокаторы — современное состояние вопроса // РМЖ. 2010. № 21 (18). С.1–6 [Uholkina G. B. Beta-blokatory — sovremennoe sostoyanie voprosa // RMZh. 2010. № 21 (18). S.1–6 (in Russian)].
20. Bangalore S., Sawhney S., Messerli F. H. Relation of beta-blocker–induced heart rate lowering and cardioprotection in hypertension // J Am Coll Cardiol. 2008. Vol. 52. P.1482–1489.
21. Остроумова О. Д., Зыкова А. А., Полосова Т. А. Эффективность и безопасность применения бисопролола для лечения артериальной гипертонии при метаболическом синдроме // Эффективная фармакотерапия. 2013. № 35. С.16–20 [Ostroumova O.D., Zykova A. A., Polosova T. A. EHffektivnost’ i bezopasnost’ primeneniya bisoprolola dlya lecheniya arterial’noj gipertonii pri metabolicheskom sindrome // EHffektivnaya farmakoterapiya. 2013. № 35. S.16–20 (in Russian)].
22. 2018 ESC/ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH) // European Heart J. 2018. Vol. 39. P.3021–3104. DOI:10.1093/eurheartj/ehy339
23. Pekarsky S. E., Baev A., Mordovin V. F. et al. Failure of renal denervation in SYMPLICITY HTN-3 is a predictable result of anatomically inadequate operative technique and not the true limitations of the technology // J. of Hypertension. 2015. Vol. 33. P.e108.
24. Оганезова Л. Г. Бисопролол — оптимальный бета-адреноблокатор для лечения сердечно-сосудистых заболеваний // РМЖ. 2012. № 11. С.61–64 [Oganezova L. G. Bisoprolol — optimal’nyj beta-adrenoblokator dlya lecheniya serdechno-sosudistyh zabolevanij // RMZh. 2012. № 11. S.61–64 (in Russian)].
25. UK Prospective Diabetes Study Group. Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 39 // Br Med J. 1998. Vol. 317. P.713–720.
26. Williams B., Lacy P. S., Thom S. M. et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes. Principal results of the conduit artery function evaluation (CAFE) Study // Circulation. 2006. Vol.113. P.1213–1225.
27. Прасолов А. В., Делова М. А., Князева Л. А., Москалюк М. И. Влияние бисопролола на показатели воспаления, эластические свойства сосудистой стенки у больных стабильной стенокардией напряжения // Фундаментальные исследования. 2010. № 11. С.103–108 [Prasolov A.V., Delova M. A., Knyazeva L. A., Moskalyuk M. I. Vliyanie bisoprolola na pokazateli vospaleniya, ehlasticheskie svojstva sosudistoj stenki u bol’nyh stabil’noj stenokardiej napryazheniya. // Fundamental’nye issledovaniya. 2010. № 11. S.103–108 (in Russian)].
28. Афанасьева Н. Л., Мордовин В. Ф., Ефимова Н. Ю. и др. Гипотензивная эффективность и церебропротективное влияние бета-блокатора метопролола // Российский кардиологический журнал. 2005. № 1. С.60–64 [Afanas’eva N.L., Mordovin V. F., Efimova N. Yu. i dr. Gipotenzivnaya ehffektivnost’ i cerebroprotektivnoe vliyanie beta-blokatora metoprolola // Rossijskij kardiologicheskij zhurnal. 2005. № 1. S.60–64 (in Russian].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






