Введение
Менингиомы представляют собой экстрацеребральные опухоли твердой мозговой оболочки. Это наиболее распространенная опухоль нервной системы, которая составляет около 15% всех интракраниальных новообразований и 30–35% опухолей центральной нервной системы (ЦНС) [1, 2].
Менингиомы относят к доброкачественным опухолям. Они демонстрируют в большинстве случаев медленный неинвазивный рост, однако скорость их роста может варьировать [3]. В соответствии с международной системой классификации опухолей ВОЗ, менингиомы разделяются на типы (grade I, II, III) на основании выявления и оценки при гистологическом исследовании следующих признаков злокачественного роста: ядерный атипизм, митозы, пролиферация эндотелия сосудов, некрозы. В 20% случаев менингиомы, которые изначально оценивали как гистологически доброкачественные, в дальнейшем проявляют признаки злокачественности [4].
В настоящее время широкое применение нейровизуализации позволяет обнаруживать менингиомы, не проявляющиеся клиническими симптомами.
Тактика ведения пациентов с менингиомами зависит от размера опухоли, ее локализации, клинических симптомов и в ряде случаев заключается в динамическом наблюдении и контроле роста опухоли без применения хирургического лечения [5].
Множественные менингиомы (ММ) впервые были описаны в 1889 г. Я.А. Анфимовым и Л.В. Блуменау. Собственно термин «множественные менингиомы», или менингиоматоз, был введен H.W. Cushing и L. Eisenhardt в 1938 г. [2, 6] и применяется в случаях одновременного или последовательного выявления двух или более пространственно разделенных менингиом в отсутствие нейрофиброматоза. ММ составляют 1–10% от общего числа выявленных менингиом, а по некоторым данным, встречаются в 30% случаев и чаще [2, 6–10]. Сведения о гендерных особенностях заболеваемости ММ противоречивы: ряд авторов [11–13] считает, что среди пациентов с ММ преобладают женщины в соотношении 3,5:1, однако сообщается и о более низком риске развития менингиоматоза у женщин [14]. Средний возраст, в котором менингиомы диагностируются впервые, составляет около 55 лет, с возрастом частота выявления заболевания увеличивается [12]. При анализе базы данных SEER (Surveillance, Epidemiology, and End Results) оказалось, что в США среди 109 660 пациентов с менингиомами большинство пациентов были старше 60 лет и лишь 0,41% — в возрасте до 19 лет [15].
У пациентов с ММ преобладают (до 90%) опухоли I гистологического типа (grade I) по классификации ВОЗ [16, 17]. Обращает на себя внимание тот факт, что среди рецидивирующих образований около 35% представлены опухолями II типа (grade II) и приблизительно 16% — III типа (grade III) [18]. Менингиомы III типа (grade III) ассоциированы со значительной частотой рецидивирования и метастазирования, чаще всего в легкие, спинной мозг, печень. В то же время и при менингиомах II типа (grade II) через 10 лет после хирургического лечения рецидивы выявляются у 40–50% пациентов [17]. Промежуток между выявлением первичной менингиомы и обнаружением метастазов может составлять от 2 мес. до 26 лет [19]. Факторами риска экстракраниального метастазирования считают наличие атипичных менингиом, вовлечение венозных синусов, рецидивы опухоли; в качестве одного из механизмов рассматривается повреждение гематоэнцефалического барьера при хирургическом лечении [19].
Особый интерес представляет генетика ММ. Описаны как спорадические случаи менингиоматоза, так и семейные, с аутосомно-доминантным типом наследования без вовлечения гена NF2 [3, 20]. Генетические и молекулярные исследования показывают связь заболевания с мутациями хромосом 17 (ген SMARCE1), 10 (ген SUFU), 22 (ген PDGFB) [2, 3, 9, 12]. При этом у одного пациента с ММ в разных опухолях могут быть выявлены разные мутации и различные гистологические подтипы, что предполагает независимое происхождение образований [16]. Для прогнозирования дальнейшего «поведения» опухоли предложена молекулярная классификация и система цитогенетического анализа удаленных менингиом [4, 18].
Наличие ММ негативно влияет на прогноз для пациентов. Имеются данные о прогрессирующем снижении выживаемости с каждым дополнительно выявленным образованием [14].
Клиническое наблюдение
Анамнез заболевания
Пациент Т., 32 года, программист. Семейный анамнез не отягощен. В 2008 г. в возрасте 16 лет после физической нагрузки на уроке физкультуры у пациента впервые развился генерализованный судорожный приступ, который повторился в 2009 г. По данным магнитно-резонансной томографии (МРТ) выявлена менингиома сильвиевой борозды слева. После консультации нейрохирургом пациент прооперирован в апреле 2009 г.
В июне 2009 г. стал отмечать боли в спине и постепенное развитие гипотрофии мышц, слабости и онемения правой ноги. По данным МРТ грудного и поясничного отделов позвоночника в декабре 2009 г. выявлены признаки объемных образований позвоночного канала на уровне нижнегрудного и поясничного отделов позвоночника. В марте 2010 г. госпитализирован с диагнозом: ММ грудного и поясничного отделов спинномозгового канала. Было проведено хирургическое лечение менингиом на уровне позвонков Th11–L2.
В мае 2014 г. утром заметил нарушение вкуса, к вечеру этого же дня развилась асимметрия лица и лагофтальм справа; лечился амбулаторно с диагнозом: нейропатия лицевого нерва справа. В связи с отсутствием эффекта лечения проведена МРТ головного мозга. По результатам МРТ картина интрамедуллярной, экстрамедуллярной опухоли на уровне позвонков С1–С2 с распространением в большое затылочное отверстие. Опухоль была удалена 30.06.2014. Гистологическое заключение от 01.07.2014: менингиома.
В дальнейшем неврологическая симптоматика не нарастала. В марте 2020 г. проведена контрольная МРТ, по данным которой выявлены новообразования на уровнях Th10 и L4–L5. В июне 2020 г. появились умеренные непостоянные боли в пояснице, которые усилились к декабрю 2020 г. и сопровождались иррадиацией в правую ногу. В феврале 2021 г. проведено микрохирургическое удаление опухолей на уровне Th 9–10 и L5, с декомпрессией позвоночного канала и спинного мозга.
В декабре 2022 г. отметил снижение слуха слева. Обратился к оториноларингологу, затем к сурдологу и неврологу. После осмотра неврологом выполнена МРТ дважды: 18.01.2023 и 13.04.2023 (рис. 1). По данным исследования картина множественных интракраниальных опухолей: в области левого мостомозжечкового угла (два образования) и на уровне большого затылочного отверстия справа.
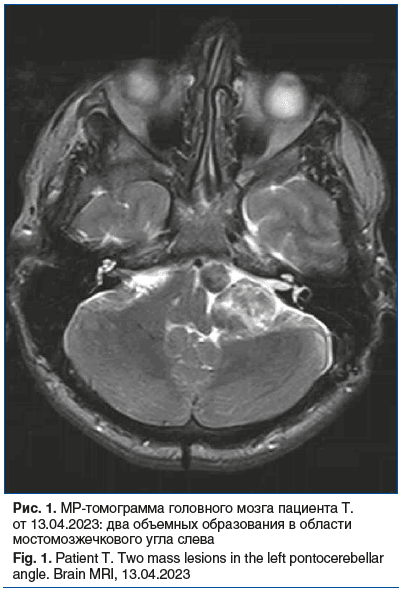
С 19.05.2023 по 05.06.2023 находился в стационаре НМИЦ нейрохирургии им. академика Н.Н. Бурденко. Проведено хирургическое лечение: удалены два образования из трех, выписан с диагнозом: атипичная менингиома задней поверхности пирамиды височной кости слева. Удаление этих образований с применением микрохирургической техники и нейрофизиологическим мониторингом черепных нервов проведено 22.05.2023. Гистологическое исследование материала от 25.05.2023: светлоклеточная менингиома, grade II. По данным контрольной МРТ головного мозга с контрастным усилением от 10.07.2023 в области пирамиды височной кости слева определяется остаточная опухоль небольшого размера с минимальной зоной перифокального отека и масс-эффекта. Дополнительно в области затылочного отверстия справа выявляется менингиома диаметром до 1,5 см. В зоне проведенного хирургического лечения данных за рецидив нет.
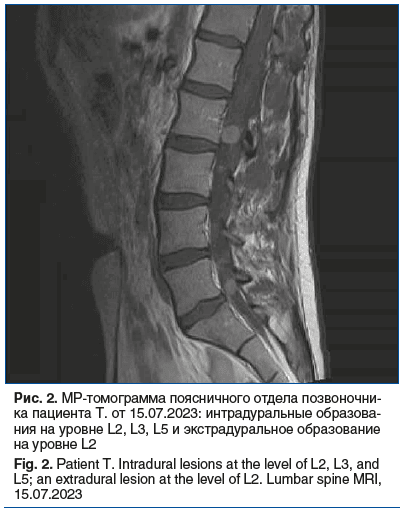
По данным плановой МРТ грудного отдела позвоночника 15.07.2023 выявлена зона интрамедуллярных изменений на уровне Th8–Th11, интрадуральная ликворная киста на уровне Th7–Th8. По результатам МРТ поясничного отдела позвоночника картина интрадуральных образований на уровне L2, L3, L5, экстрадурального образования на уровне L2 справа (рис. 2).
В середине августа 2023 г. у пациента появилась шаткость походки, увеличилась слабость в ногах, появились тазовые нарушения. В конце августа пациент стал передвигаться с опорой на трость.
Данные генетического исследования на нейрофиброматоз II типа (определение 18 мутаций в гене NF2) от 08.08.2023: мутаций, связанных с нейрофиброматозом, не выявлено.
Сеанс радиохирургического лечения двух очагов в головном мозге (атипичная менингиома задней поверхности пирамиды височной кости слева и в области кранио-вертебрального перехода справа) проведен 07.09.2023 в АО «Деловой центр нейрохирургии» (Москва).
В дальнейшем слабость в нижних конечностях нарастала. Со слов пациента, с 15.09.2023 стал передвигаться с опорой на ходунки. Самостоятельно обратился в онкологический центр г. Екатеринбурга, где проведено хирургическое лечение: гемиламинэктомия Th7–Th8 слева, вскрытие напряженной арахноидальной кисты. После лечения сохранялись нарушение передвижения и трудности в самообслуживании. Стал передвигаться при помощи кресла-коляски из-за выраженной слабости в ногах и гипотрофии мышц.
В октябре 2023 г. в связи с нарастанием нижнего парапареза и нарушением функций тазовых органов проведена ламинэктомия L1, L2 и L5 и микрохирургическое удаление опухолей на этом уровне. Гистологическое исследование от 25.10.2023: менингиомы grade II с дегенеративными изменениями.
Содержание статьи
Неврологический статус
Сознание ясное, в контакт вступает легко. Со стороны черепных нервов выявлены недостаточность отводящего нерва слева, двоение при взгляде влево и вверх, поражение лицевого нерва слева по периферическому типу. Слух на левое ухо отсутствует, наблюдается дисфагия, снижена фонация мягкого неба, снижены глоточный и небный рефлексы с двух сторон. Нижний вялый парапарез со снижением мышечной силы до 2–3 баллов проксимально, 1–2 баллов дистально. Асимметричное снижение рефлексов с ног D
Множественный менингиоматоз редко встречается в практике невролога и недостаточно освещен в отечественной литературе. Вместе с тем имеет большое значение осведомленность врачей первичного звена, в том числе неврологов, о возможности развития ММ на разных уровнях ЦНС, гетерогенности их гистологической структуры и об особенностях тактики ведения пациентов этой группы.
По данным литературы, количество менингиом у одного пациента может быть значительным: от 2–5 [8] до 50 и более [11]. Кроме того, необходимо учитывать разнообразные варианты расположения менингиом: супратенториально, инфратенториально и на протяжении всего спинномозгового канала. У нашего пациента в настоящее время обнаружено по меньшей мере 12 опухолей. Обращает на себя внимание ранний дебют заболевания (16 лет), тогда как менингиомы чаще обнаруживаются в старших возрастных группах [15]. Наиболее частым вариантом дебюта заболевания и поводом для проведения нейровизуализации, как и в нашем случае, являются эпилептические приступы (в 29–65% случаев, в зависимости от локализации опухоли) [21].
По результатам генетического обследования связь с нейрофиброматозом у пациента не подтверждена, что дает основание для обсуждения именно менингиоматоза. Кроме того, уже после принятия статьи в печать получено заключение по результатам полногеномного секвенирования с анализом панели генов «Эпилепсия» от 08.10.2024, выполненого в ФГБНУ «МГНЦ». Выявлен не описанный ранее как патогенный вариант нуклеотидной последовательности в донорном сайте сплайсинга, интроне 6 гена SMARCE1. Варианты в гене SMARCE1 в гетерозиготном состоянии описаны у пациентов с семейной множественной менингиомой (OMIM:607174). По совокупности сведений данный вариант следует расценивать как вероятно патогенный. Высоковероятный диагноз: семейная множественная менингиома (OMIM:607174). Тип наследования аутосомно-доминантный. Для данного фенотипа описана неполная пенетрантность.
В литературе встречаются данные о возможности наличия менингиом разных типов у одного пациента. К сожалению, у пациента Т. на руках оказалось лишь несколько гистологических заключений после удаления опухолей, из них два с определением типа менингиом (grade II). Именно поэтому анализ и сравнение гистологической структуры всех удаленных менингиом в представленном клиническом наблюдении оказались невозможны. По этой же причине вопрос о возможности метастазирования остался открытым. Следует помнить, что с учетом возможности мета-стазирования при обнаружении анапластической структуры удаленной менингиомы пациентам показана компьютерная томография легких [19].
Низкую эффективность хирургического лечения менингиоматоза связывают с рецидивированием менингиом и персистирующим дефектом твердой мозговой оболочки с формированием ликворной фистулы [9]. Обсуждается связь нарушения гематоэнцефалического барьера во время хирургического вмешательства с последующим развитием менингиом других локализаций. Увеличение неврологического дефицита после операций, как и в нашем случае, снижает качество жизни пациентов. Именно поэтому, несмотря на то, что хирургическое лечение остается методом выбора в большинстве случаев менингиоматоза, рекомендуется индивидуальный подход к каждой менингиоме в зависимости от симптоматики, локализации опухоли, ее размера и доступности для хирургического удаления [12]. Альтернативными вариантами лечения служат стереотаксическая радиохирургия [9] и иммунотерапия [17].
Менингиома — наиболее часто встречающаяся опухоль нервной системы. Показания к хирургическому лечению этой опухоли зависят от ее размера и локализации. Вместе с тем ММ, составляя 1–10% всех выявляемых менингиом, представляют собой проблему как в отношении диагностики, так и в плане лечебной тактики. Последовательное (а иногда и одновременное) выявление нескольких объемных образований затрудняет выбор лечебных мероприятий и их очередности и значительно ухудшает прогноз для пациента. Повторные хирургические вмешательства в ряде случаев приводят к усугублению неврологического дефицита и сокращению продолжительности жизни. Клиническое наблюдение пациента с 12 последовательно выявленными и оперированными менингиомами на различных уровнях ЦНС продемонстрировано с целью повышения настороженности специалистов в отношении менингиоматоза. Интересны результаты полногеномного секвенирования у нашего пациента, которые, несмотря на отсутствие семейного анамнеза менингиом, с высокой долей вероятности позволяют предположить наличие семейной множественной менингиомы с аутосомно-доминантным типом наследования, связанной с мутацией гена SMARCE1 (17-я хромосома), без вовлечения гена NF2.
Сведения об авторах:
Старикова Наталья Леонидовна — д.м.н., профессор кафедры неврологии и медицинской генетики ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614099, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0000-0002-8350-7004
Быстрова Ольга Викторовна — к.м.н., доцент кафедры физической реабилитационной медицины с курсом МСЭ ФГБОУ ВО ПГМУ им. академика Е.А. Вагнера Минздрава России; 614099, Россия, г. Пермь, ул. Петропавловская, д. 26; ORCID iD 0009-0008-0358-102X
Корнилович Анна Александровна — невролог ГБУЗ ПК «ПККГВВ»; 614097, Россия, г. Пермь, ул. Подлесная, д. 6.
Контактная информация: Старикова Наталья Леонидовна, e-mail: nlsta@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 12.08.2024.
Поступила после рецензирования 04.09.2024.
Принята в печать 27.09.2024.
About the authors:
Nataliya L. Starikova — Dr. Sc. (Med.), Professor of the Department of Neurology and Medical Genetics, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0000-0002-8350-7004
Olga V. Bystrova — C. Sc. (Med.), Assistant Professor of the Department of Physical Rehabilitation Medicine with Sociomedical Expertising Course, Academician E.A. Vagner Perm State Medical University; 26, Petropavlovskaya str., Perm, 614990, Russian Federation; ORCID iD 0009-0008-0358-102X
Anna A. Kornilovich — neurologist, Perm Territorial Clinical VA Hospital; 6, Podlesnaya str., Perm, 614097, Russian Federation.
Contact information: Nataliya L. Starikova, e-mail: nlsta@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 12.08.2024.
Revised 04.09.2024.
Accepted 27.09.2024.
Обсуждение
Заключение
Информация с rmj.ru