Энтеропанкреатический синдром
С. В. Бельмер, доктор медицинских наук, профессор
Т. В. Гасилина, кандидат медицинских наук
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Поджелудочная железа (ПЖ) легко вовлекается практически в любой
патологический процесс, возникающий в пищеварительной системе. Нарушение функции
ПЖ, возникающее на фоне различных болезней кишечника и нередко усугубляющее их
течение, в клинической практике можно обозначить как энтеропанкреатический
синдром. По данным различных исследователей экзокринная панкреатическая
недостаточность (ЭПН) при целиакии у взрослых наблюдается примерно у 20%
пациентов [1–3]. По данным различных авторов, использовавших беззондовые тесты
для диагностики ЭПН (уровень химотрипсина в стуле, эластазы-1 в стуле, 13C-MTG-дыхательный
тест), частота ее выявления при целиакии у взрослых колеблется от 11,4% до 56,2%
[2, 4–8]. По результатам секретин-панкреозиминового теста ЭПН средней степени
выраженности была выявлена у 42% больных целиакией, а выраженная — у 10% [9].
В исследовании A. S. Abdulkarim и соавт. среди 49 взрослых пациентов с
целиакией у 6 (12,2%) была нарушена экзокринная функция ПЖ, а у одного (2,0%)
был выявлен рак ПЖ [10]. Следует отметить при этом, что у больных целиакией
частота развития рака ПЖ не превышает таковую в популяции, что было, в
частности, показано по результатам наблюдения за 32 439 взрослыми пациентами в
рамках работы над Финским регистром больных раком (Finnish Cancer Registry)
[11].
С другой стороны, у взрослых больных целиакией повышен риск развития
панкреатита. Анализ данных, проведенный в рамках работы с Шведским национальным
регистром больных целиакией, в который вошли 14 239 больных с основным
диагнозом, установленным в 1964–2003 гг., в сравнении с сопоставимой по полу и
возрасту группой из 69 381 лица без целиакии, показал общий риск развития
панкреатита, равный 3,3, а хронического панкреатита — 19,8. Важно упомянуть, что
социоэкономический статус пациентов, наличие сахарного диабета, желчнокаменной
болезни, употребление алкоголя на уровень этого риска не влияли. Интересно, что
по данным этого исследования высокий риск развития панкреатита относился только
к пациентам, которым диагноз был поставлен во взрослом состоянии [12]. В этой же
группе больных риск развития ассоциированного с желчными камнями острого
панкреатита составил 1,59, а неассоциированного — 1,86, т. е. риски оказались
примерно равными [13].
По нашим данным при целиакии у детей в активном периоде заболевания поражение
ПЖ наблюдается у 88% больных, в периоде ремиссии — у 79%. Повышение в крови
активности трипсина, говорящее о деструктивном процессе в ПЖ, скорее всего,
обострении хронического панкреатита, наблюдается у 37% детей в активном периоде
целиакии и у 12% больных в периоде ремиссии. Что касается повышенной экскреции
триглицеридов с калом, указывающей на экзокринную недостаточность ПЖ, нами была
выявлена обратная картина: низкая частота в активный период (18%) и более
высокая — в периоде ремиссии (52%). При этом отношение содержания в стуле
неэстерифицированных жирных кислот к содержанию триглицеридов в активный период
заболевания было выше, чем в период ремиссии (соответственно 7,8 ± 2,34, по
сравнению с 3,67 ± 0,68, норма — 1,67 ± 0,2), что указывает на преобладание в
стадию ремиссии ЭПН над собственно мальабсорбцией липидов в кишечнике [14–16].
Данная закономерность совпала с таковой при оценке частоты выявления
признаков хронического панкреатита по данным УЗИ. Повышенная эхогенность и
неоднородность ткани ПЖ не выявлялись в активном периоде целиакии, но
встречались у 58% больных с целиакией в периоде ремиссии. Можно предположить
постепенное формирование хронического панкреатита по мере течения процесса даже
на фоне стойкой ремиссии целиакии с развитием ЭПН. Дальнейшие работы в этом
направлении позволили воссоздать возможные пути повреждения ПЖ при целиакии.
Целиакия характеризуется развитием индуцированной злаковым белком глютеном
атрофии слизистой оболочки тонкой кишки и нарушением всасывания практически всех
нутриентов. Данная атрофия носит гиперрегенераторный характер, что проявляется
повышенной митотической активностью в криптах и значительным их углублением.
Вместе с увеличением числа собственно энтероцитов в криптах увеличивается также
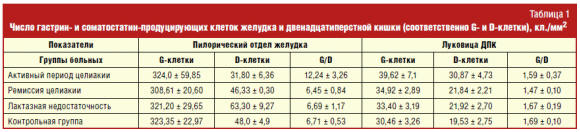
число некоторых энтероэндокринных клеток. Нами было проведено
иммуногистохимическое исследование слизистой оболочки желудка и тонкой кишки с
целью определения числа гастрин-продуцирующих G-клеток и
соматостатин-продуцирующих D-клеток у 36 детей с целиакией в активный период и в
период ремиссии через 1 год соблюдения безглютеновой диеты. Также было показано
достоверное повышение числа D-клеток в слизистой оболочке тонкой кишки у детей в
активный период целиакии и нормализация их числа в период ремиссии (табл. 1).
При этом число D-клеток достоверно положительно коррелировало с глубиной крипт (R
= +0,52, p < 0,01) [14–16].
По данным E. Arilla и соавт. гиперплазия D-клеток сопровождается повышением
их активности, повышением продукции соматостатина, причем уровень соматостатина
в большей степени повышается локально в слизистой оболочке, обеспечивая
паракринную регуляцию [17]. Мы предполагаем, что гиперсекреция соматостатина
является закономерным регуляторным ответом на гиперрегенерацию слизистой
оболочки тонкой кишки и призвана ее сдерживать в определенных пределах. Вместе с
тем она несомненно усугубляет и без того нарушенные процессы кишечного
всасывания.
Помимо воздействия на процессы регенерации и всасывания, точками приложения
соматостатина являются другие энтероэндокринные клетки, в т. ч. I-клетки,
продуцирующие холецистокинин (ХК), и S-клетки, продуцирующие секретин. При
целиакии наблюдается снижение продукции секретина и ХК энтероэндокринными
клетками тонкой кишки на фоне значительного уменьшения числа этих клеток [9,
18–21]. Так, по данным M. Fraquelli и соавт. у взрослых больных целиакией в
крови достоверно выше уровень соматостатина (9,3 ± 4,6 пмоль/л, по сравнению с
контрольной группой 4,8 ± 3,4 пмоль/л, p = 0,023), а также ниже пик концентрации
ХК и площадь под кривой его секреции (соответственно 3,1 ± 2,3 пмоль/л, по
сравнению с контрольной группой 10,5 ± 6,9 пмоль/л, p = 0,028 и 157 ± 142 пмоль/л/90
мин, по сравнению с контрольной группой 453 ± 229 пмоль/л/90 мин, p = 0,028).
Перечисленные выше изменения нормализовались при соблюдении безглютеновой диеты
[22]. Нормальные результаты секретинового и холецистокининового тестов у части
больных [2] говорят о том, что снижение функции ПЖ в активный период целиакии
связано в значительной степени с нарушением паракринной регуляции, но не с
непосредственным влиянием соматостатина на ацинарные клетки ПЖ.
Еще одним фактором, способствующим снижению экзокринной секреции ПЖ, является
повышенная продукция пептида YY в дистальных отделах тонкой кишки, также
наблюдающаяся при целиакии, видимо, в ответ на поступление туда непереваренных и
невсосавшихся липидов [23].
Эти же механизмы ведут и к нарушению реализации потенциала ферментов уже в
просвете двенадцатиперстной кишки (ДПК) (т. е. развитию относительной ЭПН), т.
к. замедляется выделение желчи, необходимой для нормальных процессов
пищеварения. Значительное снижение сократительной функции желчного пузыря у
больных целиакией было показано, в частности, M. Fraquelli и соавт. У
обследованных ими пациентов по сравнению со здоровыми лицами был значительно
увеличен объем желчного пузыря натощак и значительно меньше сокращение пузыря в
ответ на пищу (соответственно 25,7 ± 9,7 мл, по сравнению с контрольной группой
16,8 ± 7,0 мл, p = 0,021 и 55 ± 11,2%, по сравнению с контрольной группой 76 ±
7,2%, p = 0,005) [22].
Другой механизм повреждения ПЖ при целиакии связан с нарушением ее трофики и,
видимо, имеет долговременные последствия. Важными трофическими факторами для
ткани ПЖ являются такие регуляторные пептиды желудочно-кишечного тракта, как
гастрин и ХК. Нами было показано, что уровень гастрина в крови под влиянием
гиперпродукции соматостатина снижается в активный период целиакии (табл. 2).
Количество гастрин-продуцирующих G-клеток при этом не меняется ни в желудке, ни
в ДПК, что указывает на функциональный характер выявленных нарушений. Тем не
менее, в сочетании со снижением продукции ХК, которое обсуждалось выше, могут
развиваться трофические нарушения, способствующие как снижению функции органа,
так и создающие условия для развития хронического панкреатита в дальнейшем.
Наконец, имеют значение и общие нутритивные нарушения, развивающиеся при
целиакии на фоне мальабсорбции. На значение мальнутриции в развитии ЭПН
указывали также и другие исследователи [24–26]. Тяжелая гипотрофия, независимо
от причины, характеризуется нарушением функции всех пищеварительных желез, что
резко снижает толерантность пациентов с гипотрофией к пище.

Указанные трофические нарушения, снижение стабильности клеточных мембран
способствуют развитию цитолиза, достаточно чувствительных к различным
неблагоприятным факторам ацинарных клеток ПЖ. Деструкция проявляется
панкреатической гиперферментемией (гипертрипсиногенемией, гиперлипаземией) и
является отражением, по существу, неявного (без четких клинических проявлений)
панкреатита у больного целиакией. В патогенезе указанных нарушений нельзя также
исключить аутоиммунный механизм, т. к. известно о появлении в крови при целиакии
аутоантител к различным органам, в т. ч. к островковым клеткам ПЖ, хотя
аутоагрессия в отношении ацинарных клеток пока остается недоказанной [27]. Кроме
того, известно, что гипертриглицеридемия оказывает повреждающее действие на
ткань ПЖ с возможным развитием острого панкреатита, описанного у взрослых лиц с
гиперлипидемией, хотя механизмы этого воздействия неясны. Поскольку у больных
целиакией наблюдается повышение уровня триглицеридов в крови на определенном
этапе развития заболевания, нельзя исключить и этот механизм повреждения.
Наконец, при целиакии в активный период заболевания повышается уровень
вазоактивного интестинального пептида (ВИП), что приводит к нарушению
микроциркуляции в ПЖ. Ишемия ткани ПЖ, сохраняющаяся длительное время, может
быть причиной вялотекущего панкреатита с его хронизацией в дальнейшем в периоде
ремиссии. И хотя в периоде ремиссии целиакии происходит восстановление кишечного
всасывания и нутритивного статуса, нормализуется число
соматостатин-продуцирующих клеток, а уровень гастрина даже повышается, ущерб,
нанесенный ПЖ в активный период, остается не всегда поправимым, что проявляется
высокой частотой хронического панкреатита с экзокринной панкреатической
недостаточностью на фоне благополучия по основному заболеванию.
Таким образом, манифестация целиакии, развитие атрофии слизистой оболочки
тонкой кишки приводят, с одной стороны, к мальабсорбции, а с другой — к
вторичному повреждению ПЖ и нарушению ее экзокринной функции. Вторичное
нарушение переваривания способствует неблагополучию в тонкой кишке, усугубляет
мальабсорбцию и ухудшение нутритивного статуса пациента. Следовательно,
поражение тонкой кишки при целиакии и поражение ПЖ являются не просто связанными
процессами, но тесно взаимодействующими и поддерживающими друг друга.
ЭПН при целиакии, вторичная по сути своей, носит смешанный (абсолютный и
относительный) характер, а механизмы ее развития очень многообразны. При
целиакии, как уже указывалось выше, нарушается функция ПЖ в связи с трофическими
нарушениями и снижением продукции ферментов ацинарными клетками. Кроме того,
нарушается гуморальная стимуляция продукции панкреатического секрета со стороны
тонкой кишки, в частности, секретином и ХК. Последнее приводит и к замедлению
пассажа секрета по панкреатическим протокам. У части больных нельзя исключить
спазм сфинктера Одди. Следовательно, при целиакии присутствуют все возможные
механизмы развития абсолютной ЭПН. С другой стороны, нарушение продукции ХК
ведет к гипомоторике желчевыводящих путей, снижению поступления желчи в ДПК и
нарушению процессов переваривания липидов. При этом липиды, поступающие в
дистальные отделы тонкой кишки, стимулируют синтез пептида YY, который тормозит
панкреатическую секрецию. Кроме того, наблюдается ускорение тонкокишечного
транзита, что также отрицательно влияет на пищеварительные процессы.
Перечисленные механизмы обуславливают развитие относительной ЭПН.
На основании изучения механизмов поражения ПЖ при целиакии мы предложили
использовать термин «энтеропанкреатический синдром», который предполагает
нарушение функции ПЖ, обусловленное изменениями, происходящими в тонкой кишке.
При этом если в случае целиакии задействован широкий спектр механизмов, то при
лактазной недостаточности спектр их сужается. В этом случае кишечник страдает в
значительно меньшей степени, чем при целиакии, атрофия ворсинок слизистой
оболочки тонкой кишки не развивается, нарушения гуморальной регуляции выражены в
меньшей степени, однако и в этом случае можно говорить об энтеропанкреатическом
синдроме с развитием в большей степени относительной, чем абсолютной ЭПН. При
лактазной недостаточности высокая трипсиногенемия по нашим данным отмечена
только у 7% пациентов, а повышенная экскреция триглицеридов с калом, указывающая
на ЭПН, в виде умеренно выраженной стеатореи наблюдалась у 38% детей. Выявленная
закономерность совпала с таковой при оценке частоты выявления признаков
хронического панкреатита по данным ультразвукового исследования. Признаки
хронического панкреатита встречались у 32% детей с лактазной недостаточностью.
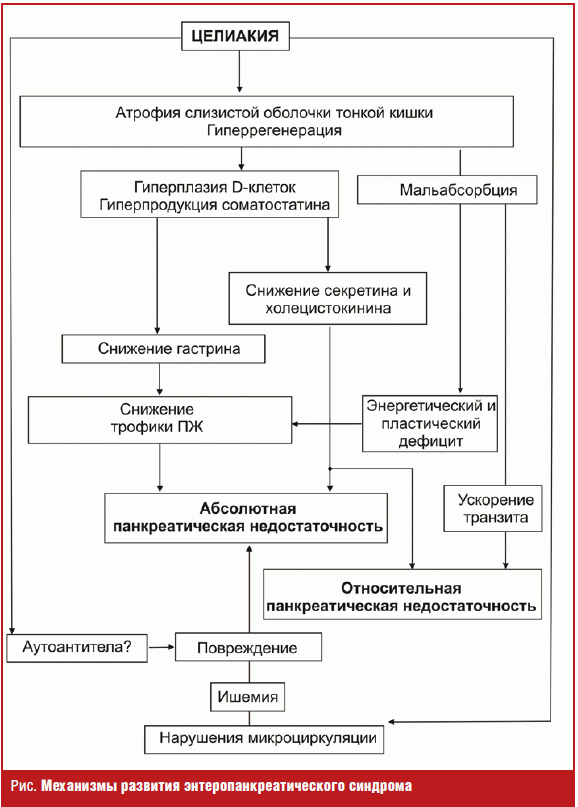
Механизмы развития энтеропанкреатического синдрома в обобщенном виде
представлены на рис.
Представленные выше взгляды на состояние ПЖ при патологии тонкой кишки
диктуют необходимость ее коррекции при целиакии и лактазной недостаточности, в
т. ч. определяют показания для заместительной терапии высокоактивными
препаратами панкреатических ферментов.
A. Carroccio и соавт. в двойном слепом плацебо-контролируемом исследовании, в
которое вошли 20 детей с целиакией, получавших заместительную терапию
препаратами панкреатических ферментов, и 20 детей, получавших плацебо, показали,
что через 30 дней терапии масса тела детей первой группы была достоверно выше,
чем во второй [7]. Положительный эффект от применения заместительной терапии у
взрослых больных целиакией был показан K. E. Evans и соавт. В проведенном ими
исследовании 20 больных получали лечение препаратами панкреатических ферментов в
средней дозе 45000 Ph. Eur липазы в сутки. В ходе наблюдения было установлено,
что уровень эластазы-1 в стуле вырос от исходных 90 мг/г до 212 мг/г через 6
месяцев и до 365 мг/г — через 12 месяцев лечения [28].
Исходя из этого, в план обследования при болезнях тонкой кишки должны входить
УЗИ ПЖ, оценка ее экзокринной функции (оптимальным методом является определение
эластазы-1 в стуле в сочетании с непрямыми методами, такими как копрограмма или
липидограмма кала), а также определение активности панкреатических ферментов в
крови (трипсина, липазы). Алгоритм оценки экзокринной функции ПЖ с
использованием определения уровня эластазы-1 в стуле рекомендован в частности,
Ассоциацией по изучению ПЖ (Association for the Study of the Pancreas) для
обследования взрослых больных целиакией [29].
Естественно, что лечение энтеропанкреатического синдрома в первую очередь
включает лечение основного заболевания. При целиакии назначается строгая
безглютеновая диета, при лактазной недостаточности — безлактозная с
использованием специализированных продуктов и/или препаратов лактазы (Лактаза
Бэби, биологически активная добавка). При водно-электролитных нарушениях
проводится их коррекция, в тяжелых случаях в виде инфузионной терапии, в легких
— пероральных средств для регидратации (Регидрон и др.). Нередко наблюдающийся
холестатический синдром также требует применения специализированных средств (Урсофальк,
Одестон, Хофитол и др.). Могут применяться адсорбенты (Смекта, Энтеросгель).
Кроме того, в состав комплексной терапии при энтеропанкреатическом синдроме, в
частности, при целиакии, должны входить препараты, улучшающие микроциркуляцию в
ПЖ (в т. ч. Трентал, Даларгин и др.) и препараты панкреатических ферментов
(например, Креон), назначение которых имеет патогенетическое значение.
Эффективность применения высокоактивных панкреатических препаратов
подтверждается как нашими наблюдениями, так и данными зарубежных авторов [7]. В
большинстве случаев использование препарата Креон 10000, содержащего 10000
единиц Ph. Eur. липазы, 8000 единиц Ph. Eur. амилазы и 600 единиц Ph. Eur.
протеаз, является оптимальным, однако в наиболее тяжелых случаях может быть
использована и более мощная форма препарата с активностью 25000 Ph. Eur липазы.
Таким образом, патологические процессы в кишечнике неизбежно оказывают
влияние на состояние ПЖ (формируется энтеропанкреатический синдром), что
оказывает существенное влияние на течение заболевания. Выявление этих нарушений
определяет тактику ведения таких пациентов, а введение высокоактивных препаратов
панкреатических ферментов повышает эффективность терапии в целом.
Литература
-
Pezzilli R. Exocrine Pancreas Involvement in Celiac Disease: A
Review // Recent Patents on Inflammation & Allergy Drug Discovery. 2014, 8,
167–172, 167. -
Carroccio A., Iacono G., Montalto G., Cavataio F., Di Marco C.,
Balsamo V. et al. Exocrine pancreatic function in children with coeliac
disease before and after a gluten free diet // Gut. 1991; 32 (7): 796–799. -
Fine K. D., Meyer R. L., Lee E. L. The prevalence and causes of
chronic diarrhea in patients with celiac sprue treated with a gluten-free diet
// Gastroenterology. 1997; 112 (6): 1830–1838. -
Walkowiak J., Herzig K. H. Fecal elastase-1 is decreased in
villous atrophy regardless of the underlying disease // Eur J Clin Invest.
2001; 31 (5): 425–430. -
Gomez J. C., Moran C. E., Maurino E. C., Bai J. C. Exocrine
pancreatic insufficiency in coeliac disease // Gastroenterology. 1998; 114
(3): 621–623. -
Carroccio A., Iacono G., Montalto G., Cavataio F., Lorello D., Soresi
M. et al. Pancreatic insufficiency in celiac disease is not dependent on
nutritional status // Dig Dis Sci. 1994; 39 (10): 2235–2242. -
Carroccio A., Iacono G., Montalto G., Cavataio F., Lorello D., Greco
L. et al. Pancreatic enzyme therapy in childhood celiac disease. A
double-blind prospective randomized study // Dig Dis Sci. 1995; 40 (12):
2555–2560. -
Perri F., Pastore M., Festa V., Clemente R., Quitadamo M., D’Altilia
M. R. et al. Intraduodenal lipase activity in celiac disease assessed by
means of 13 C mixed-triglyceride breath test // J Pediatr Gastroenterol Nutr.
1998; 27 (4): 407–410. -
Regan P. T., DiMagno E. P. Exocrine pancreatic insufficiency in
celiac sprue: A cause of treatment failure // Gastroenterology. 1980; 78 (3):
484–487. -
Abdulkarim A. S., Burgart L. J., See J., Murray J. A. Etiology of
nonresponsive celiac disease: Results of a systematic approach // Am J
Gastroenterol. 2002; 97 (8): 2016–2021. -
Ilus T., Kaukinen K., Virta L. J., Pukkala E., Collin P.
Incidence of malignancies in diagnosed celiac patients: A population-based
estimate // Am J Gastroenterol. 2014; 109 (9): 1471–1477. -
Ludvigsson J. F., Montgomery S. M., Ekbom A. Risk of pancreatitis
in 14,000 individuals with celiac disease // Clin Gastroenterol Hepatol. 2007;
5 (11): 1347–1353. -
Sadr-Azodi O., Sanders D. S., Murray J. A., Ludvigsson J. F.
Patients with celiac disease have an increased risk for pancreatitis // Clin
Gastroenterol Hepatol. 2012; 10 (10): 1136–1142. -
Гасилина Т. В., Бельмер С. В., Мухина Ю. Г., Зверков И. В.
Состояние поджелудочной железы при синдроме мальабсорбции у детей // Советская
медицина. 1989; (12): 91–93. -
Бельмер С. В., Гасилина Т. В., Мухина Ю. Г., Зверков И. В., Кургашева
Е. К. Поражение поджелудочной железы при целиакии // РМЖ. БОП. 2002; 4
(1): 10–12. -
Бельмер С. В., Гасилина Т. В. Функциональное состояние органов
пищеварения при целиакии // Вопросы детской диетологии. 2012; (2): 29–34. -
Arilla E., Hernander M., Polanco T. Modification of somatostatin.
Content and binding in jejunum from celiac children // J. Pediatr.
Gastroentero. Nutr. 1987; 6 (2): 228–233. -
DiMagno E. P., Go W. L., Summerskill W. H. Impaired
cholecystokinin-pancreozymin secretion, intraluminal dilution, and
maldigestion of fat in sprue // Gastroenterology. 1972; 63 (1): 25–32. -
Calam J., Ellis A., Dockray G. J. Identification and measurement
of molecular variants of cholecystokinin in duodenal mucosa and plasma.
Diminished concentrations in patients with coeliac disease // J Clin Invest.
1982; 69: p. 218–225. -
Domschke S., Bloom S. R., Adrian T. E., Lux G., Bryant M. G., Domschke
W. Coeliac sprue: abnormalities of the hormone profile of gastroduodenal
mucosa // Scand J Gastroenterol. 1989; 167 (Suppl.): 86–89. -
Buchan A. M., Grant S., Brown J. C., Freeman H. J. A quantitative
study of enteric endocrine cells in celiac sprue // J Pediatr Gastroenterol
Nutr. 1984; 3 (5): 665–671. -
Fraquelli M., Bardella M. T., Peracchi M., Cesana B. M., Bianchi P.
A., Conte D. Gallbladder emptying and somatostatin and cholecystokinin
plasma levels in celiac disease // Am J Gastroenterol. 1999; 94 (7):
1866–1870. -
Wahab P. J., Hopman W. P., Jansen J. B. Basal and fat-stimulated
plasma peptide YY levels in celiac disease // Dig Dis Sci. 2001; 46 (11):
2504–2509. -
Freeman H. J., Kim Y. S., Sleisenger M. H. Protein digestion and
absorption in man. Normal mechanisms and protein-energy malnutrition // Am J
Med. 1979; 67 (6): 1030–1036. -
Weinstein L. D., Herskovic T. Rectal seepage of oil in a patient
with celiac disease and secondary pancreatic insufficiency // Am J Dig Dis.
1968; 13 (8): 762–765. -
Arvanitakis S., Karagiozoglou-Lamboudes T., Aggouridaki C.,
Malaka-Lambrellis E., Galli-Tsinopoulou A., Xefteri M. Influence of
jejunal morphology changes on exocrine pancreatic function in celiac disease
// J Pediatr Gastroenterol Nutr. 1999; 29 (1): 815. -
Volta U., De Franceschi L., Molinaro N., Tetta C., Bianchi F. B.
Organ-specific autoantibodies in coeliac disease: do they represent an
epiphenomenon or the expression of associated autoimmune disorders? // Ital.
J. Gastroenterol. Hepatol. 1997; 29 (1): 18–21. -
Evans K. E., Leeds J. S., Morley S., Sanders D. S. Pancreatic
insufficiency in adult celiac disease: Do patients require long-term enzyme
supplementation? // Dig Dis Sci. 2010; 55 (10): 2999–3004. -
Leeds J. S., Hopper A. D., Hurlstone D. P., Edwards S. J., McAlindon
M. E., Lobo A. J. et al. Is exocrine pancreatic insufficiency in adult
coeliac disease a cause of persisting symptoms? // Aliment Pharmacol Ther.
2007; 25 (3): 265–271.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







