Содержание статьи
Эффективность патогенетически обоснованной терапии бесплодия у пациенток с надпочечниковой гиперандрогенией и нормальной массой тела
Е. И. Манухина, кандидат медицинских наук, доцент
М. А. Геворкян, доктор медицинских наук, профессор
Е. М. Кузнецова
ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
Многочисленными исследованиями показана важная роль надпочечниковой гиперандрогении (НГА) в нарушении репродуктивной функции, что проявляется ранними потерями беременности и/или бесплодием [1, 4]. Такие пациентки составляют гетерогенную группу, поскольку нет унифицированной схемы патогенеза гиперпродукции андрогенов в надпочечниках. На сегодня изучены две основные причины усиления синтеза андрогенов в надпочечниках — это генетически обусловленный дефицит ферментов стероидогенеза, в частности при врожденной дисфункции коры надпочечников (ВДКН), и нарушение нейроэндокринной регуляции гипоталамо-гипофизарно-надпочечниковой системы при метаболическом синдроме (МС). Более того, избыточная продукция андрогенов в надпочечниках может быть и у больных с синдромом поликистозных яичников (СПКЯ), т. е. речь идет о смешанном генезе гиперандрогении. При этом подчеркивается, что основным источником андрогенов являются поликистозные яичники. Повышенный уровень 17-гидроксипрогестерона (17-ОНП) и дегидроэпиандростерон-сульфата (ДГЭА-С) — андрогена, преимущественно синтезируемого в надпочечниках, отмечен более чем у 50% пациенток с СПКЯ [2, 10]. Была выдвинута гипотеза, что причиной гиперандрогении у некоторых пациенток с нормальной массой тела с СПКЯ является усиление стероидогенеза путем активации цитохрома Р450с17альфа — ключевого в биосинтезе андрогенов, который происходит по единому механизму, как в яичниках, так и в надпочечниках [3, 11]. Таким образом, «изолированная» НГА наблюдается не так часто.
В последние годы для диагностики ВДКН значительное место отводится пробе с адренокортикотропным гормоном (АКТГ). Этот тест, по мнению большинства исследователей, является «золотым стандартом» в диагностике НГА, в частности ВДКН, но не может быть использован в широкой клинической практике. Поэтому выявление клинических, эхографических и эндокринно-метаболических особенностей у пациенток с НГА позволит повысить эффективность терапии, направленной на восстановление генеративной функции.
Цель исследования — разработка методов диагностики и дифференцированной патогенетически обоснованной терапии, направленной на восстановление репродуктивного здоровья у больных с НГА и нормальной массой тела.
Материалы и методы исследований
Проведено обследование 89 пациенток с НГА и нормальной массой тела (индекс массы тела меньше 25) в возрасте от 23 до 35 лет, средний возраст составил 27,5 + 2,5 года. Обязательным критерием включения было повышение в крови концентраций 17-ОНП — биохимического маркера НГА по сравнению с группой контроля. Группу контроля составили 20 практически здоровых женщин репродуктивного возраста с нормальной массой тела, средний возраст — 26,9 ± 3,0 лет.
При общеклиническом исследовании тщательно изучали жалобы и данные анамнеза, которые позволили предположить причины НГА.
При осмотре пациенток оценивали тип телосложения, степень развития вторичных половых признаков гирсутизма и других клинических проявлений гиперандрогении (акне, алопеция).
Исследование гормонов в сыворотке крови проводилось у всех обследованных пациенток на 2–3 день цикла после самостоятельной или индуцированной гестагенами менструации цикла и включало определение гонадотропных гормонов — лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), а также пролактина, общего тестостерона, эстрадиола, прогестерона, 17-ОНП, ДГЭА-С, кортизола, инсулина иммунохемилюминисцентным методом на автоматическом анализаторе ACS 180.
Пробу с дексаметазоном (ДМ) проводили для выявления смешанной овариально-надпочечниковой гиперандрогении (ОНГА): определяли концентрации 17-ОНП, тестостерона и ДГЭА-С до и после приема ДМ в дозе 0,5 мг каждые 6 часов в течение 2 суток (всего 4 мг).
Пробу с Синактеном депо проводили также с целью дифференциальной диагностики источников гиперандрогении. Синактен депо в дозе 1 мг вводили в 8–9 часов утра внутримышечно, через 24 часа определяли уровни 17-ОНП, ДГЭА-С, тестостерона. Повышение уровня 17-ОНП, ДГЭА-С, тестостерона не менее чем в 6–8 раз служило дифференциально-диагностическим критерием в пользу НГА [8, 12], не менее чем в 5 раз — овариально-надпочечениковой гиперандрогении.
Диагностику инсулинорезистентности проводили с помощью глюкозотолерантного теста, при котором определяли концентрацию инсулина и глюкозы натощак и после приема 75 г глюкозы через 2 часа перорально. Концентрацию глюкозы в капиллярной крови определяли глюкозооксидазным методом экспресс-анализа на портативном глюкометре.
Ультразвуковое исследование органов малого таза производили при помощи аппарата Combison с использованием трансабдоминального и трансвагинального датчиков с частотой 3,5, 5,0 и 7,0 МГц.
Лапароскопию проводили 35 из обследованных больных по общепринятой методике.
Результаты исследования и их обсуждение
Основной мотивацией обращения у всех пациенток с НГА явилось нарушение генеративной функции: невынашивание беременности (22,5%), вторичное бесплодие (16,3%), первичное бесплодие (51,3%). Нарушение менструального цикла отмечено у 91,3% пациенток, избыточное оволосение — у 87,5%.
Из анамнеза выяснили, что у всех обследованных больных частота перенесенных нейроинфекций и других экстрагенитальных заболеваний не выше, чем у женщин контрольной группы, что больше указывает на роль генетических факторов в дисрегуляции активности ферментов, участвующих в синтезе андрогенов.
Нарушение менструального цикла по типу олигоменореи с возраста менархе отмечено у большинства пациенток с нормальной массой тела (44,7%). Характер нарушения менструальной функции и время его появления с возраста менархе являются важным клиническим критерием СПКЯ и отмечены многими авторами [1, 2, 10]. Поскольку в исследование были включены пациентки с биохимическими критериями НГА, то эти данные косвенно свидетельствуют о смешанном генезе гиперандрогении.
Нарушения генеративной функции у большинства обследованных пациенток с нормальной массой тела характеризовались первичным бесплодием (63,8%) и невынашиванием беременности ранних сроков (25,5%).
Интерес представляют пациентки с нормальной массой тела (12,8%), у которых на фоне олигоменореи, что является отражением ановуляции, были беременности без стимуляторов овуляции, которые закончились самопроизвольным прерыванием в I триместре. Ранее полагали, что у пациенток с СПКЯ не может быть овуляции и беременности, т. е. для них характерно первичное ановуляторное бесплодие. Однако в работах последних лет показано, что у некоторых пациенток с СПКЯ (так называемые «овулирующие» поликистозные яичники) могут быть беременности, но чаще они заканчиваются ранним выкидышем [6].
Гирсутизм пациентки отмечали с пубертатного периода, а степень выраженности гирсутизма по результатам настоящего исследования не коррелировала с уровнем общего тестостерона в крови, что согласуется с результатами других исследований [11].
Таким образом, результаты клинического обследования позволили выявить у 51,1% пациенток с нормальной массой тела нарушение менструального цикла, гирсутизм, первичное бесплодие с периода менархе, что может косвенно указывать на наличие у них СПКЯ. В 48,9% наблюдений были выявлены клинические признаки, характерные для ВДКН.
При трансвагинальной эхографии у 51,1% выявлены поликистозные яичники (ПКЯ): увеличение их объема в среднем до 18,6 ± 1,4 см3. При этом использовали общепринятые критерии диагностики СПКЯ [2, 10]. По мнению большинства исследователей, точность трансвагинальной эхографии в диагностике СПКЯ составляет до 96% [7, 10].
Таким образом, полученные данные не могут указывать на происхождение надпочечниковой гиперандрогении, но выявление поликистозных яичников свидетельствует о дополнительном источнике андрогенов, т. е. о смешанном генезе гиперандрогении у 51,1% пациенток.
Гормональные исследования. Известно, что основным маркером НГА при ВДКН является 17-ОНП [7], а среди пациенток с СПКЯ примерно у каждой третьей имеет место смешанная ОНГА [11, 12]. Поэтому более детально проанализированы результаты гормональных исследований по этому показателю и данным эхографии (рис.).
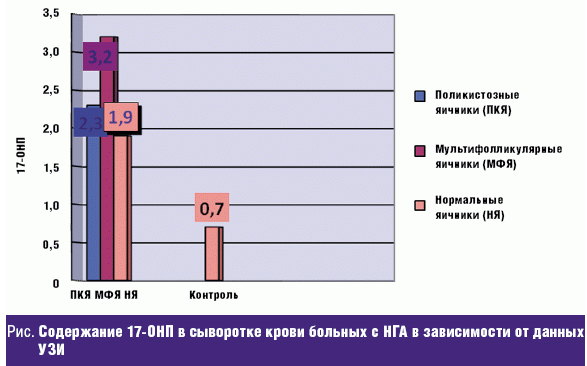
Как видно из представленных данных, у пациенток с мультифолликулярными яичниками (МФЯ), выявленными при эхографии, достоверно более высокие концентрации 17-ОНП, что может косвенно указывать на ВДКН. У пациенток с ПКЯ также достоверно более высокие концентрации 17-ОНП по сравнению с контролем, но ниже, чем у пациенток с МФЯ. Повышенные уровни 17-ОНП при СПКЯ закономерны, поскольку этот метаболит является предшественником в биосинтезе овариальных андрогенов. У нормально овулирующих пациенток содержание в крови 17-ОНП было достоверно выше по сравнению с контрольной группой. Полученные данные диктуют проведение у этих пациенток гормональных проб для выявления или исключения неклассических форм ВДКН.
С целью выявления источника гиперпродукции андрогенов проводили гормональные пробы с дексаметазоном и АКТГ (Синактен депо), суммарные результаты которых, по мнению ряда исследований, повышают диагностическую значимость [9]. Результаты гормональных исследований (табл. 1) и функциональных проб (табл. 2) показали, что гиперандрогения была представлена не только надпочечниковой (48,9%), но и смешанной — овариально-надпочечниковой (51,1%). У всех обследованных пациенток уровни 17-ОНП, ДГЭА-С, тестостерона были достоверно выше, чем в группе контроля (p > 0,05).
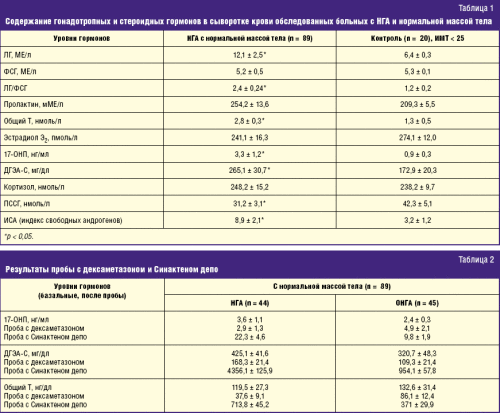
Анализ результатов исследования уровней гонадотропинов показал, что у всех пациенток с ОНГА (при врожденной дисфункции коры надпочечников уровень ЛГ не может быть высоким) концентрации ЛГ были достоверно выше, чем в контрольной группе. Данный факт свидетельствует о том, что, независимо от причины ОНГА, у большинства пациенток имеются признаки нарушения гонадотропной, а следовательно, и овариальной функции, что подтверждают другие исследователи [7].
Известно, что большинство пациенток с гиперандрогенией инсулинорезистентны независимо от сопутствующего ожирения [4]. У всех инсулинорезистентных больных достоверно выше были концентрации общего тестостерона, что является следствием усиления продукции андрогенов в результате как непосредственного действия инсулина путем усугубления ЛГ-зависимого синтеза тестостерона в поликистозных яичниках, так и опосредованного в результате подавления продукции полового стероидсвязывающего глобулина (ПССГ) в печени, что приводит к повышению биологической активности тестостерона [3].
Метаболические исследования с определением концентраций инсулина и глюкозы натощак и в процессе проведения глюкозотолерантного теста выявили инсулинорезистентность у 9% (n = 4) больных с ВДКН и у 40,3% (n = 18) с СПКЯ, что согласуется с результатами других исследований [4].
Всем пациенткам с НГА было проведено генетическое исследование на предмет выявления наиболее частых мутаций гена CYP21 методом аллель-специфической ПЦР (CYP1/CYP21, P30L, 12spl, E3del, 1172N, кластер E6, V281L, Q318X, R356W, P453S) в лаборатории Центра иммунологии и репродукции (г. Москва). У всех пациенток данной группы были выявлены мутации гена СYP21, характерные для ВДКН. У подавляющего большинства больных 82% (n = 36) определялась мутация V281L.
Диагностика гиперандрогении, в частности выявление причины формирования надпочечниковой гиперпродукции андрогенов, представляет определенные трудности. На сегодня наиболее точный тест для диагностики НГА является проба с АКТГ, а яичниковой — проба с агонистом гонадотропин-рилизинг-гормона (аГнРГ) при одновременном подавлении функции яичников и надпочечников соответственно, что не доступно для широкого использования в практике [9]. Поэтому были проанализованы представленные выше результаты проведенного комплекса клинико-лабораторных исследований для выявления дифференциально-диагностических критериев различных форм НГА, которые позволили определить источник гиперандрогении у пациенток с нормальной массой тела — ВДКН (48,9%) и СПКЯ (51,1%).
На основании полученных результатов разработана дифференцированная патогенетически обоснованная терапия, направленная на снижение синтеза андрогенов и восстановление генеративной функции.
У инсулинорезистентных пациенток с нормальной массой тела единственным методом повышения чувствительности к инсулину является терапия метформином, которую проводили в течение 6 мес с положительным эффектом.
Вторым этапом пациенткам с ВДКН назначали метипред (в дозе 4 мг в сутки), который является патогенетически обоснованным методом лечения. При наступлении беременности продолжали терапию метипредом под контролем 17-ОНП. Применение глюкокортикоидов у пациенток с СПКЯ не оправдано, т. к. повышенный синтез андрогенов происходит за счет гиперактивности 17-альфа-гидроксилазы и не решает проблемы, а, наоборот, способно только усугубить имеющуюся при СПКЯ инсулинорезистентность [5, 13]. Всем пациенткам с СПКЯ и нормальной массой тела проводили стимуляцию овуляции кломифеном. При отсутствии беременности следующим этапом рекомендовали лапароскопию.
В результате комплексной поэтапной терапии у большинства пациенток наступила беременность.
Суммарная эффективность комплексного лечения, направленного на восстановление генеративной функции у больных с НГА, составила 81,2%. Частота невынашивания беременность была не выше, чем в популяции, — 3,8%.
Таким образом, можно заключить, что патогенетическое лечение нарушений функции надпочечников улучшило результаты различных методов стимуляции овуляции, направленных на восстановление генеративной функции. Кроме того, эффективность комплексной терапии выше при НГА (ВДКН) по сравнению с пациентками с овариально-надпочечниковой гиперандрогенией (СПКЯ), что свидетельствует о более выраженных нарушениях репродуктивной функции у больных со смешанным генетически обусловленным генезом гиперандрогении.
Литература
- Балаболкин М. И., Клебанова Е. М., Креминская В. М. Дифференциальная диагностика и лечение эндокринных заболеваний (руководство). М.: Медицина, 2002. 751 с.
- Геворкян М. А. Эндокринно-метаболические и молекулярно-биологические факторы в восстановлении репродуктивного здоровья у женщин с синдромом поликистозных яичников. Автореф. дис. докт. мед. наук. М., 2001.
- Гончаров Н. П., Колесникова Г. С. Кортикостероиды: метаболизм, механизм действия и клиническое применение. М., 2002. С. 2–40.
- Манухин И. Б., Геворкян М. А., Чагай Н. Б. Ановуляция и инсулинорезистентность. М., 2006. С. 24–99.
- Мельниченко Г. А., Семичева Т. В., Фадеев В. В., Чеботникова Т. В. Применение глюкокортикоидов во время беременности // Вестник репродуктивного здоровья. 2008, 7, с. 7–17.
- Сидельникова В. М. Привычная потеря беременности. М., 2002. 304 с.
- Чагай Н. Б., Фадеев В. В. Сложности дифференциальной диагностики и терапии неклассической формы врожденной дисфункции коры надпочечников у пациенток репродуктивного возраста // Проблемы репродукции. 2009, 3, с. 93–98.
- Azziz R., Carmina E., Dewailly D. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hiperandrogenic syndrome: an androgen Excess Society guideline // J Clin Endocrinol. 2006, 91, p. 4237–4245.
- Azziz R., Hincapite L. А., Knochenhauer E. S., Dewailly D., Fox L., Boots L. R. Screening for 21-hydroxylase-deficient nonclassic adrenal hyperplasia among hyperandrogenic women: а prospective study // Fertility and Sterility. 1999, 72, p. 915–925.
- Homburg R. Diagnosis and management of polycystic ovary syndrome // Springer US. 2009, p. 238.
- Marcondes J. A. Hirsutism: differential diagnosis // Arq Bras Endocrinol Metabol. 2006, 50 (6), p. 1108–1116.
- New M. I. Nonclassical 21-hidroxylase deficiency // J. Clin. Endocrinol. Metab. 2006, 91, 11, р. 4205–4214.
- Van den Akker E. S., Stikkelbroeck M. M., Menheere P. P. Sucsessful treatment and pregnancy in a wemen with non-classic form of congenital adrenal hyperplasia // Ned Tijdschr Geneeskd. 2002, 146 (6), p. 246–249.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru