Ревматология
Ключевые слова: оптиконевромиелит, синдром Девика, аутоиммунная патология, системная красная волчанка, антитела к аквапорину-4, аквапорин-ассоциированные синдромы, демиелинизирующие заболевания центральной нервной системы.
Для цитирования: Виноградова Е.С., Новиков П.И., Моисеев С.В. Оптиконевромиелит (синдром Девика) — редкий вариант поражения нервной системы при системной красной волчанке // РМЖ. 2018. №122. С. 103-106
E.S. Vinogradova1, P.I. Novikov2, S.V. Moiseev1,2
1 Faculty of Fundamental Medicine of the Moscow State University, Moscow
2 Tareev Clinic of Nephrology, Internal and Occupational Diseases, University Clinical Hospital No.3,
Sechenov University, Moscow
Neuromyelitics optica or Devic’s syndrome is an inflammatory demyelinating disease of the central nervous system, affecting mainly the optic nerve and spinal cord. In 50–70% of cases, association with systemic diseases of the connective tissue, such as systemic lupus erythematosus, Sjogren disease, and others, is determined. In this case, the question of the secondary nature of the disease remains open. The clinical picture is characterized by a combination of optic neuritis syndromes and/or longitudinal-transverse myelitis. Imaging methods are used for diagnostics, such as optical coherence tomography, event-related potentials method, magnetic resonance imaging. At present, the key method of making the correct diagnosis is the detection of a specific serological marker — antibodies to aquaporin-4 (NMO-IgG), the titer of which correlates with disease activity and helps the differential diagnosis. Detection of Devic’s syndrome in combination with rheumatic diseases determines the tactics of more active immunosuppressive treatment. The article describes the clinical case of a young patient with systemic lupus erythematosus and Devic’s syndrome. The prognosis and severity of the disease determined the presence of neuromyelitics optica. As induction therapy, ultrahigh doses of glucocorticosteroids, cyclophosphamide replaced with azathioprine as a supportive treatment with a positive clinical and laboratory response were used.
Key words: neuromyelitics optica, Devic’s syndrome, autoimmune pathology, systemic lupus erythematosus, antibodies to aquaporin-4, aquaporin-associated syndromes, demyelinating diseases of the central nervous system.
For citation: Vinogradova E.S., Novikov P.I., Moiseev S.V. Neuromyelitics optica (Devic’s syndrome) is a rare variant of the nervous system impairment in systemic lupus erythematosus // RMJ. 2018. № 12(II). P. 103–106.
В статье приводится описание клинического случая молодой пациентки с системной красной волчанкой и синдромом Девика (оптиконевромиелит)
Оптиконевромиелит (ОМ) относится к группе воспалительных демиелинизирующих заболеваний центральной нервной системы (ЦНС) и является вторым по частоте после рассеянного склероза. При ОМ очаги воспаления и повреждения миелина затрагивают почти исключительно оптический нерв и спинной мозг (поперечный миелит на уровне грудных, реже — шейных сегментов). ОМ чаще встречается у лиц африканского и азиатского происхождения. Распространенность ОМ среди европеоидов составляет 0,3–4,4 человека на 100 000 населения. Возраст дебюта варьирует со снижением заболеваемости после 50 лет. Женщины болеют гораздо чаще (85% случаев), чем мужчины. Довольно часто ОМ (50–70%) сочетается с другими аутоиммунными заболеваниями — синдромом Шегрена, системной красной волчанкой (СКВ), аутоиммунным тиреоидитом и др. [1].
В 1894 г. E. Devic и его ученик F. Gault предложили выделить ОМ в отдельную нозологическую форму, при которой очаги воспаления и повреждения миелина затрагивали главным образом оптический нерв и спинной мозг (поперечный миелит на уровне грудных, реже — шейных сегментов) [2]. В 2004 г. V. Lennon et al. была доказана аутоиммунная природа болезни путем обнаружения сывороточных аутоантител NMO-IgG (neuromyelitis optica — Immunoglobulin G). В настоящее время ОМ — единственное демиелинизирующее заболевание, при котором выявлен специфический биомаркер. В основе патогенеза заболевания лежит селективная связь NMO-IgG с аквапорином-4, одним из основных белков водных каналов ЦНС, локализующихся в ножках астроцитов, образующих гематоэнцефалический барьер (ГЭБ). Наибольшая концентрация аквапорина-4 в ЦНС отмечена в сером веществе спинного мозга, гипоталамусе, перивентрикулярных областях. Это приводит к развитию воспалительной реакции, активации системы комплемента, повышенной продукции воспалительных цитокинов (интерлейкинов ИЛ-17, ИЛ-8, гранулоцитарного колониестимулирующего фактора). Нарушение клеточных механизмов транспорта воды, повреждение ГЭБ и активная инфильтрация периваскулярного пространства нейтрофилами и эозинофилами способствуют развитию демиелинизации, сосудистой гиперплазии с гиалинизацией стенок капилляров, некрозу олигодендроцитов и нейронов и образованию специфических полостей как в белом, так и в сером веществе спинного мозга (рис. 1). Описанные особенности морфологических изменений в спинном мозге могут напоминать аутоиммунное воспаление, протекающее по типу васкулита [3].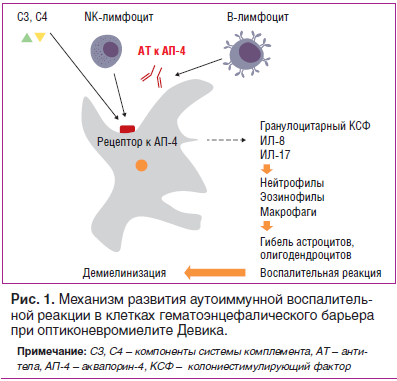
Клиническая картина характеризуется сочетанием синдромов оптического неврита и продольно-поперечного миелита (табл. 1). Типичными симптомами миелита выступают мышечная слабость, спастичность, дискоординация, атаксия, симптом Лермитта (ощущение удара током при сгибании шеи), задержка мочи, вегетативная дисфункция, возможны расстройства ниже уровня поражения спинного мозга. Поражения зрительных нервов и спинного мозга в некоторых случаях возникают одновременно, но чаще — с интервалом, который может составлять месяцы, годы и даже десятилетия. Симптоматика нарастает в течение нескольких дней, а регрессирует неделями и месяцами, зачастую с сохранением остаточного неврологического дефицита.

Для диагностики оптического неврита используются оптическая когерентная томография (показывает истончение ретинальных волокон), вызванные потенциалы (замедление проведения по данным зрительных вызванных потенциалов вплоть до полного отсутствия ответа), магнитно-резонансная томография (МРТ) (в острую фазу может наблюдаться отечность зрительного нерва и накопление им контрастного вещества).
МРТ спинного мозга, выполненная в острую фазу миелита, позволяет выявить обширный непрерывный очаг поражения спинного мозга, который распространяется по длиннику более чем на 3 позвоночных сегмента, однако отсутствие очага или короткие очаги (менее 2 сегментов) могут определяться в периоды ремиссий или в отдаленные периоды заболевания, когда формируется атрофия спинного мозга.
При МРТ головного мозга на начальных стадиях заболевания нормальная картина наблюдается у 55–84% пациентов с ОМ, однако возможно появление очагов в белом веществе при развитии заболевания (рис. 2) [5]. Церебральные очаги по своей локализации имеют предрасположенность к тем участкам головного мозга, где отмечается высокий уровень иммунореактивности к аквапорину-4 (гипоталамус, ствол головного мозга, III и IV желудочки) [6].
![Рис. 2. МРТ головного (A-D) и спинного (E, F) мозга: A, B, E — острая фаза воспаления; C, D, F — ремиссия [5] Рис. 2. МРТ головного (A-D) и спинного (E, F) мозга: A, B, E — острая фаза воспаления; C, D, F — ремиссия [5]](https://medblog.su/wp-content/uploads/2018/12/1545086709_981_optikonevromielit-sindrom-devika-redkij-variant-porazheniya-nervnoj-sistemy-pri-sistemnoj-krasnoj-volchanke-vinogradova-e-s-novikov-p-i-moiseev-s-v.png)
Ключевым методом диагностики является обнаружение серологического маркера — антител к аквапорину-4 (NMO-IgG), чувствительность 75%, специфичность 85–99%. Уровень антител к аквапорину-4 коррелирует с активностью заболевания и снижается при иммуносупрессивной терапии и остается низким в течение ремиссии. Показана корреляция титра антител с тяжестью зрительных нарушений [3].
Прогноз заболевания серьезный, вплоть до инвалидизации и летального исхода. При своевременной и адекватной терапии возможно достижение длительных ремиссий, пятилетняя выживаемость при ОМ повышается с 68 до 91%.
В настоящее время общепринятого стандарта лечения синдрома Девика нет. Одним из вариантов лечения является применение препаратов, частично блокирующих В-клетки, таких как ритуксимаб. Для лечения атаки миелита и оптического неврита применяют высокие дозы кортикостероидов. Наряду с этим эффективно использование и плазмафереза. Эффективность превентивной иммуномодулирующей терапии у пациентов с ОМ формально не изучена. Терапией выбора считают комбинацию преднизолона и азатиоприна [7].
Клиническое наблюдение
Приводим собственное клиническое наблюдение больной оптиконевромиелитом Девика, ассоциированным с СКВ (см. рис. 3).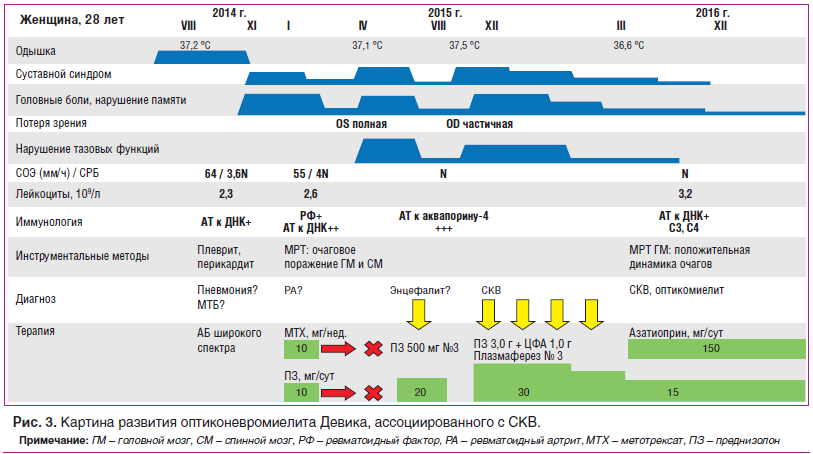
Больная К., 28 лет, домохозяйка.
В течение 2013–2014 гг. в связи с эпизодами субфебрилитета, одышкой, персистирующими рентгенологическими признаками нижнедолевой инфильтрации слева, устойчивыми к антибактериальной терапии широкого спектра, наблюдалась и получала противотуберкулезную химиотерапию в противотуберкулезном диспансере Хабаровска. Результаты многочисленных бактериологических исследований, полимеразно-цепной реакции, бронхо-альвеолярного лаважа и кожных туберкулиновых проб (диаскин-тест) были отрицательными на протяжении всего периода наблюдения. В августе 2014 г. — левосторонний плеврит, перикардит, лейкоцитопения до 2,3×109/л, повышение маркеров острофазового воспаления (скорость оседания эритроцитов (СОЭ) 52–64 мм/ч, содержание С-реактивного белка (СРБ) 3,5N), впервые выявлены антитела к нативной ДНК. В ноябре 2014 г. возникли жалобы на головные боли, боли при пальпации и движении, ограничение подвижности в шейном отделе позвоночника, боли в верхнем плечевом поясе, артриты мелких суставов кистей рук. В январе 2015 г. при обследовании: ревматоидный фактор (РФ)+, антитела к нативной ДНК 10N, лейкоцитопения 2,6×109/л, СОЭ 55 мм/ч, СРБ 4N. Состояние расценено как ревматоидный артрит, проводилась пульс-терапия глюкокортикоидами, далее назначен преднизолон 10 мг/сут, метотрексат 10 мг/нед. с положительным эффектом. В феврале 2015 г. самостоятельно прекратила прием глюкокортикоидов и метотрексата, на фоне чего отметила внезапное выпадение нижней половины поля зрения, а затем полную потерю зрения на левый глаз. В марте 2015 г. при МРТ-исследовании головного мозга патологии не выявлено.
В апреле 2015 г. была госпитализирована с диагнозом «энцефалопатия неясной этиологии». Объективно: сознание нарушено до степени заторможенности, ригидность затылочных мышц, координационные пробы не выполняет, нарушение функции тазовых органов (задержка мочи). МРТ головного мозга: в белом веществе лобных, теменных, височных долей выявлены множественные очаги измененного МР-сигнала (гиперинтенсивные в режиме Т2 и FLAIR, изо- и гипоинтенсивные в режиме Т1), полигональной формы с нечеткими и неровными контурами, сливного характера, размерами от 0,3 до 3,0 см. При постконтрастном исследовании: 2 супратенториальных очага (в левой лобной доле), минимально накапливающих контраст в виде небольших очагов на периферии. МРТ шейного, поясничного отделов спинного мозга: множественные интрамедуллярные зоны гиперинтенсивного характера протяженностью 5–13 мм. Анализ ликвора: цитоз 12/мм3 (нейтрофилы 5, лимфоциты 7), глюкоза 2,8 ммоль/л, общий белок 0,8 г/л. В лейкоцитарной формуле: лейкопения, лимфопения, значительный моноцитоз. Антитела к вирусу Эпштейна — Барр IgM, антитела к Herpes simplex IgM, антитела к кардиолипинам не обнаружены. Проведена пульс-терапия метилпреднизолоном, далее назначен преднизолон в дозе 20 мг/сут с положительным эффектом в виде постепенного восстановления памяти, функции тазовых органов. В августе 2015 г. на фоне отмены глюкокортикоидов отметила снижение остроты зрения справа, снижение чувствительности нижних конечностей, головные боли, возникли артриты мелких суставов кистей рук. Осмотр окулиста: полная атрофия зрительного нерва слева, нисходящая частичная атрофия справа, миопия средней степени. Антитела к аквапорину-4 (NMO) выявлены в высоком титре 1:320 (N
Таким образом, представленное наблюдение демонстрирует редкий вариант поражения ЦНС при системной красной волчанке. Остается открытым вопрос, следует ли рассматривать развитие ОМ в качестве самостоятельной нозологической формы или как проявление основного заболевания, в нашем случае системной красной волчанки. С одной стороны, наличие специфических антител (NMO-IgG) и возможное ухудшение течения ОМ вне контекста системных проявлений являются аргументами в пользу нозологической самостоятельности этой патологии. С другой стороны, эффективность контроля активности основного заболевания и проявлений ОМ, совпадение периодов обострения ОМ с системными проявлениями, однонаправленные изменения иммунологических маркеров ОМ и СКВ позволяют трактовать ОМ у нашей пациентки как вторичный. Важно, что определение титра NMO-IgG помогает контролировать активность болезни. Так, уровень антител к аквапорину-4 снижается и остается низким в течение ремиссии. Хороший ответ на лечение позволяет рассчитывать на длительный контроль активности при сохранении приверженности терапии.
Литература
1. Аутоиммунные заболевания в неврологии: Клиническое руководство / под ред. И.А. Завалишина и др. Т.1. М., 2014 [Autoimmunny`e zabolevaniya v nevrologii: Klinicheskoe rukovodstvo / рod red. I.A. Zavalishina i dr. T.1. M., 2014 (in Russian)].
2. Maticlo M., Weinshshenker B. Neuromyelitis optica // Multiple sclerosis. 2010. P.258–275.
3. Lennon V.A., Kryzer T.J., Pittock S.J. et al. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel // J Exp Med. 2005. Vol. 202. P.473–477.
4. Мироненко Т.В., Хубетова И.В. Оптикомиелит (болезнь Девика). Научный обзор и собственное клиническое наблюдение // Международный неврологический журнал. 2015. T.1(71). C.141–147 [Mironenko T.V., Xubetova I.V. Optikomielit (bolezn` Devika). Nauchny`j obzor i sobstvennoe klinicheskoe nablyudenie // Mezhdunarodny`j nevrologicheskij zhurnal. 2015. T.1(71). C.141–147 (in Russian)].
5. Kitley J., Woodhall M., Waters P. et al. Myelin-oligodendrocyte glycoprotein antibodies in adults with a neuromyelitis optica phenotype // Neurology. 2012. Vol. 79(12). P.1273-1277. DOI: 10.1212/WNL.0b013e31826aac4e.
6. Симанив Т.О., Воробьёва А.А., Смирнова Н.В. и др. Оптикомиелит и аквапорин-ассоциированные синдромы // Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. №2(2). С.31–37 [Simaniv T.O., Vorob`yova A.A., Smirnova N.V. i dr. Optikomielit i akvaporin-associirovanny`e sindromy` // Zhurnal nevrologii i psixiatrii im. S.S. Korsakova. 2015. №2(2). S.31–37 (in Russian)].
7. Marios C. Papadopoulos, Jeffrey L. Bennett, Alan S. Verkman. Treatment of neuromyelitis optica: state-of-the-art and emerging therapies // Nature Reviews Neurology. 2014. Vol. 10. P.493–506.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Предыдущая статья
Следующая статья
Информация с rmj.ru